![]() — Все документы — ГОСТы — ГОСТ 34106-2017 ПРОДУКЦИЯ ПИЩЕВАЯ И СЫРЬЕ. МЕТОД СЕКВЕНИРОВАНИЯ ФРАГМЕНТОВ МИТОХОНДРИАЛЬНОГО ГЕНОМА ЖИВОТНЫХ И РЫБ ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВОЙ ПРИНАДЛЕЖНОСТИ В ОДНОКОМПОНЕНТНОЙ ПРОДУКЦИИ
— Все документы — ГОСТы — ГОСТ 34106-2017 ПРОДУКЦИЯ ПИЩЕВАЯ И СЫРЬЕ. МЕТОД СЕКВЕНИРОВАНИЯ ФРАГМЕНТОВ МИТОХОНДРИАЛЬНОГО ГЕНОМА ЖИВОТНЫХ И РЫБ ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВОЙ ПРИНАДЛЕЖНОСТИ В ОДНОКОМПОНЕНТНОЙ ПРОДУКЦИИ
ГОСТ 34106-2017 ПРОДУКЦИЯ ПИЩЕВАЯ И СЫРЬЕ. МЕТОД СЕКВЕНИРОВАНИЯ ФРАГМЕНТОВ МИТОХОНДРИАЛЬНОГО ГЕНОМА ЖИВОТНЫХ И РЫБ ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВОЙ ПРИНАДЛЕЖНОСТИ В ОДНОКОМПОНЕНТНОЙ ПРОДУКЦИИ
Добавил:
Дата: [18.01.2019]
Food and raw materials. Sequencing of the mitochondrial genomes of animals and fish for species identification in single component products
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2015 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 Разработан Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ")
2 Внесен Федеральным агентством по техническому регулированию и метрологии
3 Принят Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 1 июня 2017 г. N 51)
За принятие проголосовали:
|
Краткое наименование страны по MК (ИСО 3166) 004-97 |
Код страны по МК (ИСО 3166) 004-97 |
Сокращенное наименование национального органа по стандартизации |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
|
Узбекистан |
UZ |
Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 19 июля 2017 г. N 724-ст межгосударственный стандарт ГОСТ 34106-2017 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2018 г.
5 Введен впервые
Настоящий стандарт распространяется на однокомпонентную пищевую продукцию и сырье из мяса животных, рыбы, икры и устанавливает метод определения видовой принадлежности секвенированием фрагмента митохондриального генома.
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019-79* Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
──────────────────────────────
* В Российской Федерации действует ГОСТ Р 12.1.019-2009.
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.131-83 Халаты женские. Технические условия
ГОСТ 12.4.132-83 Халаты мужские. Технические условия
ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3164-78 Масло вазелиновое медицинское. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9805-84 Спирт изопропиловый. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26678-85 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
ГОСТ 28311-89 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
ГОСТ 31719-2012 Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный)
ГОСТ IEC 60335-2-25-2014 Безопасность бытовых и аналогичных электрических приборов. Часть 2-25. Частные требования к микроволновым печам, включая комбинированные микроволновые печи
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
В настоящем стандарте применены следующие термины с соответствующими определениями.
3.1 алгоритм BLAST: Алгоритм поиска родственных нуклеотидных или аминокислотных последовательностей в базах данных.
Примечание - В настоящем стандарте под базами данных подразумеваются базы данных GenBank, EMBL и DDBJ, доступные через поисковой интернет-ресурс www.ncbi.nlm.nih.gov, содержащие охарактеризованные последовательности НК организмов различных видов и доступные пользователям на безвозмездной основе.
3.2 амплификатор: Автоматический прибор, выполняющий необходимые для ПЦР циклы нагрева и охлаждения с заданными условиями.
3.3 амплификация ДНК: Процесс, многократно увеличивающий число копий фрагмента генома какого-либо организма.
3.4 буферный раствор: Реакционная среда, содержащая различные компоненты, в том числе ионы Mg2+, необходимые для поддержания оптимальной активности и стабильности фермента.
3.5 выравнивание нуклеотидных последовательностей: Процесс сопоставления сравниваемых последовательностей до такого их взаиморасположения, при котором наблюдается максимальное количество совпадений нуклеотидов.
3.6 дезоксирибонуклеаза: Фермент, разрушающий ДНК.
3.7 денатурация ДНК: Процесс, в результате которого двухцепочечная ДНК разделяется на одноцепочечные.
3.8 ДНК-полимераза: Термостабильный фермент (ДНК-зависимая ДНК-полимераза), катализирующий циклический синтез ДНК.
3.9 идентификация: Процесс определения принадлежности микроорганизма к определенному таксону.
3.10 идентичность: Отношение количества совпадающих оснований в выровненных позициях двух нуклеотидных последовательностей к общему количеству выровненных позиций, выраженное в процентах.
3.11 лабораторная проба: Проба, предназначенная для лабораторных испытаний.
3.12 мастер-микс: Смесь реагентов, необходимых для амплификации ДНК в ПЦР, включающая специфические праймеры и дНТФ.
3.13 матрица: Одноцепочечная НК, комплементарная синтезируемой цепи ДНК, определяющая последовательность нуклеотидов в синтезируемой цепи.
3.14 нуклеиновые кислоты; НК: Макромолекулы, являющиеся носителями генетической информации или выступающие в качестве посредника при синтезе полипептидной цепи.
3.15 нуклеотидная последовательность: Порядок чередования нуклеотидных остатков в НК.
3.16 очистка ДНК: Процесс обработки выделенной ДНК, позволяющий повысить ее чистоту с целью снижения ингибирования реакции ПЦР.
3.17 отжиг: Гибридизация праймера с комплементарной последовательностью нуклеиновых кислот в заданных условиях.
3.18 отрицательный контрольный образец; ОКО: Раствор, используемый вместо анализируемой пробы для контроля чистоты выделения ДНК.
3.19 отрицательный контроль ПЦР; К-: Реакционная смесь для проведения ПЦР, заведомо не содержащая целевой нуклеиновый материал.
3.20 отрицательный контроль выделения (контроль чистоты выделения) Кв: Контроль, прошедший все этапы выделения ДНК, но в отсутствие анализируемой пробы.
3.21 полимеразная цепная реакция; ПЦР: Ферментативная реакция, позволяющая амплифицировать фрагмент ДНК in vitro.
3.22 положительный контроль ПЦР; К+: Реакционная смесь для проведения ПЦР, заведомо содержащая целевой нуклеиновый материал (ПКО).
3.23 положительный контрольный образец; ПКО: Раствор, содержащий определенное количество целевого нуклеинового материала для проведения ПЦР.
3.24 праймер: Олигонуклеотид с определенной длиной и последовательностью, комплементарный фрагменту аналитически значимой последовательности ДНК.
Примечание - Праймеры ограничивают целевую последовательность ДНК.
3.25 проба для анализа: Проба, подготовленная для проведения испытаний, которую полностью и единовременно используют для проведения испытания.
3.26 ПЦР-продукт: Фрагмент ДНК, амплифицированный в ПЦР.
3.27 ПЦР с горячим стартом: Активация термостабильной ДНК-полимеразы с помощью этапа прогрева перед основной программой, позволяющая избежать неспецифической амплификации.
3.28 секвенирование ДНК: Определение нуклеотидной последовательности фрагмента генома организма.
3.29 смесь дезоксинуклеозидтрифосфатов; дНТФ: Раствор, содержащий дезоксиаденозинтрифосфат, дезоксицитидинтрифосфат, дезоксигуанинтрифосфат, дезокситимидинтрифосфат, являющиеся "строительными блоками" для синтеза новых комплементарных цепей ДНК.
3.30 смесь дидезоксинуклеозидтрифосфатов; ддНТФ: Смесь производных дНТФ, у которых гидроксильная группа у третьего атома углерода дезоксирибозы замещена атомом водорода.
Примечание - Флуоресцентно-меченые ддНТФ используют при секвенировании в качестве терминаторов элонгации праймеров, так как их включение прерывает возможность дальнейшего удлинения цепи ДНК.
3.31 специфичность: Способность применяемого метода распознавать исключительно целевую последовательность и отличать ее от сходных последовательностей и загрязняющих примесей.
3.32 целевая ДНК: Выбранная для амплификации последовательность ДНК.
3.33 экстракция ДНК: Обработка анализируемой пробы, высвобождающая ДНК.
3.34 элюция: Извлечение вещества из твердого носителя вымыванием подходящим растворителем.
3.35 элонгация праймера: Ферментативная реакция, приводящая к синтезу новой цепи ДНК путем добавления одиночных дезоксирибонуклеотидов к 3'-концу праймера.
4.1 Условия выполнения испытаний
4.1.1 Общие требования, предъявляемые к компетентности испытательной лаборатории и проведению испытаний, - по ГОСТ ИСО/МЭК 17025.
4.1.2 Требования к персоналу - по ГОСТ ИСО/МЭК 17025.
4.2 Требования безопасности
4.2.1 При работе с химическими реактивами необходимо соблюдать общие требования безопасности обращения с вредными веществами, установленные ГОСТ 12.1.007.
4.2.2 Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных в ГОСТ 12.1.005.
4.2.3 При работе с электроустановками следует соблюдать требования электробезопасности, установленные в ГОСТ 12.1.019.
4.2.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004, быть оснащено средствами пожаротушения по ГОСТ 12.4.009.
5.1 При проведении испытаний оборудование следует обслуживать в соответствии с инструкциями производителя и требованиями ГОСТ ИСО/МЭК 17025.
5.2 Для проведения испытаний применяют следующие средства измерений и оборудование:
- весы электронные по ГОСТ OIML R 76-1 II (высокого) класса точности с действительной ценой деления d ≤ 0, 01 г; при взвешивании в диапазоне от 0, 02 до 50, 00 г пределом допускаемой погрешности при первичной поверке ± 4 мг, при эксплуатации - ± 5 мг;
- набор дозаторов электронных или механических медицинских лабораторных по ГОСТ 28311, с варьируемыми объемами доз;
- анализатор генетический для разделения фрагментов дезоксирибонуклеиновой кислоты (ДНК) методом капиллярного электрофореза с детекцией сигнала флюоресценции, позволяющий осуществить прочтение нуклеотидной последовательности длиной до 950 пар нуклеотидов (п. н.) с точностью не менее 98, 5 %*;
──────────────────────────────
* Примером подходящего оборудования может служить генетический анализатор "ABI PRISM 3130 Genetic Analyzer" (Applied Biosystems, США) с капиллярным блоком типа "3130/3100-Avant" Genetic Analyzer Capillary Array, 4 x 50 см (Applied Biosystems, США). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
- бокс ламинарный с классом биологической безопасности II типа А для выделения НК;
- ПЦР-бокс с бактерицидной лампой;
- амплификаторы для микропробирок вместимостью 0, 2 и 0, 6 см3 с возможностью активного регулирования температуры по раствору в пробирке;
- термостат твердотельный с диапазоном температур от 25 °С до 100 °С для микропробирок вместимостью 1, 5 см3;
- отсасыватель вакуумный медицинский с колбой-ловушкой;
- микроцентрифуги с угловым ротором для микропробирок вместимостью 1, 5 см3 со скоростью вращения до 14800 об/мин, максимальным ускорением 21100 g;
- миницентрифуги-встряхиватели с роторами для микропробирок вместимостью 0, 2; 0, 6 и 1, 5 см3, скоростью вращения не менее 2400 об/мин и максимальным ускорением до 700 g;
- холодильник бытовой электрический по ГОСТ 26678, обеспечивающий поддержание температуры от 2 °С до 8 °С, с морозильной камерой, обеспечивающий поддержание температуры не выше минус 16 °С;
- камеру для горизонтального электрофореза;
- источник питания для электрофореза постоянного тока с напряжением от 150 до 460 В;
- трансиллюминатор ультрафиолетовый с кабинетом для просмотра гелей;
- видеосистему с цифровой видеокамерой для регистрации результатов и передачи изображения;
- печь микроволновую мощностью не менее 800 Вт, соответствующую требованиям ГОСТ IEC 60335-2-25.
5.3 Для проведения испытаний применяют следующие реактивы:
а) набор реагентов для экстракции ДНК**, включающий:
1) буфер для лизирующего реагента, содержащий хаотропный агент гуанидин хлорид;
2) лизирующий реагент, содержащий протеиназу К;
3) раствор для отмывки N 1 для очистки от клеточных белков, содержащий хаотропный агент гуанидин тиоционат;
4) раствор для отмывки N 2 для очистки от солей, содержащий водный раствор изопропилового спирта;
5) сорбент (25 %-ная взвесь частиц SiO2 размером от 20 до 50 мкм в растворе Трис-HCl молярной концентрации 5 ммоль/дм3);
б) буфер для элюции ДНК (Трис-HCl молярной концентрации 10 ммоль/дм3; натриевая соль этилендиаминтетрауксусной кислоты (ЭДТА) молярной концентрации 1 ммоль/дм3);
6) растворы прямого и обратного ПЦР-праймеров молярной концентрацией 10 мкмоль/дм3 и чистотой специфического олигонуклеотида не менее 98 %, позволяющие амплифицировать фрагмент генов митохондриального генома cytB:
"Glu" 5'-AAACTAATGACATGAAAAA(C/T)CA(T/C)CGTTG-3';
"CytB"5'-CCCTCAGAATGATATTTGNCC(C/T)CA-3'.
в) "ПЦР-смесь-2"***, содержащую термостабильную ДНК-полимеразу активностью 0, 25 ед./мм3, магния сульфат MgSO4 молярной концентрации 5 ммоль/дм3; Трис-HCl молярной концентрации 66 ммоль/дм3 с рН 8, 3 ед. рН; аммония сульфат (NH4)2SO4 молярной концентрации 16, 7 ммоль/дм3; раствор "Твин-20" 0, 01 %-ный; раствор глицерина 20 %-ный; краситель крезоловый красный;
──────────────────────────────
** Примером может служить набор "ДНК-сорб С" (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, РФ). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
*** Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
г) раствор дНТФ, содержащий натриевые соли дНТФ с молярной концентрацией каждого 25 ммоль/дм3;
д) воду деионизованную, класса чистоты I, свободную от рибонуклеаз, дезоксирибонуклеаз, неорганических и органических примесей с удельным сопротивлением не менее 18 Мом·см;
е) воск для ПЦР;
ж) масло вазелиновое медицинское по ГОСТ 3164;
и) агарозу, пригодную для электрофоретического разделения ДНК;
к) трис-ацетатный электродный буфер (ТАЕ-буфер) для электрофореза (50-кратный концентрированный буферный раствор, содержащий трис-ацетат 2 моль/дм3, ЭДТА молярной концентрации 50 ммоль/дм3, рН = 8, 4 ед. рН;
л) раствор бромистого этидия концентрацией 10 мг/см3;
м) маркер молекулярных масс ДНК, содержащий фрагменты ДНК размером от 100 до 1000 п. н. концентрацией 100 нг/мм3, объемом для нанесения в лунки геля 3-5 мм3;
н) набор для очистки продуктов ПЦР*(1);
п) реагент для секвенирования ДНК*(2);
р) спирт изопропиловый по ГОСТ 9805 массовой долей основного вещества 99, 8 %;
с) воду дистиллированную по ГОСТ 6709;
т) формамид высокоочищенный деионизированный с электропроводностью в диапазоне 19-34 мкСм/см*(3);
у) полимер для капиллярного электрофореза*(4);
ф) концентрат буфера для капиллярного электрофореза*(5).
5.4 Для проведения испытаний применяют следующие посуду и материалы:
- пробирки одноразовые полипропиленовые плотно закрывающиеся градуированные вместимостью 0, 6 и 1, 5 см3;
- пробирки для ПЦР с плоской крышкой вместимостью 0, 2 см3;
- колбу коническую по ГОСТ 25336, из термостойкого стекла вместимостью 250 см3;
- мерную колбу вместимостью 2000 см3 по ГОСТ 1770;
- цилиндры мерные вместимостью 50 см3 и 250 см3 по ГОСТ 1770;
- ножницы;
- шпатели металлические;
- наконечники одноразовые универсальные для электронных или механических дозаторов с варьируемыми объемами доз;
- штативы для микропробирок и наконечников;
- планшеты 96-луночные для автоматического генетического анализатора с уплотнителем, основанием (штативом) и фиксатором*(6);
- емкости для сброса наконечников;
- емкости для растворов с уплотнителями*(7);
- емкость для анодного буфера*(8);
──────────────────────────────
*(1) Примером может служить набор "ExoSAP-ITтм" (USB Corporation, США). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
*(2) Примером подходящего реагента может служить "BigDye® Terminator v1.1 Ready Reaction Mix" из набора реактивов для секвенирования "BigDye® Terminator v1.1 Cycle Sequencing Kit" (Applied Biosystems, США). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
*(3) Примером может служить формамид "Hi-DiТМ Formamide" (Applied Biosystems, США). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
*(4) Примером подходящего полимера может служить "РОР-7тм Polymer for 3130/3130xl Genetic Analyzers" (Applied Biosystems, США). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
*(5) Примером подходящего концентрата буфера может служить "310 and 31хх Running Buffer, 10Х" (Applied Biosystems, США). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
*(6) Примером может служить планшет "MicroAmp® Optical 96-Well Reaction Plate" (Applied Biosystems, США) с уплотнителем типа "96-Well Plate Septa" (Applied Biosystems, США), основанием типа "3130 and 3100 series Plate Base 96-Well" (Applied Biosystems, США) и фиксатором типа "3130 and 3100 series Plate Retainer 96-Well" (Applied Biosystems, США). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
*(7) Примерами могут служить емкости для растворов "Buffer, Water, Waste Reservoir", уплотнитель "Reservoir Septa" (Applied Biosystems, США). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
*(8) Примером может служить емкость для анодного буфера "3130/3130xl Buffer Jar" (Applied Biosystems, США). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
- пакеты полиэтиленовые одноразовые с застежкой-молнией;
- салфетки для очистки линз, химически чистые;
- ленту лабораторную влагостойкую эластичную;
- халаты по ГОСТ 12.4.131 и ГОСТ 12.4.132;
- перчатки одноразовые из латекса без пудры;
- бумагу фильтровальную по ГОСТ 12026.
5.5 Допускается использование других средств измерений с метрологическими характеристиками, а также оборудования, материалов, посуды и реактивов с техническими характеристиками не хуже указанных.
6.1 Сущность метода заключается в определении нуклеотидной последовательности участка митохондриального генома разных видов животных и рыб и их сравнении с известными последовательностями для идентификации их видовой принадлежности.
6.2 Испытание состоит из следующих этапов:
- экстракция и очистка ДНК. На данном этапе осуществляется лизис клеток с последующей очисткой ДНК от балластных веществ (белков, полисахаридов и других соединений);
- ПЦР с парой праймеров, фланкирующей участок митохондриального генома в области cytB гена. На данном этапе осуществляется накопление копий определенной нуклеотидной последовательности генома;
- детекция ПЦР-продуктов методом электрофореза в агарозном геле для выявления специфической полосы амплифицированной ДНК и оценка концентрации ПЦР-продукта;
- секвенирование ПЦР-продукта, очищенного от невключившихся праймеров и дНТФ дидезоксинуклеотидным методом с флуоресцентными красителями;
- определение нуклеотидной последовательности путем разделения продуктов реакции секвенирования, очищенных от избытка дНТФ, флуоресцентно-меченых ддНТФ, праймера и солей, методом капиллярного электрофореза;
- сравнение полученной нуклеотидной последовательности фрагмента генома, выделенного из анализируемой пробы, с известными последовательностями из баз данных в целях его идентификации.
7.1 Отбор лабораторной пробы
7.1.1 Отбор проб, их транспортирование в лабораторию проводят по ГОСТ 31719 (раздел 5) с учетом требований, предъявляемых для данного вида продукции.
7.1.2 Не допускается отбор для испытания проб многокомпонентной продукции, т.е. содержащей помимо исследуемого компонента (мяса, рыбы, икры) другие компоненты животного происхождения (например, сметанный соус, яйца).
7.1.3 Для продукции в упаковке: перед вскрытием упаковки ее очищают от загрязнений. Стеклянные или металлические банки вскрывают с использованием чистого консервного ножа. Полимерные пакеты, пачки из картона и комбинированных материалов, стаканы из полимерных материалов, формочки из фольги вскрывают при помощи стерильных ножей, ножниц, шпателей и других подручных инструментов.
Замороженную продукцию перед вскрытием размораживают: при температуре (4 ± 2) °С - не более 18 ч; при температуре от 18 °С до 20 °С - в течение 1 ч.
7.1.4 Отбор проб мяса или рыбы: кусок мяса (тушку рыбы) разрезают, из средней части вырезают фрагмент тканей массой 30-200 г. Мелкую рыбу берут на испытание целиком.
7.1.5 Отбор проб икры: для испытания отбирают 50 г развесной икры либо отбирают одну упаковочную единицу фасованной икры (массой до 200 г).
7.1.6 Отбор проб готовой продукции и полуфабрикатов: на испытание отбирают 30-200 г продукции.
7.1.7 Пробы отбирают в одноразовые плотные полиэтиленовые пакеты с застежкой-молнией или чистые емкости из стекла или пластика с герметично закрывающимися крышками.
7.1.8 Каждый образец отбирают отдельным набором стерильных инструментов в одноразовых перчатках.
7.1.9 Лабораторные пробы хранят в соответствии с условиями, предусмотренными для хранения данного вида продукции.
7.2 Отбор и подготовка анализируемых проб
7.2.1 Подготовку анализируемых проб проводят в одноразовых перчатках.
7.2.2 Для подготовки анализируемых проб используют ступки и пестики, предварительно обработанные хромовой смесью, и инструменты, выдержанные в 96 %-ном этиловом спирте и обожженные в пламени газовой горелки.
7.2.3 Отбор анализируемых проб
7.2.3.1 Отбор анализируемых проб мяса, рыбы, готовой продукции, полуфабрикатов однокомпонентного состава: подготовленным по 7.2.2 скальпелем срезают верхнюю часть продукта, высекают из середины куска небольшой фрагмент массой 3-5 г, растирают пестиком и аккуратно переносят шпателем 10-50 мг в пластиковую одноразовую пробирку вместимостью 1, 5 см3.
7.2.3.2 Отбор проб рыбной икры: для испытания отбирают 1-2 икринки в пластиковую одноразовую пробирку вместимостью 1, 5 см3.
7.2.4 Анализируемые пробы в закрытых пробирках передают на выделение ДНК.
7.2.5 После отбора анализируемой пробы рабочую поверхность обрабатывают дезинфицирующим раствором, дистиллированной водой и подвергают ультрафиолетовому излучению в течение 15 мин.
Экстракцию ДНК из анализируемой пробы, полученной по 7.2, осуществляют с использованием набора реагентов для экстракции ДНК сорбционным методом по 5.3.
8.1 Буфер для лизирующего реагента и раствор для отмывки N 1 (если они хранились при температуре от 2 °С до 8 °С) прогревают на поверхности твердотельного термостата при температуре от 60 °С до 64 °С до полного растворения кристаллов.
8.2 Отбирают необходимое количество одноразовых пробирок объемом 1, 5 см3 (включая отрицательный контроль выделения). В пробирки вносят анализируемые пробы. В пробирку отрицательного контроля выделения ДНК вносят 100 мм3 воды деионизованной по 5.3.
8.3 Отдельными наконечниками с аэрозольным барьером вносят в каждую пробирку по 400 мм3 буфера для лизирующего реагента и по 17 мм3 лизирующего реагента. Тщательно перемешивают содержимое пробирок.
8.4 Инкубируют пробирки при температуре (64 ± 1) °С в течение 1 ч на твердотельном термостате, периодически встряхивая на миницентрифуге-встряхивателе (пять раз через каждые 10-12 мин).
8.5 Осаждают нерастворенные частицы образцов центрифугированием при 13000 об/мин в течение 5 мин.
8.6 Надосадочную жидкость в объеме 200-350 мм3 очень аккуратно (так, чтобы не попали взвешенные частицы и капли жира) отбирают отдельными наконечниками с аэрозольными барьерами и переносят в новые пробирки.
8.7 Пробы центрифугируют в течение 5 с при 5000 об/мин на микроцентрифуге для сброса капель с крышки пробирок.
8.8 Тщательно ресуспендируют сорбент универсальный на миницентрифуге-встряхивателе. В каждую пробирку отдельным наконечником добавляют по 25 мм3 ресуспендированного сорбента универсального. Перемешивают на встряхивателе, оставляют в штативе на 10-15 мин, перемешивая через каждые 2 мин.
8.9 Осаждают сорбент универсальный в пробирках центрифугированием при 5000 об/мин в течение 1 мин. Удаляют надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
8.10 Добавляют в пробы по 300 мм3 раствора для отмывки N 1, перемешивают на встряхивателе до полного ресуспендирования сорбента универсального. Осаждают сорбент универсальный центрифугированием при 5000 об/мин на микроцентрифуге в течение 1 мин. Удаляют надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
8.11 Добавляют в пробы по 500 мм3 раствора для отмывки N 2, перемешивают на встряхивателе до полного ресуспендирования сорбента универсального, центрифугируют 1 мин при 10000 об/мин на микроцентрифуге. Отбирают надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
8.12 Повторяют процедуру отмывки по 8.11, отбирают супернатант полностью. Помещают пробирки в термостат при температуре (64 ± 1) °С на 5-10 мин для подсушивания сорбента универсального. При этом крышки пробирок должны быть открыты.
8.13 В пробирки добавляют по 50 мм3 ТЕ-буфера для элюции ДНК. Перемешивают на встряхивателе. Помещают в термостат при температуре (64 ± 1) °С на 5-8 мин, периодически (один раз в минуту) перемешивая на встряхивателе.
8.14 Центрифугируют пробирки при 13000 об/мин в течение 2 мин на микроцентрифуге. Надосадочная жидкость содержит очищенную ДНК.
8.15 Очищенную ДНК можно хранить в течение одной недели при температуре от 2 °С до 8 °С и в течение года при температуре не выше минус 16 °С. Для этого рекомендуется перенести надосадочную жидкость в чистые микропробирки вместимостью 1, 5 см3.
8.16 Для постановки ПЦР разводят полученную ДНК в 100 раз. В отдельные пробирки вместимостью 1, 5 см3 вносят по 99 мм3 буфера для элюции ДНК и по 1 мм3 очищенной ДНК, тщательно перемешивают на встряхивателе, центрифугируют в течение 5 с при 5000 об/мин на микроцентрифуге для сброса капель с крышки пробирок. Пробы готовы к постановке ПЦР.
9.1 Для видовой идентификации фрагмента митохондриального генома используют пару праймеров, позволяющих амплифицировать фрагмент митохондриального генома в области гена cytB длиной 476 п. н., в соответствии с таблицей 1.
|
Наименование |
Направление |
Нуклеотидная последовательность |
Положение* |
|
Glu |
Прямой |
AAACTAATGACATGAAAAA(C/T)CA(T/C)CGTTG |
14482-14509 |
|
cytB |
Обратный |
CCCTCAGAATGATATTTGNCC(C/T)CA |
14957-14934 |
|
* Указаны позиции первого и последнего нуклеотида соответствующего праймера, выравненного относительно последовательности митохондриального генома Bos taurus с регистрационным номером KJ789953 в базах данных. | |||
9.2 Для проведения ПЦР готовят мастер-микс "ПЦР-смесь-1", смешивая по 0, 10 см3 растворов прямого и обратного ПЦР-праймеров, 0, 02 см3 раствора дНТФ и 0, 28 см3 деионизованной воды.
9.3 Для ПЦР используют среднестенные микропробирки вместимостью 0, 6 см3. Для повышения специфичности применяют "горячий старт" с восковой прослойкой, для чего воск расплавляют в термостате при температуре 90 °С.
9.4 В микропробирки вносят по 5 мм3 "ПЦР-смеси-1", наслаивают сверху по 10 мм3 расплавленного воска так, чтобы он полностью накрыл жидкость. Закрывают крышки, делают пометки с наименованием используемой пары праймеров. Если воск покрыл жидкость неровно или образовались пузыри, прогревают пробирки в термостате в течение 1 мин при температуре 95 °С и охлаждают.
9.5 Срок хранения мастер-микса "ПЦР-смесь-1" под воском при температуре минус 20 °С - не более шести месяцев.
9.6 Для амплификации в микропробирки на поверхность наносят по 10 мм3 "ПЦР-смеси-2", при этом она не должна проваливаться под воск и смешиваться с "ПЦР-смесью-1". В противном случае пробирку считают браком и утилизируют.
9.7 Сверху добавляют по капле вазелинового масла для ПЦР (примерно 25 мм3).
Затем в одну микропробирку вносят 10 мм3 Кв, а в остальные - по 10 мм3 ДНК по 8.16.
9.8 В двух микропробирках ставят контрольные реакции амплификации:
К- - вместо ДНК-пробы вносят 10 мм3 ДНК-буфера;
К+ - вместо ДНК-пробы вносят 10 мм3 ПКО cytB.
9.9 Запускают на амплификаторе программу термоциклирования в соответствии с таблицей 2.
|
Температура*, °С |
Время*, с |
Число циклов* |
|
95 |
Пауза | |
|
95 |
300 |
1 |
|
95 |
20 |
10 |
|
50 |
20 | |
|
72 |
40 | |
|
95 |
20 |
25 |
|
54 |
20 | |
|
72 |
40 | |
|
72 |
300 |
1 |
|
10 |
Хранение | |
* Приведенные режимы ПЦР оптимизированы на амплификаторах "Терцик". Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта. При использовании других амплификаторов необходимо оптимизировать условия термоциклирования.
9.10 При достижении температуры 95 °С микропробирки помещают в ячейки амплификатора и снимают программу с паузы.
9.11 После завершения реакции микропробирки отправляют в помещение детекции и учета результатов ПЦР методом электрофореза в соответствии с разделами 10 и 11.
9.12 Срок хранения анализируемых проб после амплификации при комнатной температуре - не более 16 ч, при температуре от 2 °С до 8 °С - не более семи суток, при температуре минус 16 °С - не более шести месяцев.
10.1 Готовят рабочий буфер для электрофореза: в мерный цилиндр вливают 40 см3 ТАЕ-буфера, переносят в мерную колбу вместимостью 2000 см3, доводят дистиллированной водой до метки и перемешивают.
10.2 На весах по 5.2 взвешивают 1, 8 г агарозы для электрофореза ДНК, навеску помещают в стеклянную колбу из термостойкого стекла вместимостью 250 см3. Мерным цилиндром вместимостью 250 см3 вносят 100 см3 рабочего электрофорезного буфера, перемешивают вращением колбы и плавят в микроволновой печи до полного растворения агарозы. Время плавления агарозы в микроволновой печи мощностью 800 Вт при ее загруженности одной колбой - 1, 5 мин.
10.3 Вынимают колбу с расплавленной агарозой из микроволновой печи, аккуратно перемешивают, вращая колбу. После этого вновь помещают колбу с агарозой в микроволновую печь на 1, 5 мин (при мощности 800 Вт), доводят агарозу до кипения. Вынимают колбу из микроволновой печи и остужают агарозу до температуры (65-70) °С, вращая колбу.
10.4 К раствору агарозы добавляют 5 мм3 раствора бромистого этидия концентрацией 10 мг/см3, тщательно перемешивают раствор. Полученный агарозный гель используют для заливки в рамку камеры.
10.5 Выравнивают столик для заливки гелей, заливают агарозный гель в рамку камеры. Устанавливают гребенки, не касаясь дна рамки камеры, на расстоянии не менее 3 см друг от друга. Толщина агарозного геля должна быть около 0, 6 см.
10.6 После полного застывания агарозного геля (30 мин при комнатной температуре), осторожно вынимают из него гребенки, не повредив лунки. Помещают рамку с готовым агарозным гелем в камеру так, чтобы лунки располагались ближе к отрицательному электроду. Заливают в камеру рабочий электрофорезный буфер так, чтобы он полностью покрыл агарозный гель.
10.7 Из пробирок с продуктами амплификации поочередно отбирают дозатором по 5.2 по 10 мм3 анализируемых и контрольных (К+, К-, Кв) проб и вносят в лунки агарозного геля. В каждом ряду лунок агарозного геля обязательно вносят маркер молекулярных масс ДНК и К+.
10.8 Подключают камеру к источнику тока, соблюдая полярность (ДНК должна двигаться в направлении положительного электрода). Электрофорез проводят при напряжении от 180 до 250 В в течение 20-30 мин, при этом краситель крезоловый красный, входящий в "ПЦР-смесь-2", должен продвинуться не менее чем на 2 см от старта. Оптимальная напряженность электрического поля при этом составляет 10 В/см.
10.9 По завершении времени электрофореза выключают источник тока, переносят рамку с гелем на УФ-трансиллюминатор, расположив полосы горизонтально лунками вверх. Получают изображение агарозного геля (электрофореграмму) на компьютере с помощью видеосистемы.
11.1 Учет результатов ПЦР проводят по наличию или отсутствию на электрофореграмме специфической полосы амплифицированной ДНК размером около 476 п. н. (данная длина фрагмента характерна Bos taurus, ПКО cytB).
Примечание - Точная длина амплифицированного специфического фрагмента ДНК зависит от вида объекта испытания и может варьировать в пределах 1-5 нуклеотидов.
11.2 Учет начинают с оценки результатов амплификации положительных и отрицательных контролей в соответствии с таблицей 3.
|
Контроль |
Наличие специфической полосы, соответствующей фрагменту cytB |
|
Экстракции ДНК, Кв |
"-" |
|
ПЦР, К- |
"-" |
|
ПЦР, К+ |
"+" |
|
Примечание - Знак "+" означает, что обнаружен ПЦР-продукт, знак "-" - не обнаружен. | |
В дорожке К+ должна наблюдаться специфическая полоса амплифицированной ДНК размером 476 п. н.
В дорожках К- и Кв не должно быть никаких полос, за исключением возможных димеров праймеров, находящихся ниже уровня 100 п. н.
11.3 Если результаты анализа положительных и отрицательных контролей не соответствуют приведенным в таблице 3, испытание повторяют со следующих этапов:
- если в дорожках отрицательных контролей Кв и/или К- выявляется специфическая полоса, значит, произошла контаминация реактивов или проб. Принимают меры по выявлению источника контаминации. Повторяют испытание с этапа выделения ДНК;
- если в дорожке К+ не выявляется специфическая полоса, повторяют испытание с этапа ПЦР;
- если в дорожках электрофореграммы наблюдаются неспецифические полосы на разных уровнях, то испытание повторяют с этапа ПЦР. Возможные причины неспецифической амплификации - отсутствие "горячего старта" или неверный температурный режим в ячейках амплификатора.
11.4 Если результаты амплификации контролей не противоречат ожидаемому результату в соответствии с таблицей 3, учитывают результаты амплификации анализируемых проб. Для проб, содержащих митохондриальную ДНК животных и рыб, в дорожке должна наблюдаться яркая светящаяся полоса на уровне, близком уровню К+.
11.5 Оценивают концентрацию ПЦР-продукта, сравнивая визуально интенсивность свечения соответствующей ему полосы и полос маркера молекулярных масс ДНК на электрофореграмме. Испытания (секвенирование ДНК) пробы продолжают при условии, если свечение полосы ПЦР-продукта той же интенсивности или более интенсивно по отношению к свечению полос маркера молекулярных масс ДНК.
11.6 В случае, если полоса ПЦР-продукта менее интенсивна по отношению к полосам маркера молекулярных масс ДНК, то проводят повторное испытание, начиная с этапа выделения ДНК.
12.1 Перед секвенированием амплифицированного фрагмента генома проводят очистку ПЦР-продукта, полученного в соответствии с разделом 9, от невключившихся праймеров и дНТФ. Для очистки берут 5 мм3 ПЦР-продукта, добавляют 2 мм3 реагента для очистки продуктов ПЦР и перемешивают пипетированием.
12.2 Полученный по 12.1 раствор инкубируют при температуре 37 °С в течение 15 мин. Затем встряхивают и осаждают капли кратковременным центрифугированием и снова инкубируют при температуре 80 °С в течение 15 мин.
12.3 Очищенные в соответствии с 12.2 ПЦР-продукты секвенируют с использованием cytB праймера.
12.4 Для проведения реакции в тонкостенные микропробирки вместимостью 0, 2 см3 вносят 0,8 мм3 очищенного по 12.2 ПЦР-продукта; 0,8 мм3 cytB праймера молярной концентрации 1 мкмоль/дм3, а также 1 мм3 смеси реагента для секвенирования ДНК и 2,4 мм3 воды деионизованной по 5.3. Общий объем реакционной смеси должен быть 5 мм3.
12.5 Термоциклирование проводят на амплификаторах с термостатируемой крышкой, соблюдая следующий режим:
а) начальная денатурация - 1 мин при температуре 96 °С;
б) затем 25 циклов:
1) денатурация при температуре 96 °С - 10 с;
2) отжиг праймера при температуре 55 °С - 5 с;
3) элонгация праймера при температуре 60 °С - 4 мин.
Полученную реакционную смесь объемом 5 мм3 используют для дальнейшего испытания в соответствии с разделом 13.
13.1 Проводят очистку реакционной смеси, полученной в соответствии с 12.5, от избытка дНТФ, флуоресцентно-меченых ддНТФ, секвенирующего праймера и солей осаждением полинуклеотидов изопропиловым спиртом. Для этого к реакционной смеси объемом 5 мм3 в микропробирке добавляют 30 мм3 75 %-ного изопропилового спирта и инкубируют в течение 20 мин при комнатной температуре.
13.2 Микропробирки с полученной по 13.1 смесью центрифугируют при 14000 об/мин в течение 20 мин и удаляют надосадочную жидкость.
13.3 К полученному осадку добавляют 100 мм3 75 %-ного изопропилового спирта, центрифугируют при 14000 об/мин в течение 2 мин и удаляют надосадочную жидкость.
13.4 Высушивают полученный по 13.3 осадок в термостате при температуре 65 °С в течение 10-15 мин и растворяют в 20 мм3 формамида по 5.3.
13.5 Полученные анализируемые пробы в формамиде переносят в 96-луночный планшет, закрывают уплотнителем и подвергают тепловой денатурации при температуре 95 °С в течение 3 мин, а затем при температуре 4 °С - в течение 5 мин.
13.6 Подготовленные в соответствии с 13.5 анализируемые пробы, содержащие продукты секвенирования, разделяют методом капиллярного электрофореза с детекцией сигнала флюоресценции в соответствии с инструкцией по эксплуатации генетического анализатора по 5.2.
13.7 Программное обеспечение генетического анализатора автоматически анализирует полученные сигналы (хроматограммы) и определяет последовательность нуклеотидов. Результатом анализа является расшифрованная последовательность нуклеотидов, приведенная над пиками хроматограммы в формате abi файла.
14.1 Для оценки качества секвенирования, поиска причин и путей устранения проблем рекомендуется использовать примеры типовых результатов, приведенные в приложении А.
14.2 Для последующей видовой идентификации в соответствии с разделом 15 используют нуклеотидные последовательности на хроматограммах с высокой интенсивностью сигнала флюоресценции и хорошо разделенными пиками.
14.3 Корректность чтения нуклеотидов проверяют дополнительно вручную в целях исключения ошибки автоматического анализа. Удаляют плохо читаемые из-за всплесков фона нуклеотиды в начале хроматограммы и область обратного праймера на конце секвенируемого ПЦР-продукта.
15.1 Для видовой идентификации сравнивают полученную в соответствии с разделом 14 нуклеотидную последовательность фрагмента генома с известными последовательностями из баз данных.
15.2 Таксономическая принадлежность (биологический вид, род) устанавливается на том уровне, который позволяют выявленные нуклеотидные различия.
15.3 Если полученная нуклеотидная последовательность 100 % идентична аналогичным участкам генома определенного биологического вида, при этом гомология с последовательностями других видов более низкая - принимают, что геном принадлежит данному биологическому виду.
15.4 Если полученная нуклеотидная последовательность 100 % идентична с аналогичными участками геномов сразу нескольких видов, устанавливают таксономическую принадлежность на том уровне, который позволяют выявленные нуклеотидные различия (например, биологический род).
15.5 Если полученная нуклеотидная последовательность не имеет 100 %-ной идентичности ни с одной последовательностью из баз данных, проводят филогенетический анализ родства нуклеотидных последовательностей. Это позволяет отнести исследуемый геном к наиболее близкой таксономической группе (биологический вид, род).
Приложение А
(справочное)
А.1 Примеры результатов секвенирования ДНК, возможные причины неудачных испытаний и пути устранения проблем приведены в таблице А.1.
Таблица А.1
|
N п/п |
Полученный результат |
Фрагмент хроматограммы |
Возможные причины |
Устранение проблем | |
|
1 |
Интенсивность сигнала высокая, пики хорошо разделены | 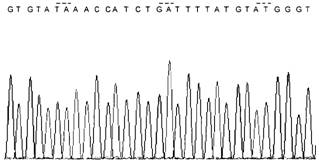 |
Норма |
- | |
|
2 |
Сигнал чтения матрицы ДНК идет на фоне выраженного шума прибора, "слабый сигнал" |  |
Недостаточное количество матрицы в анализируемой пробе |
Увеличение концентрации ДНК матрицы на этапе проведения реакции секвенирования | |
|
3 |
Отсутствие выраженных пиков, сигнал на уровне шума прибора |
1) В реакционную смесь не добавлен один из компонентов: готовая смесь для секвенирования, матрица или праймер. 2) Недостаточное количество матрицы в анализируемой пробе. 3) Праймер не комплементарен данной матрице |
Повторение испытания с этапа проведения реакции секвенирования. В случае воспроизведения неудачного результата испытание повторяют с этапа выделения ДНК | ||
|
4 |
Основной сигнал чтения матрицы ДНК идет на фоне более или менее выраженного второго сигнала или нескольких сигналов | 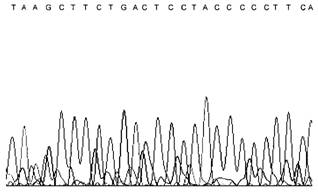 |
1) Нарушение режима ПЦР, приводящее к появлению неспецифических продуктов амплификации. 2) Анализируемая проба не является однокомпонентной продукцией |
1) Повторное испытание анализируемой пробы, начиная с этапа ПЦР. 2) Проба не подлежит испытанию | |
|
5 |
Пики очень высокой интенсивности в начале хроматограммы, быстрое падение сигнала, короткое прочтение матрицы | 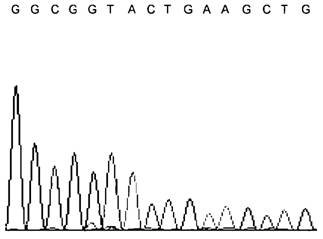 |
Перегрузка реакционной смеси ДНК матрицей, в результате чего нарабатывается одновременно слишком много коротких фрагментов, амплификация длинных фрагментов тормозится недостатком флуоресцентно-меченых ддНТФ |
Уменьшение концентрации ДНК матрицы на этапе проведения реакции секвенирования | |
|
6 |
Перегрузка короткими фрагментами матрицы (20-40 п. н.) в начале хроматограммы, далее высота пиков резко снижается | 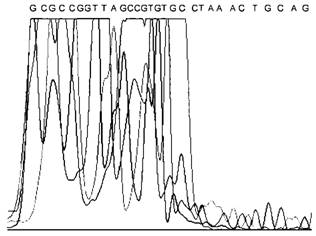 |
Присутствие в анализируемой пробе большого количества димеров праймеров, образовавшихся в результате ПЦР |
Повторение испытания, начиная с этапа ПЦР. Улучшение качества очистки ДНК матрицы для секвенирования (например, вырезание фрагмента основного продукта ПЦР из агарозного геля) | |
|
7 |
Пики на хроматограмме слева имеют крутые края, а справа - пологие | 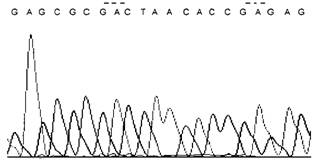 |
Загрязнение матрицы побочными веществами, например, солями |
Повторяют испытание с этапа очистки ПЦР продукта, используют альтернативные методы очистки (например, переосаждение ДНК этиловым спиртом в присутствии ацетата калия) | |
|
8 |
Всплески флюоресценции несвязавшихся во время ПЦР-реакции флюоресцентно-меченых терминаторов | 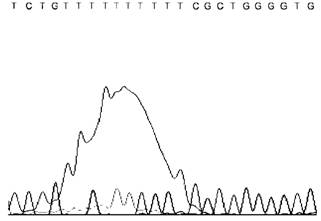 |
Недостаточно эффективная очистка реакционной смеси от несвязавшихся флюоресцентно-меченых терминаторов |
Оптимизация условий реакции секвенирования. Оптимизация условий очистки реакционной смеси, использование других доступных наборов реагентов | |
|
9 |
Появление в произвольном месте узкого и высокого пика всех четырех цветов | 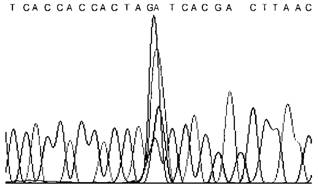 |
Попадание в капилляр кристалла полимера, дефект электрофореза |
Повторение этапа капиллярного электрофореза анализируемой пробы | |
|
10 |
Размывание пиков на хроматограмме |  |
Ухудшение качества полимера, истощение буферного раствора, загрязнение капилляров |
Проведение технического обслуживания анализатора с заменой буфера и полимера. Повторение этапа капиллярного электрофореза анализируемой пробы |
(Нет голосов) |
-
29.05.2025
Слухи о скорой заморозке вкладов в России объяснили
 Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
-
29.05.2025
Дачникам рассказали о штрафах за нескошенную траву
 Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
-
29.05.2025
Вероятность исчезновения в России наличных денег оценили
 Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
-
29.05.2025
Перспективы исламского банкинга в России оценили
 Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
-
30.04.2025
Россиянам объяснили опасность зарплаты в конвертах
 Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии
Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии