Утв. Постановлением Государственного комитета СССР по стандартам от 1 сентября 1978 г. N 2409
Государственный стандарт Союза ССР ГОСТ 23268.5-78*
"ВОДЫ МИНЕРАЛЬНЫЕ ПИТЬЕВЫЕ ЛЕЧЕБНЫЕ, ЛЕЧЕБНО-СТОЛОВЫЕ И ПРИРОДНЫЕ СТОЛОВЫЕ. МЕТОДЫ ОПРЕДЕЛЕНИЯ ИОНОВ КАЛЬЦИЯ И МАГНИЯ"
ОКСТУ 9109
С изменениями:
(9 июля 1986 г.)
Drinking medicinal, medicinal-table and natural-table minenal waters. Methods of determination of calcium and magnesium ions
Срок действия - с 1 января 1980 г.
до 1 января 1985 г.
Ограничение срока действия снято в 1993 г.
Настоящий стандарт распространяется на лечебные, лечебно-столовые и природные столовые питьевые минеральные воды и устанавливает титриметрический метод определения ионов кальция и магния; потенциометрический метод определения ионов кальция и атомно-абсорбционный метод определения ионов магния.
(Измененная редакция, Изм. N 1).
1. Метод отбора проб
1.1. Отбор проб - по ГОСТ 23268.0-78.
1.2. Объем минеральной воды, отобранный для определения ионов кальция и магния, должен быть не менее 250 см3.
2. Титриметрический метод определения ионов кальция
2.1.а. Сущность метода
Метод основан на способности комплексона III образовывать в щелочной среде в интервале рН 12 - 13 комплексные соединения с ионами кальция.
Метод позволяет определять более 1 мг ионов кальция в пробе с пределом погрешности измерений ±0, 02 мг при числе определении n = 5 с доверительной вероятностью Р = 0, 95.
2.1. Аппаратура, материалы и реактивы
Бюретки мерные по ГОСТ 20292-74, вместимостью 10, 25 см3.
Пипетки мерные по ГОСТ 20292-74, вместимостью 1, 2, 5, 10, 25, 50 см3.
Колбы мерные по ГОСТ 1770-74, вместимостью 100, 500, 1000 см3.
Цилиндры мерные по ГОСТ 1770-74, вместимостью 50, 100 см3.
Колбы стеклянные лабораторные конические по ГОСТ 25336-82, вместимостью 250 см3.
Капельницы по ГОСТ 25336-82.
Стекло часовое.
Холодильник стеклянный лабораторный по ГОСТ 25336-82.
Весы лабораторные не ниже второго класса точности с наибольшим пределом взвешивания до 200 г по ГОСТ 24104-80 или другие весы, обеспечивающие необходимую точность взвешивания.
Весы лабораторные не ниже четвертого класса точности с наибольшим пределом взвешивания до 500 г по ГОСТ 24104-80 или другие весы, обеспечивающие необходимую точность взвешивания.
Плитка электрическая по ГОСТ 14919-83.
Воронки стеклянные по ГОСТ 25336-82.
Ступка фарфоровая по ГОСТ 9147-80.
Шпатель.
Кислота соляная фиксанал, раствор концентрацией 0, 1 моль/дм3.
Метиловый красный по ГОСТ 5853-51.
Кислота кальконкарбоновая.
Натрия гидроокись по ГОСТ 4328-77.
Гидроксиламина гидрохлорид по ГОСТ 5456-79.
Комплексон III фиксанал, раствор концентрацией 0, 05 моль/дм3.
Спирт этиловый ректификованный по ГОСТ 5962-67.
Вода дистиллированная по ГОСТ 6709-72.
Глицерин по ГОСТ 6259-75.
Мурексид.
Натрий хлористый по ГОСТ 4233-77.
Все реактивы должны быть квалификации х.ч. или ч.д.а.
2.2. Подготовка к анализу
2.2.1. Приготовление раствора комплексона III концентрацией 0, 05 моль/дм3
Раствор готовят из фиксанала. Содержимое ампулы количественно переносят в мерную колбу вместимостью 1000 см3, растворяют в дистиллированной воде и объем раствора доводят дистиллированной водой до метки.
2.2.2. Приготовление раствора соляной кислоты концентрацией 0, 1 моль/дм3
Раствор готовят из фиксанала. Содержимое ампулы количественно переносят в мерную колбу вместимостью 1000 см3 и объем раствора доводят дистиллированной водой до метки.
2.2.3. Приготовление индикатора метилового красного
0, 1 г метилового красного взвешивают с погрешностью не более 0, 01 г и растворяют в 100 см3 горячей дистиллированной воды.
2.2.4. Приготовление раствора гидроокиси натрия концентрацией 2 моль/дм3
80 г гидроокиси натрия взвешивают с погрешностью не более 0, 01 г, помещают в мерную колбу вместимостью 1000 см3, растворяют в дистиллированной воде, охлаждают до температуры 20°С и доводят объем раствора дистиллированной водой до метки.
2.2.5. Приготовление раствора гидроксиламина
4, 5 г гидрохлорид гидроксиламина взвешивают с погрешностью не более 0, 01 г и растворяют в 100 см3 этилового спирта.
(Измененная редакция, Изм. N 1).
2.2.6. Приготовление раствора с массовой долей кальконкарбоновой кислоты 0, 025%
0, 025 г кальконкарбоновой кислоты взвешивают с погрешностью не более 0, 0002 г и растворяют в 100 см3 водно-глицериновой смеси 1:1.
2.2.7. Приготовление индикатора мурексида
0, 1 - 0, 2 г индикатора мурексида смешивают с 10 г хлористого натрия и тщательно растирают смесь в фарфоровой ступке.
2.3. Проведение анализа
В коническую колбу вместимостью 250 см3 отмеривают от 10 до 100 см3 минеральной воды, разбавляют дистиллированной водой до 100 см3, нейтрализуют раствором соляной кислоты концентрацией 0, 1 моль/дм3 по индикатору метиловому красному до розового окрашивания раствора, добавляют еще 1 см3 соляной кислоты, кипятят 5 мин с обратным холодильником для удаления двуокиси углерода (холодильник можно заменить перевернутой воронкой). Раствор охлаждают до температуры 20°С. Добавляя 2 см3 раствора гидроокиси натрия концентрацией 2 моль/дм3, устанавливают рН от 12 до 13. В качестве индикатора вводят 1 см3 раствора кальконкарбоновой кислоты и пробу медленно титруют раствором комплексона III концентрацией 0, 05 моль/дм3 до изменения цвета раствора из вишневого в синий.
При определении ионов кальция в железистых минеральных водах железо маскируют 2 - 3 каплями раствора гидроксиламина.
При использовании мурексида в качестве индикатора в обработанную по ранее описанной методике пробу вводят на кончике шпателя индикатор, приготовленный по п. 2.2.7, и пробу медленно титруют раствором комплексона III концентрацией 0, 05 моль/дм3 до изменения цвета раствора из малинового в красно-фиолетовый.
2.4. Обработка результатов
Массовую концентрацию ионов кальция (Х), мг/дм3 вычисляют по формуле
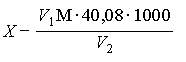 ,
,
где V1 - объем раствора комплексона III, пошедший на титрование, см3;
М - молярная концентрация раствора комплексона III;
40, 08 - молярная масса иона кальция, г/моль;
V2 - объем воды, взятый на анализ, см3.
За окончательный результат анализа принимают среднее арифметическое результатов двух параллельных определений относительные, допускаемые расхождения между которыми не должны превышать 2%.
3. Титриметрический метод определения ионов магния
3.1.а. Сущность метода
Метод основан на способности комплексона III образовывать в щелочной среде при рН 10 комплексные соединения с ионами кальция и магния.
Метод позволяет определять от 1 мг ионов магния в пробе с пределом погрешности измерений ±0, 02 мг при числе определений n = 5 с доверительной вероятностью Р = 0, 95.
3.1. Аппаратура, материалы и реактивы
Бюретки мерные по ГОСТ 20292-74, вместимостью 10, 25 см3.
Пипетки мерные по ГОСТ 20292-74, вместимостью 5, 10, 15, 20, 25, 50 см3.
Колбы стеклянные лабораторные конические по ГОСТ 10394-72, вместимостью 100, 250 см3.
Колбы по ГОСТ 1770-74, вместимостью 100, 250 см3.
Ступка фарфоровая по ГОСТ 9147-80.
Весы лабораторные не ниже четвертого класса точности с наибольшим пределом взвешивания до 500 г по ГОСТ 24104-80 или другие весы, обеспечивающие необходимую точность взвешивания.
Бумага индикаторная универсальная.
Комплексон III фиксанал, раствор концентрацией 0, 1 моль/дм3.
Эриохром черный Т.
Хром темно-синий кислотный.
Натрий хлористый по ГОСТ 4233-77.
Аммоний хлористый по ГОСТ 3773-72.
Аммиак водный по ГОСТ 3760-79.
Вода дистиллированная по ГОСТ 6709-72.
Все реактивы должны быть квалификации х.ч. или ч.д.а.
3.2. Подготовка к анализу
3.2.1. Приготовление раствора комплексона III концентрацией 0, 05 моль/дм3 из фиксанала - по п. 2.2.1
3.2.2. Приготовление индикатора
0, 5 г индикатора эриохрома черного Т или кислотного хрома темно-синего взвешивают с погрешностью не более 0, 01 г, смешивают со 100 г хлористого натрия и тщательно растирают смесь в фарфоровой ступке.
3.2.3. Приготовление аммиачного буферного раствора
10 г хлористого аммония взвешивают с погрешностью не более 0, 01 г, помещают в мерную колбу вместимостью 500 см3, растворяют в небольшом количестве дистиллированной воды, добавляют 50 см3 раствора с массовой долей аммиака 25% и объем раствора доводят дистиллированной водой до метки. рН приготовленного раствора 10. Хранят раствор в плотно закрытой склянке.
3.3. Проведение анализа
В коническую колбу вместимостью 250 см3 отмеривают от 25 до 50 см3 минеральной воды, разбавляют дистиллированной водой до 100 см3, устанавливают рН 10, добавляя 5 см3 аммиачного буферного раствора, вводят несколько крупинок индикатора и титруют пробу раствором комплексона III концентрацией 0, 05 моль/дм3 до изменения цвета раствора из вишнево-красного в синий.
3.4. Обработка результатов
Массовую концентрацию ионов магния (X1), мг/дм3 вычисляют по разности объемов комплексона III, израсходованных на титрование суммы ионов кальция и магния и отдельно ионов кальция в одинаковых объемах по формуле
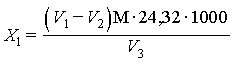 ,
,
где V1 - объем раствора комплексона III, пошедший на титрование суммы ионов кальция и магния, см3;
V2 - объем раствора комплексона III, пошедший на титрование ионов кальция, см3;
М - молярная концентрация раствора комплексона III;
24, 32 - молярная масса иона магния, г/моль;
V3 - объем воды, взятый на анализ, см3.
За окончательный результат анализа принимают среднее арифметическое результатов двух параллельных определений относительные, допускаемые расхождения между которыми не должны превышать 2%.
4. Потенциометрический метод определения ионов кальция
4.1. Сущность метода
Метод основан на прямом определении ионов кальция с использованием ионоселективного кальциевого электрода.
Метод позволяет определять от 4 до 100 мг ионов кальция в пробе. В диапазоне 4 - 20 мг - с пределом погрешности измерений 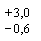 мг; в диапазоне 20 - 100 мг - с пределом погрешности измерений
мг; в диапазоне 20 - 100 мг - с пределом погрешности измерений 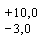 мг при числе определений n = 5 с доверительной вероятностью Р = 0, 95.
мг при числе определений n = 5 с доверительной вероятностью Р = 0, 95.
4.2. Аппаратура, материалы, реактивы
Прибор для измерения величины потенциала, типа рН-метр-милливольтметр (рН-340, рН-121) или иономер типа ЭВ-74.
Электрод сравнения хлорсеребряный насыщенный образцовый 2-го разряда по ГОСТ 17792-72.
Электрод "Квант" ионоселективный кальциевый.
Весы лабораторные не ниже второго класса точности с наибольшим пределом взвешивания до 200 г по ГОСТ 24104-80 или другие весы, обеспечивающие необходимую точность взвешивания.
Весы лабораторные не ниже четвертого класса точности с наибольшим пределом взвешивания до 500 г по ГОСТ 24104-80 или другие весы, обеспечивающие необходимую точность взвешивания.
Шкаф сушильный.
Секундомер механический по ГОСТ 5072-79.
Стаканы лабораторные по ГОСТ 25336-82, вместимостью 250 см3.
Колбы конические по ГОСТ 25336-82, вместимостью 500 см3.
Колбы мерные по ГОСТ 1770-74, вместимостью 100, 1000 см3.
Цилиндры мерные с притертой пробкой по ГОСТ 1770-74, вместимостью 50 см3 (исполнения 2 или 4).
Пипетки мерные по ГОСТ 20292-74, вместимостью 1, 5, 10, 25 см3.
Палочки стеклянные.
Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82.
Бутыль полиэтиленовая.
Анионит АВ-17 по ГОСТ 20301-74.
Натрий уксуснокислый 3-водный по ГОСТ 199-78.
Кальций углекислый по ГОСТ 4530-76.
Кислота соляная по ГОСТ 3118-77.
Бумага фильтровальная лабораторная по ГОСТ 12026-76.
Бумага индикаторная универсальная.
Все реактивы должны быть квалификации х.ч. или ч.д.а.
4.3. Подготовка к анализу
4.3.1. Приготовление основного стандартного раствора хлористого кальция
Углекислый кальций прокаливают в сушильном шкафу при температуре (110±2)°С до постоянной массы. 10, 000 г прокаленного углекислого кальция взвешивают с погрешностью не более ±0, 0002 г.
Навеску переносят в стакан вместимостью 250 см3 и растворяют в 216 см3 раствора соляной кислоты концентрацией 1 моль/дм3, затем содержимое стакана перемешивают стеклянной палочкой и после растворения соли раствор количественно переносят в мерную колбу вместимостью 1 дм3 и доводят объем раствора до метки дистиллированной водой. Полученный раствор хранят в полиэтиленовой бутыли.
1 см3 раствора содержит 1·10-4 молей хлористого кальция.
4.3.2. Приготовление раствора хлористого кальция концентрацией 0, 001 моль/дм3.
В мерную колбу вместимостью 100 см3 приливают 1 см3 основного стандартного раствора, отмеренного пипеткой вместимостью 1 см3 и объем раствора доводят дистиллированной водой до метки.
1 см3 раствора содержит 1·10-6 молей хлористого кальция.
4.3.3. Приготовление буферного раствора
136, 00 г трехводного уксуснокислого натрия взвешивают с погрешностью не более ±0, 01 г. Навеску помещают в колбу вместимостью 1000 см3, растворяют в 100 - 150 см3 дистиллированной воды и объем раствора доводят дистиллированной водой до метки.
4.3.4. Подготовка прибора к испытанию
Новый измерительный ионоселективный кальциевый электрод перед работой выдерживают в основном стандартном растворе не менее 24 ч. Перед началом работы ионоселективный электрод присоединяют к клемме прибора для измерения величины потенциала "Изм.", промывают дистиллированной водой, а остатки воды с электрода удаляют фильтровальной бумагой. В качестве электрода сравнения используют хлорсеребряный электрод.
По окончании работы ионоселективный электрод и наконечник электролитического ключа обмывают дистиллированной водой.
Между анализами ионоселективный кальциевый электрод хранят в стаканчике с раствором хлористого кальция концентрацией 0, 001 моль/дм3.
4.3.5. Подготовка анионита - по ГОСТ 10896-78.
4.4. Проведение анализа
На характер градуировочного графика влияют ионная сила раствора и присутствующие в воде гидрокарбонат-ионы. Влияние ионной силы устраняют добавлением буферного раствора. Для устранения влияния гидрокарбонат-ионов анализируемую воду пропускают через колонку, наполненную ионообменной смолой марки АВ-17 в СI-форме. Первые 10 - 20 см3 фильтрата для анализа не используют.
В мерный цилиндр с притертой пробкой вместимостью 50 см3 отмеривают пипетками от 5 до 25 см3 фильтрата для того, чтобы в отобранной пробе содержалось от 4 до 100 мг ионов кальция, пробу фильтрата разбавляют дистиллированной водой до 25 см3 и добавляют 25 см3 буферного раствора. Раствор перемешивают. Подготовленную пробу используют для трех параллельных измерений. Для этого в стаканчик вместимостью 50 см3 отливают около одной трети полученного раствора, погружают в него ионоселективный кальциевый электрод и наконечник электролитического ключа. Потенциал электрода измеряют при помощи прибора для измерения величины потенциала. Показания прибора снимают через 30 с после погружения электрода.
4.4.1. Построение градуировочного графика
В мерные цилиндры с притертыми пробками вместимостью по 50 см3 каждый вносят при помощи пипеток вместимостью 1, 5, 10, 15, 25 см3 соответственно 1, 5, 10, 15, 25 см3 основного стандартного раствора и доводят растворы до 25 см3 дистиллированной водой. Полученные эталонные растворы содержат соответственно ионов кальция 1, 0·10-4 моль/дм3 (4, 0 мг/дм3); 5, 0·10-4 моль/дм3 (20, 0 мг/дм3); 1, 0·10-3 моль/дм3 (40, 0 мг/дм3); 1, 5·10-3 моль/дм3 (60, 0 мг/дм3); 2, 5·10-3 моль/дм3 (100 мг/дм3). Затем к эталонным растворам добавляют пипеткой вместимостью 25 см3 по 25 см3 буферного раствора. Растворы перемешивают и измеряют их потенциалы, как указано в п. 4.4. в порядке возрастания концентрации ионов кальция в эталонных растворах.
На основании полученных данных строят градуировочный график зависимости потенциала электрода, mV, от концентрации ионов кальция. Для его построения на миллиметровой бумаге на оси абсцисс откладывают отрицательные логарифмы значений концентраций ионов кальция в эталонных растворах, выраженные в г·моль/дм3, а на оси ординат - величины измеренных потенциалов.
Логарифмы значений концентраций ионов кальция, г·моль/дм3, приведены в таблице. Градуировочный график проверяют ежедневно.
4.5. Обработка результатов
Отрицательный логарифм значения концентрации ионов кальция (рС) находят по градуировочному графику, используя среднее арифметическое значение трех параллельных измерений потенциала, проведенных из одной пробы. Массовую концентрацию ионов кальция (С) находят по таблице.
Соотношение между - IgC (рС) и массовой концентрацией ионов кальция (С)
|
- lg, С (рС)
|
С, г·моль/дм3
|
С, мг/дм3
|
|
2, 60
|
2, 51·10-3
|
100, 5
|
|
2, 61
|
2, 46·10-3
|
98, 2
|
|
2, 62
|
2, 40·10-3
|
96, 0
|
|
2, 63
|
2, 34·10-3
|
93, 8
|
|
2, 64
|
2, 30·10-3
|
91, 6
|
|
2, 65
|
2, 24·10-3
|
89, 6
|
|
2, 66
|
2, 19·10-3
|
87, 5
|
|
2, 67
|
2, 14·10-3
|
85, 5
|
|
2, 68
|
2, 09·10-3
|
83, 6
|
|
2, 69
|
2, 04·10-3
|
81, 7
|
|
2, 70
|
1, 99·10-3
|
79, 8
|
|
2, 75
|
1, 80·10-3
|
72, 0
|
|
2, 80
|
1, 60·10-3
|
64, 0
|
|
2, 85
|
1, 40·10-3
|
56, 0
|
|
2, 90
|
1, 30·10-3
|
52, 0
|
|
2, 95
|
1, 10·10-3
|
44, 0
|
|
3, 00
|
1, 00·10-3
|
40, 0
|
|
3, 05
|
9, 00·10-4
|
36, 0
|
|
3, 10
|
8, 00·10-4
|
32, 0
|
|
3, 15
|
7, 00·10-4
|
28, 0
|
|
3, 20
|
6, 30·10-4
|
25, 2
|
|
3, 25
|
5, 60·10-4
|
22, 4
|
|
3, 30
|
5, 00·10-4
|
20, 0
|
|
3, 35
|
4, 50·10-4
|
18, 0
|
|
3, 40
|
4, 00·10-4
|
16, 0
|
|
3, 45
|
3, 50·10-4
|
14, 0
|
|
3, 50
|
3, 20·10-4
|
12, 8
|
|
3, 55
|
2, 80·10-4
|
11, 2
|
|
3, 60
|
2, 50·10-4
|
10, 0
|
|
3, 65
|
2, 20·10-4
|
8, 8
|
|
3, 70
|
2, 00·10-4
|
8, 0
|
|
3, 75
|
1, 80·10-4
|
7, 2
|
|
3, 80
|
1, 60·10-4
|
6, 4
|
|
3, 85
|
1, 40·10-4
|
5, 6
|
|
3, 90
|
1, 30·10-4
|
5, 2
|
|
3, 95
|
1, 10·10-4
|
4, 4
|
|
4, 00
|
1, 00·10-4
|
4, 0
|
При составлении таблицы использована зависимость
C=40·103-pC,
где С - концентрация ионов кальция, моль/дм3,
40 - молярная масса иона кальция, г/моль;
рС - отрицательный логарифм концентрации ионов кальция, выраженной в моль/дм3.
Если при подготовке пробы к анализу минеральную воду разбавляют дистиллированной водой, то массовую концентрацию ионов кальция (X2), мг/дм3 вычисляют по формуле
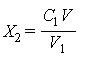 ,
,
где C1 - массовая концентрация ионов кальция в разбавленной пробе, мг/дм3,
V - объем разбавленного раствора, см3,
V1 - объем минеральной воды, взятый на анализ, см3.
5. Атомно-абсорбционный метод определения ионов магния
5.1. Сущность метода
Метод основан на переводе части образца в атомный пар и измерении поглощения этим паром излучения, характеристического для атомов магния.
Метод позволяет определять от 12, 5 до 250 м/см3 ионов магния в пробе (после ее разведения) с пределом погрешности измерений 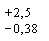 мкг при числе определений n = 5 с доверительной вероятностью Р = 0, 95.
мкг при числе определений n = 5 с доверительной вероятностью Р = 0, 95.
Метод применяется при возникновении разногласий в оценке качества.
5.2. Аппаратура, материалы и реактивы
Спектрофотометр абсорбционный с магниевой лампой с полым катодом.
Весы лабораторные не ниже второго класса точности с наибольшим пределом взвешивания до 200 г по ГОСТ 24104-80 или другие весы, обеспечивающие необходимую точность взвешивания.
Весы лабораторные не ниже четвертого класса точности с наибольшим пределом взвешивания до 500 г по ГОСТ 24104-80 или другие весы, обеспечивающие необходимую точность взвешивания.
Шкаф сушильный лабораторный с терморегулятором.
Плитка электрическая по ГОСТ 14919-83.
Печь муфельная.
Эксикатор по ГОСТ 25336-82.
Бумага фильтровальная беззольная по ГОСТ 12026-76 "Красная лента".
Колбы верные по ГОСТ 1770-74, вместимостью 25, 50, 100, 1000 см3.
Пипетки мерные по ГОСТ 20292-74, вместимостью 1, 2, 5, 10, 25, 50, 100, см3
Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82.
Стаканы лабораторные по ГОСТ 25336-82, вместимостью 50, 100, 2000 см3.
Посуда лабораторная фарфоровая по ГОСТ 9147-80.
Чашки выпарные по ГОСТ 9147-80.
Кислота соляная по ГОСТ 3118-77.
Магний углекислый основной водный по ГОСТ 6419-78.
Аммиак водный по ГОСТ 3760-79.
Лантан хлористый или другая соль лантана.
Вода дистиллированная по ГОСТ 6709-72.
Бумага индикаторная универсальная.
Все реактивы должны быть квалификации ос.ч., х.ч. или ч.д.а.
5.3. Подготовка к анализу
5.3.1. Приготовление основного стандартного раствора хлористого магния.
Углекислый магний прокаливают в сушильном шкафу при температуре (110±2)°С до постоянной массы 1, 7500 г высушенного углекислого магния взвешивают с погрешностью не более ±0, 0002 г. Навеску переносят в мерную колбу вместимостью 500 см3, приливают 15 см3 концентрированной соляной кислоты (плотностью 1, 19 г/см3), перемешивают и после полного растворения соли разбавляют до метки дистиллированной водой.
1 см3 раствора содержит 1 мг ионов магния.
5.3.2. Приготовление промежуточного стандартного раствора хлористого магния
В колбу с притертой пробкой вместимостью 500 см3 отбирают при помощи пипетки вместимостью 25 см3 25 см3 основного стандартного раствора хлористого магния, приливают при помощи пипетки вместимостью 10 см3 8, 5 см3 концентрированной соляной кислоты и объем раствора доводят до метки дистиллированной водой.
1 см3 рабочего стандартного раствора содержит 50 мкг ионов магния.
5.3.3. Приготовление раствора хлористого лантана
Раствор готовят из оксида лантана (La2O3), полученного из любой соли лантана следующим образом: 100 г соли лантана (например хлористого лантана) взвешивают с погрешностью не более ±0, 01 г, переносят в стакан вместимостью 2 дм3, добавляют 50 см3 концентрированной соляной кислоты и раствор нагревают почти до кипения. В горячий раствор приливают небольшими порциями концентрированный аммиак до рН 9, выдерживают на теплой электроплитке до коагуляции осадка и отфильтровывают гидроокись лантана через фильтр "Красная лента". Осадок промывают горячей водой, высушивают на воздухе, собирают с фильтра и прокаливают в фарфоровой чашке при 1000°С до постоянной массы.
58 г полученного гидроксида лантана переносят в мерную колбу вместимостью 1 дм3, растворяют в 100 см3 концентрированной соляной кислоты, и полученный раствор разбавляют дистиллированной водой до метки.
1 см3 раствора содержит 50 мг ионов лантана.
5.3.4. Приготовление рабочих стандартных растворов хлористого магния
В колбы с притертыми пробками вместимостью 100 см3 отмеряют при помощи пипеток вместимостью 1, 5, 10 см3 соответственно по 0, 00 см3 - нулевой раствор; 0, 50 см3 - (раствор N 1); 1, 00 см3 - (раствор N 2); 2, 00 см3 - (раствор N 3); 4, 00 см3 - (раствор N 4); 6, 00 см3 - (раствор N 5); 8, 00 см3 - (раствор N 6) и 10, 00 см3 (раствор N 7) промежуточного стандартного раствора хлористого магния, приготовленного как указано в п. 5.3.2, вносят при помощи пипетки вместимостью 2 см3 соответственно по 1, 80; 1, 80; 1, 75; 1, 70; 1, 70; 1, 65; 1, 60 см3 концентрированной соляной кислоты и затем вносят при помощи пипетки вместимостью 10 см3 соответственно по 10 см3 раствора хлористого лантана, приготовленного по п. 5.3.4, разбавляют растворы до меток дистиллированной водой, закрывают пробками и перемешивают.
Полученные рабочие стандартные растворы содержат в 1 см3 ионов магния - раствор N 1 - 0, 25 мкг; раствор N 2 - 0, 50 мкг; раствор N 3 - 1, 0 мкг; раствор N 4 - 2 мкг; раствор N 5 - 3 мкг; раствор N 6 - 4 мкг; раствор N 7 - 5 мкг.
5.3.5. Подготовка пробы
В 1 см3 пробы должно содержаться не более 6 мкг магния.
В мерную колбу с притертой пробкой вместимостью 25 см3 вносят при помощи пипетки вместимостью 1, 0 см3 2% по объему концентрированной соляной кислоты, вносят при помощи пипетки вместимостью 5 см3 2, 5 см3 раствора хлористого лантана и аликвоту минеральной воды. Раствор в колбе доводят до метки дистиллированной водой, закрывают пробкой и перемешивают. Параллельно готовят холостой раствор.
5.3.6. Приготовление холостого раствора
В мерную колбу вместимостью 25 см3 вносят при помощи пипетки вместимостью 1, 0 см3 2% по объему концентрированной соляной кислоты, при помощи пипетки вместимостью 5 см3 вносят 2, 5 см3 раствора хлористого лантана и доводят раствор до метки дистиллированной водой. Колбу закрывают пробкой и содержимое ее перемешивают.
5.4. Проведение анализа
Определение магния проводят по резонансной линии 285, 6 нм в воздушно-ацетиленовом пламени.
Проводят примерную оценку концентрации магния в растворе, сравнивая анализируемый раствор с одним из рабочих стандартных растворов, приготовленных по п. 5.3.4.
Из серии рабочих стандартных растворов, приготовленных по п. 5.3.4, выбирают три - четыре раствора, близких по концентрации к анализируемому, и нулевой раствор. Устанавливают чувствительность прибора, оптимальную для этих растворов.
Фотометрируют отобранную группу стандартных растворов, анализируемый и холостой растворы. Затем повторяют измерения в обратной последовательности. Вычисляют среднее арифметическое значение величины, регистрируемой прибором, для каждого рабочего стандартного, анализируемого и холостого растворов.
Градуировочный график строят по полученным данным для стандартных рабочих растворов, откладывая на оси ординат показания регистрирующего прибора, с вычетом показаний для нулевого раствора, а на оси абсцисс массовую концентрацию ионов магния в мкг/см3.
5.5. Обработка результатов
Массовую концентрацию магния (C3), мг/дм3 вычисляют по формуле
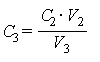 ,
,
где C2 - массовая концентрация магния, найденная по градуировочному графику с учетом холостого раствора, мкг/см3,
V2 - объем, до которого разбавлена аликвота минеральной воды, см3,
V3 - объем минеральной воды, взятый для разбавления, см3.
За окончательный результат анализа принимают среднее арифметическое результатов двух параллельных определений относительные, допускаемые расхождения между которыми не должны превышать 3%.
_____________________________
* Переиздание сентябрь 1983 г. с Изменением N 1, утвержденным в апреле 1983 г.; Пост. N 2001 от 21.04.83 (ИУС N 8 - 1983 г.)
![]() — Все документы — ГОСТы — ГОСТ 23268.5-78* (09.07.1986) ВОДЫ МИНЕРАЛЬНЫЕ ПИТЬЕВЫЕ ЛЕЧЕБНЫЕ, ЛЕЧЕБНО-СТОЛОВЫЕ И ПРИРОДНЫЕ СТОЛОВЫЕ. МЕТОДЫ ОПРЕДЕЛЕНИЯ ИОНОВ КАЛЬЦИЯ И МАГНИЯ ОКСТУ 9109
— Все документы — ГОСТы — ГОСТ 23268.5-78* (09.07.1986) ВОДЫ МИНЕРАЛЬНЫЕ ПИТЬЕВЫЕ ЛЕЧЕБНЫЕ, ЛЕЧЕБНО-СТОЛОВЫЕ И ПРИРОДНЫЕ СТОЛОВЫЕ. МЕТОДЫ ОПРЕДЕЛЕНИЯ ИОНОВ КАЛЬЦИЯ И МАГНИЯ ОКСТУ 9109 Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
 Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
 Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
 Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
 Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии
Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии
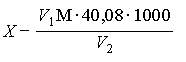 ,
,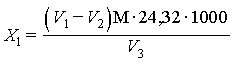 ,
,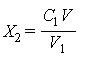 ,
,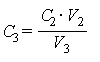 ,
,