Утв. Постановлением Государственного комитета СССР по управлению качеством продукции и стандартам от 29 декабря 1990 г. N 3671
Государственный стандарт Союза ССР ГОСТ 15848.1-90 (ИСО 6331-83)
"РУДЫ ХРОМОВЫЕ И КОНЦЕНТРАТЫ. МЕТОД ОПРЕДЕЛЕНИЯ ОКСИДА ХРОМА (III)"
Chromium ores and concentrates. Method for determination of chromium oxide (III)
Срок действия - с 1 января 1992 г.
до 1 января 2002 г.
отмен с 1995
Взамен ГОСТ 15848.1-70
Информационные данные
1. Разработан Министерством металлургии СССР
Разработчики
Н.И. Стенина (руководитель темы), Г.В. Шибалко, Н.И. Забугорная
2. Утвержден и введен в действие постановлением Государственного комитета СССР по управлению качеством продукции и стандартам от 29.12.90 N 3671
Приложение "Руды хромовые и концентраты. Определение содержания хрома. Титриметрический метод" настоящего стандарта подготовлено на основе прямого применения международного стандарта ИСО 6331-81
3. Взамен ГОСТ 15848.1-70
4. Ссылочные нормативно-технические документы
|
Обозначение НТД, на который дана ссылка
|
Номер раздела приложения
|
|
ГОСТ 83-79
|
2
|
|
ГОСТ 435-77
|
2
|
|
ГОСТ 1277-75
|
2
|
|
ГОСТ 4204-77
|
2
|
|
ГОСТ 4208-72
|
2
|
|
ГОСТ 4220-75
|
2
|
|
ГОСТ 4233-77
|
2
|
|
ГОСТ 4461-77
|
2
|
|
ГОСТ 4462-78
|
2
|
|
ГОСТ 4465-74
|
2
|
|
ГОСТ 5839-77
|
2
|
|
ГОСТ 6552-80
|
2
|
|
ГОСТ 11125-84
|
2
|
|
ГОСТ 14262-78
|
2
|
|
ГОСТ 15848.0-90
|
2 приложение
|
|
ГОСТ 20478-75
|
2
|
|
ГОСТ 20490-75
|
2
|
|
ИСО 6629-81
|
Приложение
|
Настоящий стандарт распространяется на хромовые руды и концентраты и устанавливает титриметрический серебряно-персульфатный метод определения массовой доли оксида хрома (III) (от 10 до 65%).
Метод определения оксида хрома по международному стандарту ИСО 6331-84 указан в приложении.
Метод основан на окислении трехвалентного хрома в сернокислой среде надсернокислым аммонием в присутствии катализатора азотнокислого серебра или смеси сернокислого кобальта и сернокислого никеля.
Шестивалентный хром восстанавливают раствором соли Мора и избыток его оттитровывают раствором марганцовокислого калия. При массовой доле ванадия в анализируемом образце до 0, 05% допускается шестивалентный хром титровать непосредственно раствором соли Мора в присутствии индикатора фенилантраниловой кислоты. Конечную точку титрования можно устанавливать потенциометрически.
Навеску руды или концентрата сплавляют с пероксидом натрия или разлагают в смеси серной и фосфорной кислот.
1. Общие требования
Общие требования к методу определения оксида хрома - по ГОСТ 15848.0.
2. Аппаратура, реактивы и растворы
Печь муфельная с терморегулятором, обеспечивающая температуру нагрева не ниже 800°С.
Установка потенциометрическая с парами электродов: платина-хлорид-серебряный, платина-вольфрам или другими электродами, обеспечивающими четкое фиксирование конечной точки титрования (к.т.т.).
Тигли железные.
Кислота азотная по ГОСТ 4461 или ГОСТ 11125.
Кислота ортофосфорная по ГОСТ 6552.
Кислота серная по ГОСТ 4204 или ГОСТ 14262 и разбавленная 1 : 1. 1 : 4, 1 : 100.
Марганец (II) сернокислый 5-водный по ГОСТ 435 (сульфат марганца (II), раствор с массовой концентрацией 1 г/дм3.
Серебро азотнокислое по ГОСТ 1277 (нитрат серебра (I), раствор с массовой концентрацией 1 г/дм3. Для большей устойчивости раствора азотнокислого серебра приливают 0, 5 см3 азотной кислоты на каждый 1 дм3 раствора. Раствор хранят в склянке из темного стекла.
Кобальт (II) сернокислый 7-водный по ГОСТ 4462 (сульфат кобальта (II).
Никель (II) сернокислый 7-водный по ГОСТ 4465 (сульфат никеля (II)).
Кобальто-никелевый катализатор, раствор: 15 г сернокислого кобальта и 15 г сернокислого никеля помещают в стакан вместимостью 700 - 800 см3, приливают 500 см3 воды и перемешивают до растворения солей.
Аммоний надсернокислый по ГОСТ 20478 (пероксодисульфат аммония), раствор с массовой концентрацией 250 г/дм3. Раствор годен к применению в течение 7 - 10 сут.
Натрий углекислый по ГОСТ 83 (карбонат натрия), раствор с массовой концентрацией 2 г/дм3.
Натрий хлористый по ГОСТ 4233 (хлорид натрия), раствор с массовой концентрацией 50 г/дм3.
Кислота фенилантраниловая, раствор, содержащий 2 г кислоты в 100 см3 раствора углекислого натрия.
Натрия перекись (натрия пероксид).
Калий двухромовокислый по ГОСТ 4220 (дихромат калия), раствор с молярной концентрацией эквивалента с (1/6 K2Cr2O7) = 0, 1 моль/дм3; 4, 9032 г двухромокислого калия, дважды перекристаллизованного и высушенного в течение 2 - 3 ч при 150 - 170°С растворяют в 500 - 600 см3 воды в мерной колбе вместимостью 1000 см3, доливают водой до метки и перемешивают, 1 см3 раствора соответствует 0, 002533 г оксида хрома (III).
Соль закиси железа и аммония двойная сернокислая (соль Мора) по ГОСТ 4208, раствор с молярной концентрацией эквивалента c(NH4)2SO4·FeSO4·6H2O)=0, 1 моль/дм3 39, 5 г соли Мора растворяют в 250 см3 серной кислоты (1 : 4), раствор фильтруют в мерную колбу вместимостью 1000 см3, доливают водой до метки и перемешивают.
Для установления массовой концентрации раствора соли Мора 25 см3 раствора двухромовокислого калия с молярной концентрацией эквивалента с (1/6 K2Cr2O7) = 0, 1 моль/дм3 помещают в коническую колбу вместимостью 500 см3, приливают 200 см3 воды, 40 см3 серной кислоты (1 : 1), раствор перемешивают и охлаждают. Затем приливают 5 - 6 капель раствора фенилантраниловой кислоты, снова перемешивают и медленно титруют раствором соли Мора до перехода вишневой окраски раствора в зеленую.
Массовую концентрацию раствора соли Мора (С) по оксиду хрома (III) в граммах на кубический сантиметр вычисляют по формуле
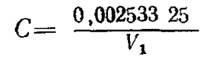 ,
,
где 0, 002533 - масса оксида хрома (III), соответствующая 1 см3 раствора двухромовокислого калия, г;
25 - объем раствора двухромовокислого калия, взятый для титрования, см3;
V1 - объем раствора соли Мора, израсходованный на титрование с учетом значения контрольного опыта, см3.
Массовую концентрацию раствора соли Мора допускается устанавливать по стандартному образцу, близкому по составу к анализируемым пробам. Стандартный образец проводят через ход анализа, как указано в пп. 3.1 и 3.2.
Массовую концентрацию (С) раствора соли Мора по оксиду хрома (III) в граммах на кубический сантиметр вычисляют по формуле
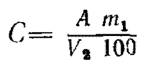 ,
,
где A - аттестованное значение массовой доли оксида хрома (III) в стандартном образце, %;
m1 - масса навески высушенного стандартного образца, г;
V2 - объем раствора соли Мора, израсходованный на титрование, с учетом значения контрольного опыта, см3.
Натрий щавелевокислый по ГОСТ 5839, перекристаллизованный и высушенный при 105 - 110°С до постоянной массы
Калий марганцовокислый, по ГОСТ 20490, раствор с молярной концентрацией эквивалента c (1/5 KMnO4) = 0, 1 моль/дм3: 32 г марганцовокислого калия растворяют в 1000 см3 воды, переливают в бутыль из темного стекла вместимостью 10 дм3, приливают 9 дм3 воды, перемешивают и оставляют на 7 - 10 сут. Раствор переливают, пользуясь сифоном, не доходящим до дна бутыли на 15 мм, в другую бутыль из темного стекла. Вместо сифонирования можно применять фильтрование через прокаленный асбест.
Для установления массовой концентрации марганцовокислого калия 0, 2 г щавелевокислого натрия помещают в коническую колбу вместимостью 250 см3 и растворяют при слабом нагревании в 75 см3 воды, затем приливают 15 см3 серной кислоты (1 : 1), нагревают до 70 - 80°С и титруют раствором марганцовокислого калия до появления розовой окраски, устойчивой в течение 1 - 2 мин.
Массовую концентрацию раствора марганцовокислого калия (С) по оксиду хрома (III) в граммах на кубический сантиметр вычисляют по формуле
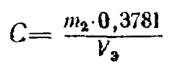 ,
,
где m2 - масса навески щавелевокислого натрия, г;
0, 3781 - коэффициент пересчета щавелевокислого натрия на оксид хрома (III);
V3 - объем раствора марганцовокислого калия, израсходованный на титрование, с учетом значения контрольного опыта, см3.
Для установления соотношения между растворами марганцовокислого калия и соли Мора в коническую колбу вместимостью 250 см3 приливают 20 см3 раствора соли Мора с молярной концентрацией эквивалента 0, 1 моль/дм3, 50 - 60 см3 воды и титруют раствором марганцовокислого калия с молярной концентрацией эквивалента 0, 1 моль/дм3 до появления слабо-розовой окраски, устойчивой в течение 1 - 2 мин.
Коэффициент, определяющий соотношение между объемом раствора марганцовокислого калия, израсходованного на титрование, и объемом раствора соли Мора, взятого на титрование (K), вычисляют по формуле
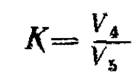 ,
,
где V4 - объем раствора марганцовокислого калия с молярной концентрацией эквивалента 0, 1 моль/дм3 израсходованный на титрование, с учетом значения контрольного опыта, см3;
V5 - объем раствора соли Мора, взятый для титрования, см3.
3. Проведение анализа
3.1 Обратное титрование избытка соли Мора раствором марганцовокислого калия
3.1.1 Разложение навески в смеси серной и фосфорной кислот
0, 2 г хромовой руды или концентрата помещают в колбу вместимостью 500 см3, смачивают водой, приливают 10 см3 фосфорной кислоты, перемешивают, приливают 20 см3 серной кислоты, вновь перемешивают и нагревают до разложения навески, периодически перемешивая содержимое колбы. Затем раствор охлаждают, приливают 300 - 500 см3 воды и перемешивают. К полученному раствору приливают 5 см см3 раствора сернокислого марганца, 10 см3 раствора азотнокислого серебра или 10 см3 раствора кобальто-никелевого катализатора, 50 см3 раствора надсернокислого аммония и нагревают до появления малиновой окраски, что указывает на полное окисление хрома. Раствор кипятят до прекращения выделения пузырьков кислорода, приливают 10 см3 раствора хлористого натрия и снова кипятят до исчезновения малиновой окраски.
Раствор охлаждают, приливают раствор соли Мора до перехода окраски из желтой в зеленую и в избыток 5 - 6 см3. Избыток соли Мора оттитровывают раствором марганцовокислого калия до появления розовой окраски устойчивой в течение 1 - 2 мин.
3.1.2. Разложение навески сплавлением с пероксидом натрия
0, 2 г хромовой руды или концентрата помещают в железный тигель и насыпают 3 - 4 г пероксида натрия. Содержимое тигля перемешивают, насыпают еще 1 - 2 г пероксида натрия и сплавляют при 700 - 750°С до получения однородного плава. Тигель охлаждают, помещают в стакан вместимостью 600 см3 и выщелачивают плав 100 - 150 см3 воды; тигель вынимают и обмывают водой. К содержимому стакана приливают серную кислоту (1 : 1) до растворения осадка гидроксидов. При наличии на дне стакана окалины раствор фильтруют через вату в колбу вместимостью 500 см3. Вату промывают 5 - 6 раз серной кислотой (1·100). К раствору приливают 30 см3 серной кислоты (1 : 1), 5 см3 фосфорной кислоты и кипятят 20 - 25 мин для разрушения основной массы пероксида водорода. Раствор охлаждают, приливают 5 см3 раствора сернокислого марганца и анализ ведут, как указано в п. 3.1.1.
3.2 Прямое титрование шестивалентного хрома раствором соли Мора (для руд и концентратов, содержащих менее 0, 05% ванадия)
3.2.1. При разложении навески пробы в смеси серной и фосфорной кислот анализ проводят, как указано в п. 3.1.1. После этого раствор охлаждают, приливают 25 см3 серной кислоты (1 : 1), перемешивают и вновь охлаждают, приливают 5 - 6 капель фенилантраниловой кислоты и титруют раствором соли Мора до перехода вишневой окраски раствора в зеленую.
При потенциометрической индикации конечной точки титрования (к.т.т.) после приливания 25 см3 серной кислоты (1 : 1) раствор перемешивают и охлаждают. В колбу опускают соответствующую пару электродов и титруют раствором соли Мора до максимального скачка потенциалов при перемешивании анализируемого раствора на магнитной мешалке.
3.2.2. При сплавлении навески с пероксидом натрия анализ проводят, как указано в п. 3.1.2. После чего раствор охлаждают, приливают 25 см3 серной кислоты (1 : 1), перемешивают и вновь охлаждают, приливают 5 - 6 капель фенилантраниловой кислоты и титруют раствором соли Мора до перехода вишневой окраски раствора в зеленую.
Допускается потенциометрическая индикация конечной точки титрования (к.т.т.), как указано в п. 3.2.1.
4. Обработка результатов
4.1. Массовую долю оксида хрома (III) (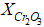 ) в процентах в рудах и концентратах вычисляют по формуле
) в процентах в рудах и концентратах вычисляют по формуле
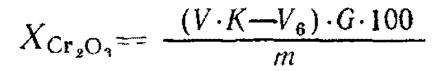 ,
,
где V - объем раствора соли Мора, взятый для анализа, см3;
K - соотношение между объемами растворов марганцовокислого калия и соли Мора;
V6 - объем раствора марганцовокислого калия, израсходованный на титрование избытка раствора соли Мора, см3;
С - массовая концентрация раствора марганцовокислого калия по оксиду хрома (III), г/см3;
m - масса навески высушенной руды или концентрата, г.
4.2. Массовую долю оксида хрома (III) (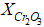 ) в процентах в рудах и концентратах, содержащих до 0, 05% ванадия, вычисляют по формуле
) в процентах в рудах и концентратах, содержащих до 0, 05% ванадия, вычисляют по формуле
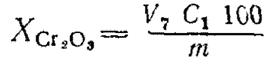 ,
,
где V7 - объем раствора соли Мора, израсходованный на титрование, с учетом величины контрольного опыта, см3;
C1 - массовая концентрация раствора соли Мора по оксиду хрома (III), г/см3.
4.3 Нормы точности и нормативы контроля точности определения массовой доли оксида хрома (III) в процентах приведены в табл 1.
Таблица 1
|
Массовая доля оксида хрома (lll) %
|
Δ
|
dk
|
d2
|
d3
|
δ
|
|
От 10 до 20
Св 20 " 50
" 50 " 65
|
0, 3
0, 4
0, 5
|
0, 3
0, 5
0, 6
|
0, 3
0, 4
0, 5
|
0, 4
0, 5
0, 6
|
0, 2
0, 3
0, 3
|
Приложение
Руды хромовые и концентраты
Определение содержания хрома. Титриметрический метод (ИСО 6331-83)
1. Область применения
Настоящий международный стандарт включает титриметрический метод определения хрома в хромовых рудах и концентратах, содержащих более 7% (m/m) хрома.
Настоящий стандарт следует применять вместе с ГОСТ 15848.0 (ИСО 6629).
2. Ссылка
ГОСТ 15848.0 (ИСО 6629). Хромовые руды и концентраты. Методы химического анализа. Общие требования
3. Сущность метода
Сплавление навески материала с пероксидом натрия. Выщелачивание плава водой, подкисление серной кислотой и удаление избытка пероксида водорода кипячением.
Окисление ионов хрома (III) до хромат-ионов пероксидисульфатом аммония в присутствии нитрата серебра в качестве катализатора.
Титрование храма (VI) раствором сульфата железа (II) аммония, конечную точку находят или визуально, добавлением избытка сульфата железа (II) аммония и обратным титрованием, или прямым потенциометрическим титрованием
4. Реактивы
4.1. Пероксид натрия.
4.2 Серная кислота, ρ= 1, 84 г/см3.
4.3 Серная кислота, разбавленная 1 : 1.
4.4. Серная кислота, разбавленная 1 : 4
4.5 Ортофосфорная кислота, ρ = 170 г/см3.
4.6 Сульфат марганца (II), раствор 100 г/дм3
Растворяют 100 г сернокислого марганца (MnSO4·7H2O) в 1 дм3 воды.
4.7. Сульфат марганца (II), раствор 1 г/дм3 Смешивают 10 см3 раствора сульфата марганца (п. 4 6) с 1 дм3 воды.
4.8 Нитрат серебра, раствор 1 г/дм3.
Для обеспечения большей стабильности раствора нитрата серебра добавляют по 0, 5 см3 азотной кислоты на каждый 1 дм3 раствора.
Хранят раствор в сосуде из темного стекла.
4.9. Пероксидисульфат аммония, раствор 200 г/дм3. Готовят раствор непосредственно перед употреблением.
4.10. Хлористый натрий, раствор 50 г/дм3. Растворяют 50 г хлористого натрия (NaCl) в 1 дм3 воды.
4.11 Перманганат калия, стандартный титрованный раствор (1/5 KMnO4) ≈0, 1 моль/дм3.
4.11.1 Приготовление раствора
Растворяют 32 г перманганата калия в 1000 см3 воды, переносят раствор в бутыль из темного стекла вместимостью 10 дм3, добавляют 9 дм3 воды, перемешивают и оставляют стоять 7 - 10 дней.
Пользуясь сифоном, переливают раствор в другую бутыль из темного стекла (трубку сифона вставляют в бутыль так, чтобы конец трубки находился на расстоянии 15 см от дна бутыли)
4.11.2. Установка титра раствора
Помещают 0, 2 г безводного оксалата натрия, предварительно высушенного при 105 - 110°С, в коническую колбу вместимостью 250 см3, добавляют 75 см3 воды и растворяют при нагревании Добавляют 15 см3 раствора серной кислоты (п. 4.3) и нагревают до 70 - 80°С. Титруют раствором перманганата калия (п. 4.11.1) до розовой окраски, не исчезающей в течение 1 - 2 мин.
Титр (Т) раствора перманганата калия, выраженный в граммах железа, рассчитывают по формуле
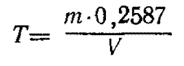 ,
,
где m - масса навески оксалата натрия, г;
V - объем раствора перманганата калия, израсходованный на титрование, см3;
0, 2587 - фактор пересчета оксалата натрия на хром.
4.12 Сульфат железа (II) аммония, стандартный титрованный раствор c (NH4)2Fe(SO4)2·6H2O≈0, 1 моль/дм3.
4.12.1. Приготовление раствора
Растворяют 39, 5 г сульфата железа (II) аммония в 200 см3 раствора серной кислоты (п. 4.4), отфильтровывают раствор в мерную колбу вместимостью 1000 см3, доливают водой до метки и перемешивают.
4.12.2. Установка титра
Помещают 0, 2 г бихромата калия, перекристаллизованного и высушенного при 180 - 200°С до постоянной массы, в стакан вместимостью 600 см3, растворяют в 200 см3 воды, добавляют 50 см3 раствора серной кислоты (п. 4.4), перемешивают и охлаждают. Помещают электроды (п. 5.1.1) в стакан и титруют раствором сульфата железа (II) аммония (п. 4.12.1) до максимального отклонения стрелки милливольтметра (п 5.1.3).
Титр (T1) раствора сульфата железа (ll) аммония в г/см3 рассчитывают по формуле
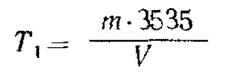 ,
,
где m - масса бихромата калия, г,
V - объем раствора сульфата железа (II) аммония, израсходованный на титрование, см3;
0, 3535 - фактор пересчета бихромата калия на хром.
Титр раствора сульфата железа (II) аммония изменяется и должен контролироваться в каждой серии определений.
4.12.3 Расчет соотношения между растворами сульфата железа (II) аммония и перманганата калия
Отбирают пипеткой или с помощью бюретки 20 см3 раствора сульфата железа (II) аммония в раствор контрольного опыта, предварительно оттитрованного раствором перманганата калия (п. 4.11)). Затем добавляют 50 - 60 см3 воды и титруют снова раствором перманганата калия (п. 4.11) до появления розовой окраски, не исчезающей в течение 1 - 2 мин
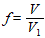 ,
,
где V - объем раствора перманганата калия, израсходованный на титрование, см3;
V1 - объем раствора сульфата железа (II) аммония, взятый для титрования, см3.
4.13 Нитрит натрия, раствор 10 г/дм3.
4.14. Мочевина.
5. Аппаратура для потенциометрического титрования
5.1. Пара электродов. индикаторный платиновый электрод и электрод сравнения каломельный или вольфрамовый
5.2 Магнитная мешалка.
5.3. Милливольтметр электронного типа с высоким полным сопротивлением для измерения рН, пригодный для записи отклонений потенциала в точке эквивалентности при титровании по выбранной схеме индикатор/электрод сравнения (п. 5.1).
6. Проведение анализа
6.1. Навеска материала. Для анализа берут 0, 5 г материала.
6.2 Разложение навески. Помещают навеску материала (п. 6.2) в корундовый никелевый или железный тигель и добавляют 3 - 4 г пироксида натрия (п. 4.1). Перемешивают содержимое тигля стеклянной палочкой, покрывают слоем пероксида натрия (1 - 2 г) и осторожно нагревают при 400 - 500°С, затем при 800 - 850°С, перемешивая содержимое тигля и поддерживая температуру постоянной до тех пор, пока не будет достигнута гомогенная масса расплава (5 - 7 мин). Затем тигель охлаждают, помещают в стакан вместимостью 600 см3 и выщелачивают плав 100 - 150 см3 горячей воды. Тигель обмывают водой. Если частицы плава пристали к стенкам тигля, добавляют 7 - 3 капель раствора серной кислоты (п. 4.3) и 2 - 3 см3 воды. После полного растворения частиц плава соединяют полученный таким образом раствор с основным раствором и снова обмывают тигель водой.
Добавляют раствор серной кислоты (п. 4.3) до полного растворения осадка гидроксидов, разбавляют раствор водой до 300 - 350 см3, добавляют 10 см3 серной кислоты (п. 4.2), 5 см3 ортофосфорной кислоты (п. 4.5) и кипятят в течение 20 - 25 мин для разложения основной массы пероксида водорода.
Фильтруют раствор для отделения нерастворимого осадка через неплотный фильтр или лавсановую вату, собирая фильтрат в стакан вместимостью 800 см3. Промывают фильтр с осадком 6 - 8 раз горячей водой и отбрасывают его.
Добавляют 10 см3 раствора титрата серебра (п. 4.8) и 1 см3 раствора сульфата марганца (II) (п. 4.7) в том случае, если руда содержит менее 0, 1% по массе марганца. Добавляют 25 см3 раствора пероксида сульфата аммония (п. 4.9) и нагревают раствор до появления малиновой окраски, что указывает на полноту окисления хрома. Кипятят раствор в течение 12 - 15 мин для разрушения периксидисульфата аммония, добавляют 10 см3 раствора хлористого натрия (п 4.10) и снова кипятят 8 - 10 мин для разрушения марганцевой кислоты и коагуляции осадка хлористого серебра. Добавляют 2 см3 раствора сернокислого марганца (п. 4.7) и кипятят только 3 мин
Если розовая окраска появляется, продолжают анализ, как указано выше начиная со слов: "Кипятят раствор в течение 12 - 15 мин"
6.3. Определение
6.3.1 Титрование с визуальным фиксированием точек эквивалентности
Добавляют раствор сульфата железа (II) аммония (п. 4.12) из бюретки в стакан, содержащий испытуемый раствор, до тех пор, пока цвет раствора не перейдет из желтого в зеленый (хром (VI) и ванадий (V) восстанавливаются до хрома (III) и ванадия (IV). Добавляют из бюретки еще 5 - 10 см3 раствора сульфата железа (II) аммония в избыток. Титруют раствором парманганата калия (п. 4.11) до розовой окраски не исчезающей в течение 1 - 2 мин.
Примечание. Одновременно перманганатом калия титруется ванадий (IV), Поэтому объем раствора сульфата железа (II) аммония соответствует только содержанию хрома.
6.3.2 Потенциометрическое титрование
Добавляют к испытуемому раствору 60 см3 раствора серной кислоты (п. 4.4), в стакан помещают два электрода (п. 5.3.1), включают магнитную мешалку (п. 5.12) и титруют раствором сульфата железа (II) аммония до максимального отклонения стрелки милливольтамперметра к концу титрования - медленно
Примечание. Объем израсходованного на титрование раствора соответствует общему содержанию хрома и ванадия.
Добавляют по каплям раствор перманганата калия (п. 4.11) до появления розовой окраски не исчезающей в течение 2 мин для окисления ванадия. Восстанавливают избыток раствора перманганата калия, добавляя по каплям раствор нитрата калия (п. 4.13) до исчезновения розовой окраски. Немедленно добавляют 1 - 1, 5 г мочевины (п. 4.14) для удаления избытка нитрата калия. Титруют ванадий раствором сульфата железа (II) аммония до максимального отклонения стрелки милливольтметра.
Разница в объемах раствора сульфата железа (II) аммония, израсходованных на титрование соответствует содержанию хрома.
7. Обработка результатов
7.1 Расчет содержания хрома при титровании с визуальной фиксацией точки эквивалентности
Содержание хрома (Cr) в процентах (m/m) вычисляют по формуле
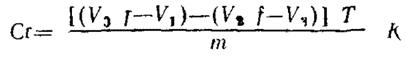 ,
,
где V0- объем раствора сульфата железа (II) аммония, израсходованный на проведение анализа, см3,
V1 - объем раствора перманганата калия, израсходованный на титрование избытка раствора сульфата железа (II) аммония, см3,
V2 - объем раствора сульфата железа (II) аммония, добавленный к раствору контрольного опыта, см3,
V3 - объем раствора перманганата калия, израсходованный на титрование избытка раствора сульфата железа (II) аммония в контрольном опыте, см3,
f - соотношение между растворами сульфата железа (II) аммония и перманганата калия,
Т - титр раствора перманганата калия, выраженный в г/см3 хрома;
m - масса навески материала, г
К - фактор пересчета содержания хрома на сухое вещество
7.2 Расчет содержания хрома при потенциометрическом титровании
Содержание хрома (Cr) в процентах (m/m) вычисляют по формуле
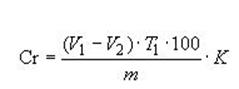 ,
,
где V1 - объем раствора сульфата железа (II) аммония, израсходованный на титрование хрома и ванадия, см3,
V2 - объем раствора сульфата железа (II) аммония израсходованный на титрование ванадия, см3
T1 - титр раствора сульфата железа (II) аммония, выраженный в г/см3 хрома
m - масса навески материала, г;
К - фактор пересчета содержания хрома на сухое вещество.
7.3 Пересчет содержания хрома на окись хрома
Cr2O3[%(m/m)]=1, 4615 Cr[%(m/m)]
7.4. Допускаемые расхождения между результатами двух параллельных анализов не должны превышать указанных в таблице.
|
Содержание хрома, %, (m/m)
|
Допускаемые расхождения, %, (m/m)
|
|
От 7 до 15
Св. 15 " 30
" 30
|
0, 2
0, 3
0, 4
|
![]() — Все документы — ГОСТы — ГОСТ 15848.1-90 (ИСО 6331-83) РУДЫ ХРОМОВЫЕ И КОНЦЕНТРАТЫ. МЕТОД ОПРЕДЕЛЕНИЯ ОКСИДА ХРОМА (III)
— Все документы — ГОСТы — ГОСТ 15848.1-90 (ИСО 6331-83) РУДЫ ХРОМОВЫЕ И КОНЦЕНТРАТЫ. МЕТОД ОПРЕДЕЛЕНИЯ ОКСИДА ХРОМА (III) Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
 Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
 Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
 Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
 Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии
Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии
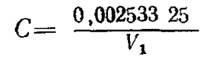 ,
,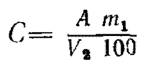 ,
,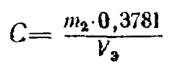 ,
,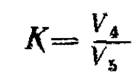 ,
,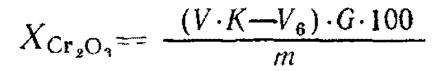 ,
,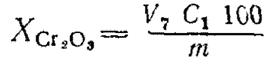 ,
,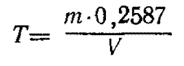 ,
,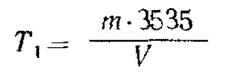 ,
,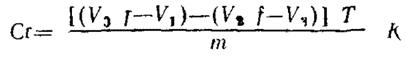 ,
,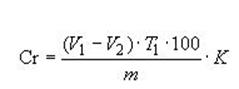 ,
,