Введен в действие приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 г. N 1766-ст
Межгосударственный стандарт ГОСТ 31744-2012 (ISO 7937:2004)
"МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ. МЕТОД ПОДСЧЕТА КОЛОНИЙ Clostridium perfringens"
Microbiology of food and animal feeding stuffs. Clostridium perfringens colony-count technique
Дата введения - 1 июля 2013 г.
Введен впервые
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
1 Область применения
Настоящий стандарт устанавливает метод подсчета жизнеспособных микроорганизмов Clostridium perfringens.
Настоящий стандарт применяется при исследовании продуктов, предназначенных для употребления в пищу человеком и к кормам для животных, а также образцов окружающей среды в местах производства и оборота пищевых продуктов.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие правила микробиологических исследований
ГОСТ ISO 11133-1-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории
ГОСТ ISO 11133-2-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред
ГОСТ ISO 16140-2011 Микробиология пищевых продуктов и кормов для животных. Протокол валидации альтернативных методов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов по указателю "Национальные стандарты", составленному по состоянию на 1 января текущего года, и по соответствующим информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применяют следующие термины с соответствующими определениями:
3.1 Clostridium perfringens (С. perfringens): Бактерии, которые образуют типичные колонии (черный осадок, вызванный разложением сульфита до сульфида, который окрашивает колонии в черный цвет) в определенных селективных средах, и которые дают положительные реакции подтверждения, если испытания проводят в соответствии с одним из двух методов, указанном в настоящем стандарте.
3.2 подсчет колоний С. perfringens: Определение количества способных к росту и подтвержденных бактерий Clostridium perfringens в см3 или г образца при условии проведения испытания в соответствии с методом, указанным в настоящем стандарте.
4 Сущность метода
4.1 Посев в чашки Петри определенного количества испытуемой пробы, если исходный продукт жидкий, или установленного количества исходной суспензии.
Следующий посев в чашки Петри проводят в аналогичных условиях с использованием десятикратного разведения испытуемой пробы или исходной суспензии.
Добавляют селективную среду (метод пластинчатого посева) и заливают посев сверху слоем той же среды.
4.2 Анаэробная инкубация чашек при 37°С в течение (20±2) ч.
4.3 Подсчет типичных колоний
4.4 Подтверждение ряда типичных колоний и определение количества колоний С. perfringens в г или см3 продукта.
5 Разведение, питательные среды и реактивы
Для текущей лабораторной практики см. [1], ГОСТ ISO 7218, ГОСТ ISO 11133-1 и ГОСТ ISO 11133-2 для приготовления, производства, проверки и применения питательных сред.
5.1 Разведения
В общем случае согласно ГОСТ ISO 7218.
5.2 Сульфит-циклосериновый агар (SC)
5.2.1 Состав в соответствии с таблицей 1.
Таблица 1
|
Состав
|
Значение показателя
|
|
Ферментативный белковый гидролизат, г
|
15, 0
|
|
Ферментативный соевый гидролизат, г
|
5, 0
|
|
Дрожжевой экстракт, г
|
5, 0
|
|
Двунатрий дисульфит безводный (Na2S2O5), г
|
1, 0
|
|
Железо (III) - аммония цитрат*, г
|
1, 0
|
|
Агар, г
|
От 9, 0 до 18, 0**
|
|
Вода, см3
|
1000
|
|
* Реактив должен содержать не менее 15% железа (массовая доля).
** В зависимости от гелеобразующей способности агара.
|
5.2.1.1 Приготовление среды
Растворяют компоненты среды в горячей воде и доводят до кипения. Устанавливают уровень рН, чтобы после стерилизации он соответствовал(7, 6±0, 2) при 25°С.
Разливают среду во флаконы или бутылки соответствующей емкости.
Стерилизуют в автоклаве (6.1) 15 мин при 121°С.
Хранят в холодильнике при температуре (5±3)°С не более двух недель после приготовления.
5.2.2 Раствор D-циклосерина
5.2.2.1 Состав в соответствии с таблицей 2.
Таблица 2
|
Состав
|
Значение показателя
|
|
D-циклосерин*, г
|
4, 0
|
|
Вода, см3
|
100
|
|
* Используется белый кристаллический порошок.
|
5.2.2.2 Приготовление среды
Растворяют D-циклосерин в воде и стерилизуют.
Среду хранят в холодильнике при температуре (3±2)°С не более четырех недель после приготовления.
5.2.3 Полная среда
Непосредственно перед посевом чашечным методом (см. п. 9.2) добавляют 1 см3 раствора D-циклосерина (5.2.2) к каждой порции стерильной расплавленной основы среды объемом 100 см3 (5.3.1), охлажденной до 44°С- 47°С.
5.2.4 Проверка качества среды (SC)
Определение селективности и качества среды проводят по ГОСТ ISO 11133-1. Для проверки характеристик применяют ГОСТ ISO 11133-2 (таблица В.1).
5.3 Жидкая тиогликолатная среда
5.3.1 Состав в соответствии с таблицей 3.
Таблица 3
|
Состав
|
Значение показателя
|
|
Ферментативный перевар казеина, г
|
10, 0
|
|
L-Цистин, г
|
0, 5
|
|
D - Глюкоза, г
|
5, 5
|
|
Дрожжевой экстракт, г
|
5, 0
|
|
Хлорид натрия, г
|
2, 5
|
|
Натрия тиогликолат (меркаптоацетат), г
|
0, 5
|
|
Агар, г
|
0, 5-2, 0*
|
|
Диазорезорин, г
|
0, 001
|
|
Вода, см3
|
1000
|
|
* В зависимости от гелеобразующей способности агара.
|
5.3.2 Растворяют компоненты в воде при необходимости раствор доводят до кипения. Устанавливают уровень рН, чтобы после стерилизации он соответствовал (7, 3±0, 2) при 25°С.
Среду разливают по 10 см3 в пробирки 16 х 160 мм и стерилизуют в автоклаве 15 мин при 121°С.
Перед использованием среда должна быть деаэрирована.
5.3.3 Проверка качества тиогликолатной среды
Определение селективности и качества среды проводят по ГОСТ ISO 11133-1. Для проверки характеристик применяют ГОСТ ISO 11133-2 (таблица В.4).
5.4 Лакто-сульфитная среда (LS) (необязательно)
5.4.1 Основа среды
5.4.1.1 Состав в соответствии с таблицей 4.
Таблица 4
|
Состав
|
Значение показателя
|
|
Ферментативный перевар казеина, г
|
5, 0
|
|
Дрожжевой экстракт, г
|
2, 5
|
|
Хлорид натрия, г
|
2, 5
|
|
Лактоза, г
|
10, 0
|
|
L-Цистин гидрохлорид, г
|
0, 3
|
|
D-Глюкоза, г
|
5, 5
|
|
Вода, см3
|
1000
|
5.4.1.2 Приготовление
Растворяют компоненты в воде, при необходимости раствор доводят до кипения. Устанавливают уровень рН, чтобы после стерилизации он соответствовал (7, 1±0, 2) при 25°С.
Среду разливают по 8 см3 в пробирки с обратными трубками Дархема и стерилизуют в автоклаве 15 мин при 121°С.
Среду хранят в холодильнике при температуре (3±2)°С не более четырех недель после приготовления.
5.4.2 Раствор безводного метабисульфита натрия
5.4.2.1 Состав в соответствии с таблицей 5.
Таблица 5
|
Состав
|
Значение показателя
|
|
Двунатрий дисульфит (Na2S2O5) безводный, г
|
1, 2
|
|
Вода, см3
|
100
|
5.4.2.2 Приготовление
Растворяют двунатрий дисульфит в воде и стерилизуют.
Раствор используют в течение дня.
5.4.3 Раствор цитрата железа (III) - аммония
5.4.3.1 Состав в соответствии с таблицей 6.
Таблица 6
|
Состав
|
Значение показателя
|
|
Железа (III) - аммония цитрат, г
|
1, 0
|
|
Вода, см3
|
100
|
5.4.3.2 Приготовление раствора
Растворяют цитрат железа (III) - аммония в воде и стерилизуют раствор фильтрованием.
Раствор используют в течение дня.
5.4.4 Полная среда
Перед составлением полной среды ее деаэрируют нагреванием и последующим быстрым охлаждением. В случае хранения среды во флаконах с завинчивающимися крышками, крышки ослабляют перед нагреванием и затем завинчивают перед охлаждением.
Затем к каждым 8 см3 основы среды (5.4.1) добавляют 0, 5 см3 раствора цитрата железа (III) - аммония (5.4.3) и 0, 5 см3 раствора двунатрия дисульфита (5.4.2).
Среда используется в течение дня.
5.5 Подвижная нитратная среда (необязательно)
5.5.1 Состав в соответствии с таблицей 7.
Таблица 7
|
Состав
|
Значение показателя
|
|
Ферментативный гидролизат казеина, г
|
5, 0
|
|
Мясной экстракт, г
|
3, 0
|
|
Галактоза, г
|
5, 0
|
|
Глицерин, г
|
5, 0
|
|
Азотнокислый калий (KNO3), г
|
1, 0
|
|
Динатрийфосфат (Na2HPO4), г
|
2, 5
|
|
Агар, г
|
1, 0-5, 0*
|
|
Диазорезорин, г
|
0, 001
|
|
Вода, см3
|
1000
|
|
* В зависимости от гелеобразующей способности агара.
|
5.5.2 Приготовление
Растворяют компоненты в воде, при необходимости раствор доводят до кипения. Устанавливают уровень рН, чтобы после стерилизации он соответствовал (7, 3±0, 2) при 25°С.
Среду разливают в пробирки с выросшей разводкой-культурой по 10 см3 и стерилизуют в автоклаве 15 мин при 121°С. Если среду не использовали в день приготовления, то ее хранят в холодильнике при температуре (5±3)°С не более четырех недель после приготовления.
Непосредственно перед использованием подогревают в кипящей воде или на пару в течение 15 мин и затем быстро охлаждают до температуры разведения.
5.6 Нитратный реактив обнаружения (необязательно)
5.6.1 Раствор 5-амино-2-нафталинсульфокислоты (5-2-ANSA)
Растворяют 0, 1 г 5-2-ANSA в 100 см3 15% (объемная доля) раствора уксусной кислоты. Фильтруют через бумажный фильтр.
Реактив хранят в хорошо закупоренном флаконе (предпочтительно с капельницей шаровидной формы) в холодильнике при температуре (5±3)°С
5.6.2 Раствор сульфаниловой кислоты
Растворяют 0, 4 г сульфаниловой кислоты в 100 см3 15% (объемная доля) раствора уксусной кислоты. Фильтруют через бумажный фильтр.
Реактив хранят в хорошо закупоренном флаконе (предпочтительно с капельницей шаровидной формы) в холодильнике при температуре (5±3)°С
5.6.3 Приготовление полного реактива
Смешивают равные количества двух растворов 5.6.1 и 5.6.2 непосредственно перед использованием. Неиспользованный реактив уничтожают.
5.7 Цинковая пыль (необязательно)
5.8 Лактозо-желатиновая среда
5.8.1 Состав в соответствии с таблицей 8.
Таблица 8
|
Состав
|
Значение показателя
|
|
Ферментативный гидролизат казеина, г
|
15, 0
|
|
Дрожжевой экстракт, г
|
10, 0
|
|
Галактоза, г
|
10, 0
|
|
Желатин, г
|
120, 0
|
|
Фенол красный, г
|
0, 05
|
|
Вода, см3
|
1000
|
5.8.2 Приготовление среды
Растворяют компоненты в воде (кроме лактозы и фенола красного). Устанавливают уровень рН, чтобы после стерилизации он соответствовал (7, 5±0, 2) при 25°С.
Добавляют лактозу и фенол красный. Среду разливают в пробирки по 10 см3 и стерилизуют в автоклаве 15 мин при 121°С. Если среду не использовали в день приготовления, то ее хранят в холодильнике при температуре (5±3) °С не более трех недель после приготовления.
Непосредственно перед использованием подогревают в кипящей воде или на пару в течение 15 мин и затем быстро охлаждают до температуры разведения.
6 Оборудование и лабораторная посуда
Примечание - При одинаковой спецификации одноразовое оборудование предпочтительнее многоразового.
Обычное лабораторное оборудование, а также следующее:
6.1 Стерилизаторы сухожаровые (печи) или паровые (автоклавы) по ГОСТ ISO 7218.
6.2 Термостат, поддерживающий температуру (37±1) °С.
6.3 Анаэростат, обеспечивающий культивирование анаэробных микроорганизмов.
6.4 рН-метр с разрешением 0, 01 единиц рН и точностью ±0, 1 рН при 25°С.
6.5 Бактериологические петли из платино-иридиевого или никель-хромового сплава, около 3 мм в диаметре, и иглы из тех же материалов для пересева в агаровые косяки.
6.6 Приборы для фильтрования, предназначенные для стерилизации растворов.
6.7 Пробирки с размерами 16 х 160 мм с перевернутыми трубками Дархема, длиной 35 мм и диаметром 7 мм
6.8 Пипетки с полным сливом, номинальным объемом от 1 до 10 см3.
6.9 Чашки Петри, из стекла или пластмассы, диаметром 90 - 100 мм.
6.10 Водяная баня, поддерживающая температуру от 44°С до 47°С и (46±5) °С.
6.11 Резиновые колбы, используемые с градуированными пипетками для разбрызгивания компонентов нитратного реактива обнаружения (при необходимости).
7 Отбор проб
В лабораторию направляют представительную пробу. Проба не должна быть повреждена или изменена в процессе транспортировки или хранения.
Отбор проб не является частью метода, приведенного в настоящем стандарте. Рекомендуется достижение соглашения заинтересованных сторон касательно отбора проб конкретного продукта при отсутствии специального стандарта для данного продукта.
8 Подготовка проб для испытания
Подготовку проб проводят в соответствии со специальным стандартом для данного продукта. Рекомендуется достижение соглашения заинтересованных сторон касательно подготовки проб конкретного продукта при отсутствии специального стандарта на подготовку проб данного продукта.
9 Проведение определения
9.1 Метод приготовления исходной суспензии и последующие разведения
Приготовление пробы и первичного разведения в зависимости от вида продукта согласно соответствующей части ГОСТ 26669.
9.2 Посев и инкубирование (чашечный метод)
С помощью стерильной пипетки (см. 6.8) переносят в двух повторностях 1 см3 исходной суспензии или испытуемой пробы (если продукт жидкий) в центр пустых чашек Петри (см. 6.9).
Наливают в обе чашки от 10 до 15 см3 SC агара (см. 5.2.3), подогретого в водяной бане (см. 6.10) при температуре от 44 до 47°С, и хорошо перемешивают с испытуемой пробой, осторожно вращая чашки. После затвердевания среды добавляют сверху 10 см3 дополнительно SC агара.
Оставляют чашки для затвердевания агара. Застывшие чашки агара с исходной пробой помещают в анаэростат или другие приборы, обеспечивающий культивирование анаэробных микроорганизмов, и инкубируют в анаэробных условиях в течение (20±2) ч при температуре 37°С.
Более продолжительное инкубирование может привести к излишнему почернению среды.
Повторяют процедуру с последующими десятикратными разведениями (см. 9.1).
9.3 Подсчет и выделение колоний
После установленного периода инкубации (см. 9.2) выделяют все чашки Петри, содержащие менее 150 колоний. Из них выделяют чашки с двумя последовательными разведениями. Подсчитывают на каждой чашке характерные колонии, предположительно относящиеся к С. perfringens.
Выделяют из каждой чашки 5 типичных колоний и подтверждают их, используя одну из методик описанных в п. 9.4.2. или п. 9.4.3.
9.4 Биохимическое подтверждение
9.4.1 Общие положения
Для целей подтверждения может быть использован набор сред для биохимических испытаний в соответствии с ГОСТ ISO 7218.
9.4.2 Методика подтверждения с использованием среды LS
Примечание - Реакция, протекающая в лактозо-сульфитной среде (см. 5.4) при 46°С, очень специфична для С. perfringens и С. absonum. Поэтому не обязательно добиваться дополнительной очистки черных колоний, выделенных с агаровой среды, перед их посевом на тиогликолатную и затем на лактозо-сульфитную среду.
9.4.2.1 Пересев и инкубирование
Каждую изолированную колонию (см. 9.3) пересевают на жидкую тиогликолатную среду (см. 5.3). Инкубируют в анаэробных условиях в течение 18-24 ч при температуре 37°С.
9.4.2.2 Обработка результатов
Исследуют пробирку с LS средой, учитывая образование газа и наличие черного окрашивания (осадок сульфита железа). Трубки Дархема, заполненные более чем на одну четвертую часть газом, и пробирки, содержащие черный осадок, оценивают как положительные.
В сомнительных случаях, когда трубка Дархема в пробирке с почерневшей средой заполнена газом менее чем на четверть, без промедления с помощью стерильной пипетки переносят 5 капель культуры с LS средой (см. 9.4.2.1) в другую пробирку с той же средой. Инкубируют на водяной бане (см. 6.10) при температуре от 46°С в течение 18 - 24 ч. Оценивают эти пробирки как описано выше.
Бактерии, которые образуют типичные колонии на LS среде и дают положительную реакцию подтверждения на LS среде, относят к С. perfringens. Во всех прочих случаях пробирки с посевами рассматривают как отрицательные.
9.4.3 Методика подтверждения с использованием подвижной нитратной среды и лактозо-желатиновой среды
9.4.3.1 Общие положения
Для данной методики подтверждения требуются хорошо изолированные типичные колонии. Если их нет (т.е. они чрезмерно разрослись на поверхности чашек, и нет возможности выбрать хорошо изолированные типичные колонии), засевают пять типичных колоний на предварительно деаэрированные жидкие тиогликолатные среды (см. 5.3).
Инкубируют в анаэробных условиях при температуре 37°С в течение 18-24 ч. Штрихуют колонии на чашках с основным агаром SC (см. 5.2.1.2) и добавляют сверху 10 см3 основного агара SC.
Дают застыть агару и инкубируют в анаэробных условиях при температуре 37°С в течение 18 - 24 ч. Потом выбирают из каждой чашки одну типичную и хорошо выделенную колонию.
При необходимости повторяют штрихование и посев на чашки Петри с основным агаром SC до получения хорошо изолированных, типичных колоний.
Подтверждают каждую колонию как описано в 9.4.3.2, 9.4.3.3 и 9.4.3.4.
9.4.3.2 Инокуляция и исследование подвижной нитратной среды
Инокулируют уколом каждую выделенную колонию (см. 9.3) в только что деаэрированную подвижную нитратную среду (см. 5.5).
Инкубируют в анаэробных условиях при 3°С в течение 24 ч. Исследуют пробирку с подвижной нитратной средой на тип культуры по линии укола. Подвижность очевидна по диффузному распределению бактерий в среду от линии укола.
Проводят испытание на присутствие нитрита, добавляя с помощью градуированной пипетки (см. 6.8) и резиновой колбы (см. 6.11) от 0, 2 до 0, 5 см3 нитритного реактива обнаружения (см. 5.6) в каждую пробирку с подвижной нитратной средой.
ПРЕДУПРЕЖДЕНИЕ: В целях безопасности проводят это испытание в вытяжном шкафу.
Образование красного цвета подтверждает восстановление нитрата до нитрита. Если красный цвет не появляется в течение 15 мин, добавляют небольшое количество цинковой пыли (см. 5.7) и дают отстояться в течение 10 мин. Если красный цвет не появился после добавления цинковой пыли, восстановления нитрата не произошло.
9.4.3.3 Инокуляция и исследование лактозо-желатиновой среды
Инокулируют каждую выделенную колонию (см. 9.3) в только что деаэрированную лактозо-желатиновую среду (см. 5.8). Инкубируют в анаэробных условиях при 37°С в течение 24 ч.
Исследуют пробирку с лактозо-желатиновой средой на присутствие газа и желтого цвета (благодаря образованию кислоты), указывающих на ферментацию лактозы. Охлаждают пробирки при 5°С в течение 1 ч и проверяют на сжижение желатина. Если среда застыла, повторно инкубируют в течение еще 24 ч и снова проверяют на сжижение желатина.
9.4.3.4 Интерпретация
Бактерии, которые образуют черные колонии в среде SC, неподвижны, обычно восстанавливают нитрат до нитрита, вырабатывают кислоту и газ из лактозы, и сжижают желатин за 48 ч, относятся к бактериям С. perfringens. Культуры, которые дают слабую реакцию на нитрит (т.е. розового цвета) должны быть ликвидированы, так как бактерии С. perfringens дают сильную и немедленную реакцию.
10 Обработка результатов
10.1 Метод расчета
Обработка результатов по ГОСТ ISO 7218.
10.2 Сходимость
10.2.1 Межлабораторные испытания
Данные о сходимости этого метода, описанные в настоящем международном стандарте, базируются на результатах межлабораторного испытания [2]. Детали этого межлабораторного испытания приведены в приложении А. Предельные значения повторяемости и воспроизводимости определялись на трех видах продуктов, загрязненных на разных уровнях, и на контрольных материалах.
Значения, полученные на основе этого межлабораторного испытания, не могут применяться к пределам концентраций и матрицам, отличным от приведенных здесь.
10.2.2 Повторяемость
Абсолютная разность между двумя отдельными (log10-преобразованными) результатами испытаний (число С. perfringens на г или см3), или соотношение большего к меньшему из двух результатов по нормальной шкале, полученных при использовании одного и того же метода, на идентичном испытуемом материале, одним и тем же оператором, использующим одно и то же оборудование, в течение короткого допустимого промежутка времени, будет превышать предел повторяемости (r) не более чем в 5% случаев.
В качестве общего показателя повторяемости (r) при испытании проб пищевых продуктов могут использоваться следующие значения. Эти значения r являются общими для всех матриц, рассматриваемых в процессе межлабораторного испытания:
r = 0, 21 для подтверждения LS или 0, 25 для подтверждения MN/LG (выраженные как разница между log10-преобразованными результатами испытания); или
r = 1, 67 для подтверждения LS или 1, 8 для подтверждения MN/LG (выраженные как соотношение большего к меньшему из двух результатов испытания).
Для контрольных материалов (см. таблицу А.4) могут применяться следующие значения:
r = 0, 13 для подтверждения LS или 0, 12 для подтверждения MN/LG (выраженные как разница между log10-преобразованными результатами испытания); или
r = 1, 3 для подтверждения LS или 1, 8 для подтверждения MN/LG (выраженные как соотношение большего к меньшему из двух результатов испытания).
Пример
Получен первый результат 10000 или 1, 0×104 предполагаемых бактерий С. perfringens на г продукта. В условиях повторяемости соотношение большего результата к меньшему не должно быть выше 1, 9. следовательно, второй результат будет между 5263 (= 10000/1, 9) и 19000 (10000 х 1, 9) предполагаемых бактерий С. perfringens на г.
10.2.3 Воспроизводимость
Абсолютная разность между двумя отдельными (log10-преобразованными) результатами испытаний (число С. perfringens на г или см3). или абсолютное соотношение между результатами двух испытаний по нормальной шкале, полученными при использовании одного и того же метода, на идентичном испытуемом материале в разных лабораториях, разными операторами, использующими различное оборудование, будут превышать предел воспроизводимости (R) не более чем в 5% случаев.
В качестве показателя предела воспроизводимости (R) при испытании различных видов пищевых продуктов и контрольных материалов могут использоваться значения из таблицы 9. Эти значения r являются средними значениями, полученными в результате межлабораторного испытания для различных уровней*.
Таблица 9 - Примеры значений для R
|
Вид пробы
|
Подтверждение LS
|
Подтверждение MN и LG
|
|
R (log)*
|
R**
|
R (log)*
|
R**
|
|
Сыр
|
0, 26
|
1, 8
|
0, 31
|
2, 1
|
|
Мясо
|
0, 55
|
3, 5
|
0, 52
|
3, 3
|
|
Сухой корм для животных
|
0, 65
|
4, 5
|
0, 72
|
5, 3
|
|
Контрольный материал
|
0, 27
|
1, 9
|
0, 29
|
1, 9
|
|
* R (log) - предел воспроизводимости, выраженный как разность между
log10-трансформированными результатами испытаний.
** R - предел воспроизводимости, выраженный как соотношение между результатами испытаний.
|
Примеры
1 Во-первых, лаборатория нашла результат испытания, равный 10000 или 1, 0×104 C.perfringens на г сыра, В условиях воспроизводимости соотношение большего результата к меньшему не должно быть выше 2, 1. Следовательно, результат второй лаборатории должен быть между 4761 (= 10000/2, 1) и 21000 (10000 х 2, 1) предполагаемых бактерий С. perfringens на г.
2 Во-вторых, лаборатория хочет знать максимальный уровень, который она может найти и который соответствует установленному уровню (например, предел в 100000 или log105). Для этого значение R (0, 31 х 0, 59) является разностью между log10-трансформированными результатами испытаний, а значение 1, 52 (100, 18) представляет соотношение между результатами испытаний. Следовательно, результаты до log105, 18 (log105± log100, 18) или 152000 (100000 х 1, 52) не указывают несоответствие пределу. Коэффициент 0, 59 отражает тот факт, что испытание с односторонним 95% интервалом проводится для того, чтобы узнать, превышен ли предел. Коэффициент 0, 59 получен из следующей формулы
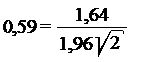
.
11 Протокол испытания
В протоколе испытания указывают:
а) всю информацию, необходимую для полной идентификации пробы:
b) метод отбора пробы, если известен;
c) использованный метод испытания со ссылкой на настоящий стандарт;
d) все детали исследования, не оговариваемые в настоящем стандарте, или рассматриваемые как необязательные, а также детали иного свойства, могущие оказать влияние на результаты исследований;
e) полученные результаты.
_____________________________
* В случае данного межлабораторного испытания значения воспроизводимости, которые должны быть выражены как общее значение, применимое ко всем пробам продуктов, очень сильно отличаются между пробами.
Приложение А
(справочное)
Результаты межлабораторного испытания
Межлабораторное совместное испытание [2], в котором принимали участие 17 лабораторий из 15 стран, проводилось на пробах сыра, мяса, сухого корма для животных и контрольном материале. Каждая проба пищевых продуктов/кормов для животных была испытана на трех различных уровнях загрязнения бактериями Clostridium perfringens.
В соответствии с ГОСТ ISO 16140, в процессе межлабораторного испытания были получены следующие параметры. Испытание было организовано Голландским национальными институтом общественного здоровья (RIVM) в январе 2000 г. и дало данные по сходимости, приведенные в таблицах А.1 - А.4.
Таблица А.1 - Результаты анализа данных, полученных на пробах сыра
|
Проба
|
Сыр (низкий уровень)
|
Сыр (средний уровень)
|
Сыр (высокий уровень)
|
|
Число лабораторий с правильными результатами
|
13
|
13
|
13
|
|
Число проб
|
2
|
2
|
2
|
|
Число лабораторий, оставшихся после исключения выбросов
|
13
|
13
|
13
|
|
Число выбросов
|
0
|
0
|
0
|
|
Число принятых проб
|
26
|
26
|
26
|
|
Среднее значение 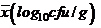
|
2, 5/2, 5*
|
3, 5/3, 5*
|
4, 5/4, 5*
|
|
Среднеквадратическое отклонение повторяемости SR(log10cfu/g)
|
0, 11/0, 11*
|
0, 06/0, 07*
|
0, 08/0, 10*
|
|
Среднее относительное отклонение повторяемости
|
4, 37/4, 59*
|
1, 63/1, 97*
|
1, 85/2, 31*
|
|
Предел повторяемости r
| | | |
|
- как разность по шкале log10(log10cfu/g)
|
0, 30/0, 32*
|
0, 16/0, 19*
|
0, 23/0, 29*
|
|
- как соотношение по нормальной шкале
|
2, 0/2, 1*
|
1, 5/1, 6*
|
1, 7/1, 9*
|
|
Среднеквадратическое отклонение воспроизводимости SR(log10cfu/g)
|
0, 13/0, 13*
|
0, 08/0, 15*
|
0, 11/0, 14*
|
|
Среднее относительное отклонение воспроизводимости (%)
|
5, 21/5, 11*
|
2, 32/4, 38*
|
2, 50/3, 11*
|
|
Предел воспроизводимости R
| | | |
|
как разность по шкале log10(log10cfu/g)
|
0, 36/0, 35*
|
0, 23/0, 43*
|
0, 31/0, 39*
|
|
как соотношение по нормальной шкале
|
2, 3/2, 2*
|
1, 7/2, 7*
|
2, 1/2, 4*
|
|
* Первый результат был получен с использованием лактозо-желатиновой среды, а второй - с использованием подвижной нитратной и лактозо-желатиновой среды.
|
Таблица А.2 - Результаты анализа данных, полученных на пробах мясного фарша
|
Проба
|
Мясной фарш (низкий уровень)
|
Мясной фарш (средний уровень)
|
Мясной фарш (высокий уровень)
|
|
Число лабораторий с правильными результатами
|
13
|
13
|
13
|
|
Число проб
|
2
|
2
|
2
|
|
Число лабораторий, оставшихся после исключения выбросов
|
13
|
13
|
13
|
|
Число выбросов
|
0
|
0
|
0
|
|
Число принятых проб
|
26
|
26
|
26
|
|
Среднее значение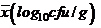
|
2, 7/2, 7*
|
3, 6/3, 6*
|
4, 5/4, 5*
|
|
Среднеквадратическое отклонение повторяемости SR(log10cfu/g)
|
0, 06/0, 11*
|
0, 06/0, 10*
|
0, 11/0, 09*
|
|
Среднее относительное отклонение повторяемости (%)
|
2, 32/4, 22*
|
1, 67/2, 70*
|
2, 33/2, 01*
|
|
Предел повторяемости r
| | | |
|
- как разность по шкале log10(log10cfu/g)
|
0, 18/0, 32*
|
0, 17/0, 27*
|
0, 29/0, 25*
|
|
- как соотношение по нормальной шкале
|
1, 5/2, 1*
|
1, 5/1, 9*
|
2, 0/1, 8*
|
|
Среднеквадратическое отклонение воспроизводимости SR(log10cfu/g)
|
0, 14/0, 18*
|
0, 18/0, 18*
|
0, 18/0, 22*
|
|
Среднее относительное отклонение воспроизводимости (%)
|
5, 01/6, 54*
|
5, 07/5, 05*
|
3, 90/4, 76*
|
|
Предел воспроизводимости R
| | | |
|
- как разность по шкале log10(log10cfu/g)
|
0, 38/0, 49*
|
0, 51/0, 50*
|
0, 49/0, 60*
|
|
- как соотношение по нормальной шкале
|
2, 4/3, 1*
|
3, 2/3, 2*
|
3, 1/4, 0*
|
|
* Первый результат был получен с использованием лактозо-сульфитной среды, а второй - с использованием подвижной нитратной и лактозо-желатиновой среды.
|
Таблица А.3 - Результаты анализа данных, полученных на пробах сухого корма для животных
|
Проба
|
Сухой корм (низкий уровень)
|
Сухой корм (средний уровень)
|
Сухой корм (высокий уровень)
|
|
Число лабораторий с правильными результатами
|
13
|
13
|
13
|
|
Число проб
|
2
|
2
|
2
|
|
Число лабораторий, оставшихся после исключения выбросов
|
13
|
13
|
13
|
|
Число выбросов
|
0
|
0
|
0
|
|
Число принятых проб
|
25
|
25
|
25
|
|
Среднее значение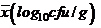
|
2, 6/2, 6*
|
3, 8/3, 9*
|
4, 8/4, 9*
|
|
Среднеквадратическое отклонение повторяемости SR(log10cfu/g)
|
0, 07/0, 10*
|
0, 08/0, 8*
|
0, 06/0, 04*
|
|
Среднее относительное отклонение повторяемости (%)
|
2, 85/3, 79*
|
2, 09/1, 93*
|
1, 22/0, 75*
|
|
Предел повторяемости r
| | | |
|
- как разность по шкале log10(log10cfu/g)
|
0, 21/0, 28*
|
0, 22/0, 21*
|
0, 16/0, 10*
|
|
- как соотношение по нормальной шкале
|
1, 6/1, 9*
|
1, 7/1, 6*
|
1, 5/1, 3*
|
|
Среднеквадратическое отклонение воспроизводимости SR(log10cfu/g)
|
0, 32/0, 32*
|
0, 25/0, 24*
|
0, 17/0, 17*
|
|
Среднее относительное отклонение воспроизводимости (%)
|
12, 21/12, 03*
|
6, 53/6, 18*
|
3, 50/3, 49*
|
|
Предел воспроизводимости R
| | | |
|
- как разность по шкале log10(log10cfu/g)
|
0, 88/0, 88*
|
0, 69/0, 67*
|
0, 47/0, 47*
|
|
- как соотношение по нормальной шкале
|
7, 6/7, 6*
|
4, 9/4, 7*
|
3, 03/3, 0*
|
|
* Первый результат был получен с использованием лактозо-сульфитной среды, а второй - с использованием подвижной нитратной и лактозо-желатиновой среды.
|
Таблица А.4 - Результаты анализа данных, полученных на контрольном материале
|
Проба
|
Контрольный материал
|
|
Число лабораторий с правильными результатами
|
13
|
|
Число проб
|
2
|
|
Число лабораторий, оставшихся после исключения выбросов
|
13
|
|
Число выбросов
|
0
|
|
Число принятых проб
|
26
|
|
Среднее значение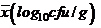
|
3, 7/3, 7*
|
|
Среднеквадратическое отклонение повторяемости SR(log10cfu/capsule)
| |
|
Среднее относительное отклонение повторяемости (%)
|
0, 05/0, 5*
1, 24/1, 21*
|
|
Предел повторяемости r
| |
|
- как разность по шкале log10(log10cfu/capsule)
|
0, 13/0, 12*
|
|
- как соотношение по нормальной шкале
|
1, 3/1, 3*
|
|
Среднеквадратическое отклонение воспроизводимости SR(log10cfu/capsule)
|
0, 09/0, 09*
|
|
Среднее относительное отклонение воспроизводимости (%)
|
2, 51/2, 39*
|
|
Предел воспроизводимости R
| |
|
- как разность по шкале log10(log10cfu/capsule)
|
0, 26/0, 25*
|
|
- как соотношение по нормальной шкале
|
1, 8/1, 6*
|
|
* Первый результат был получен с использованием лактозо-сульфитной среды, а второй - с использованием подвижной нитратной и лактозо-желатиновой среды.
|
Библиография
|
[1]
|
ISO 6887-2:2003
|
Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 2: Specific rales for the preparation of meat and meat products (Микробиология пищевых продуктов и кормов для животных. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологических исследований. Часть 2. Специальные правила подготовки мяса и мясных продуктов)
|
|
[2]
|
Schulten S.M., Benschop E., Nagelkerke N.J.D. и Mooijman K.A. Validation of microbiological methods: Enumeration of Clostridium perfringens according to ISO 7937 (второе издание, 1997). Отчет 286555002, Национальный институт общественного здоровья и окружающей среды, Bilthoven, Нидерланды, 2001
|
| | | |
![]() — Все документы — ГОСТы — ГОСТ 31744-2012 (ISO 7937:2004) МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ. МЕТОД ПОДСЧЕТА КОЛОНИЙ Clostridium perfringens
— Все документы — ГОСТы — ГОСТ 31744-2012 (ISO 7937:2004) МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ. МЕТОД ПОДСЧЕТА КОЛОНИЙ Clostridium perfringens Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
 Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
 Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
 Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
 Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии
Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии
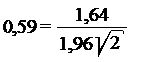 .
.