Межгосударственный стандарт ГОСТ ISO 11133-2-2011
"МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ. РУКОВОДЯЩИЕ УКАЗАНИЯ ПО ПРИГОТОВЛЕНИЮ И ПРОИЗВОДСТВУ ПИТАТЕЛЬНЫХ СРЕД. Часть 2. ПРАКТИЧЕСКИЕ РУКОВОДЯЩИЕ УКАЗАНИЯ ПО ЭКСПЛУАТАЦИОННЫМ ИСПЫТАНИЯМ ПИТАТЕЛЬНЫХ СРЕД"
(введен в действие приказом Федерального агентства по техническому регулированию и метрологии от 13 декабря 2011 г. N 1476-ст)
С изменениями:
(9 июля 2014 г.)
Microbiology of food and animal feeding stuffs. Guidelines on preparation and production of culture media. Part 2. Practical guidelines on performance testing of culture media
Дата введения - 1 января 2013 г.
Введен впервые
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Порядок разработки, принятия, применения, обновления и отмены"
Введение
Важно, чтобы для проведения микробиологического анализа пищевых продуктов с большой степенью надежности использовались питательные среды проверенного качества. Для всех сред, описанных в стандартизованных методах, является важным установить минимальные критерии приемлемости, требуемые для обеспечения надежности сред. Рекомендуется, чтобы при определении эксплуатационных характеристик питательной среды проводились испытания, которые соответствуют настоящим техническим условиям. Это применяется:
1) к приготовленным на коммерческой основе обезвоженным средам, готовым к употреблению;
2) питательным средам, приготовленным из основных компонентов в лаборатории пользователя.
Установление широко принятых минимальных критериев эксплуатации для сред должно привести к более однородному качеству продукции на коммерческой основе и тем самым сократить спектр испытаний, которые необходимо проводить в лаборатории пользователя.
Кроме того, минимальные критерии приемлемости, измеряемые методами, установленными в настоящем стандарте, могут использоваться всеми микробиологическими лабораториями для оценки свойств производительности, селективности и/или избирательности питательной среды.
В микробиологическом анализе пищевых продуктов и кормов для животных требования настоящего стандарта являются приоритетными при оценке качества сред.
1 Область применения
Настоящий стандарт устанавливает критерии и методы эксплуатационных испытаний питательных сред. Настоящий стандарт применяется:
- к коммерческим структурам, производящим и/или распространяющим готовые к употреблению или полуфабрикатные, восстановленные или обезвоженные среды для микробиологических лабораторий;
- некоммерческим структурам, поставляющим среды третьей стороне;
- микробиологическим лабораториям, осуществляющим приготовление питательных сред для собственного использования и оценивание эксплуатационных характеристик этих сред.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные документы. Для датированных ссылок применяют только указанное издание ссылочного документа, для недатированных ссылок применяют последнее издание ссылочного документа (включая все его изменения).
ISO/TS 11133-1:2000 Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 1: General guidelines on quality assurance forthe preparation of culture media in the laboratory (Микробиологияпищевыхпродуктовикормовдляживотных. Руководящие указания по приготовлению и производству питательных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления питательных сред в лаборатории)
ISO 4831 Microbiology of food and animal feeding stuffs - Horizontal method for the detection and enumeration of coliforms - Most probable number technique (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод обнаружения и подсчета колиформных бактерий. Методика наиболее вероятного числа)
ISO 4832 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coliforms - Colony-count technique (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальныйметодподсчетаколиформ. Методподсчетаколоний)
ISO 4833 Microbiology of food and animal feeding stuffs. Horizontal method for the enumeration of microorganisms. Colony-count technique at 30°C (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод подсчета микроорганизмов. Метод подсчета колоний при температуре 30°С)
ISO 6579 Microbiology of food and animal feeding stuffs - Horizontal method forthe detection of Salmonella spp. (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения сальмонеллы Salmonella spp.)
ISO 6887-1 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 1: General rules for the preparation of the initial suspension and decimal dilutions (Микробиологияпищевыхпродуктовикормовдляживотных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общиеправилаприготовленияисходнойсуспензииидесятичныхразведений)
ISO 6887-2 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 2: Specific rules for the preparation of meat and meat products (Микробиологияпищевыхпродуктовикормовдляживотных. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологических исследований. Часть 2. Специальныеправилаподготовкимясаимясныхпродуктов)
ISO 6887-3 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 3: Specific rules for the preparation of fish and fishery products (Микробиологияпищевыхпродуктовикормовдляживотных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 3. Специальныеправиладляприготовлениярыбыирыбныхпродуктов)
ISO 6887-4 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 4: Specific rules for the preparation of products other than milk and milk products, meat and meat products, and fish and fishery products (Микробиологияпищевыхпродуктовикормовдляживотных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 4. Специальные правила для приготовления продуктов, кроме молока и молочных продуктов, мяса и мясных продуктов, рыбы и рыбопродуктов)
ISO 6887-5 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 5: Specific rules for the preparation of milk and milk products (Микробиологияпищевыхпродуктовикормовдляживотных. Подготовка проб для анализа, исходной суспензии и десятичных разведений для микробиологического исследования. Часть 5. Специальные правила подготовки молока и молочных продуктов)
ISO 6888-1 Microbiology of food and animal feeding stuffs. Horizontal method for the enumeration of coagulasepositive staphylococci (Staphylococcus aureus and other species). Part 1. Technique using Baird-Parker agar medium (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод подсчета коагулазоположительных стафилококков (Staphylococcus aureus и другие виды). Часть 1. Метод с применением агаровой среды Бейда-Паркера)
ISO 6888-2 Microbiology of food and animal feeding stuffs. Horizontal method for the enumeration of coagulasepositive staphylococci (Staphylococcus aureus and other species). Part 2. Technique using rabbit plasma fibrinogen agar medium (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод подсчета коагулазоположительных стафилококков (Staphylococcus aureus и другие виды). Часть 2. Метод с применением агаровой среды с бычьим фибриногеном в плазме кролика)
ISO 6888-3 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) - Part 3: Detection and MPN technique for low numbers (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод подсчета коагулазоположительных стафилококков (Staphylococcus aureus и другие виды). Часть 3. Обнаружениеиметод MPN длянизкихколичеств)
ISO 7251 Microbiology of food and animal feeding stuffs - Horizontal method for the detection and enumeration of presumptive Escherichia coli - Most probable number technique (Микробиологияпищевыхпродуктовикормов. Горизонтальный метод обнаружения и определения количества презумптивных бактерий Escherichia coli. Методнаиболеевероятногочисла)
ISO 7932 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of presumptive Bacillus cereus - Colony-count ount technique at 30°C (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод подсчета презумптивных бактерий Bacillus cereus. Методика подсчета колоний при температуре 30°С)
ISO 7937 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of Clostridium perfringens - Colony-count technigue (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальныйметодподсчета Clostridium perfringens. Методподсчетаколоний)
ISO 10272-1 Microbiology of food and animal feeding stuffs - Horizontal method for detection and enumeration of Campylobacter spp. - Part 1: Detection method (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод обнаружения и подсчета бактерий Campylobacter spp. Часть 1. Метод обнаружения)
ISO/TS 10272-2 Microbiology of food and animal feeding stuffs - Horizontal method for detection and enumeration of Campylobacter spp. - Part 2: Colony-count technique (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод обнаружения и подсчета бактерий Campylobacter spp. Часть 2. Метод подсчета колоний)
ISO/TS 10272-3 Microbiology of food and animal feeding stuffs - Horizontal method for detection and enumeration of Campylobacter spp. - Part 3: Semi-quantitative method (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод обнаружения и подсчета бактерий Campylobacter spp. Часть 3. Полуколичественный метод)
ISO 10273 Microbiology of food and animal feeding stuffs - Horizontal method for the detection of presumptive pathogenic Yersinia enterocolitica (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальныйметодвыявленияусловно-патогенных Yersinia enterocolitica)
ISO 11290-1 Microbiology of food and animal feeding stuffsmethod for detection and enumeration of Listeria monocytogenes - Part 1: Detection method (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод обнаружения и подсчета микроорганизмов Listeria monocytogenes. Часть 1. Метод обнаружения)
ISO 11290-2 Microbiology of food and animal feeding stuffs - Horizontal method for the detection and enumeration of Listeria monocytogenes - Part 2: Enumeration method (Микробиологияпродуктовпитанияиживотныхкормов. Горизонтальный метод обнаружения и подсчета микроорганизмов Listeria monocytogenes. Часть 2. Метод подсчета)
ISO 15213 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of sulfite-reducing bacteria growing under anaerobic conditions (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальныйметодподсчетасульфитвосстанавливающихбактерий, растущихванаэробныхусловиях)
ISO 15214 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of mesophilic lactic acid bacteria - Colony-count technique at 30°C (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальный метод подсчета мезофильных молочнокислых бактерий. Метод подсчета колоний при температуре 30°С)
ISO 16649 (всечасти) Microbiology of food and animal feeding stuffs. Horisontal method for the enumeration of beta-glucuronidase-positive Escherichia coli (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальныйметодподсчетабета-глюкуронидаза-положительныхбактерий Escherichia coli)
ISO 16654 Microbiology of food and animal feeding stuffs. Horizontal method for the detection of Escherichia coli O157 (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальныйметодобнаруженияпалочки Escherichia coli O157)
ISO 21528-1 Microbiology of food and animal feeding stuffs - Horizontal methods for the detection and enumeration of Enterobacteriaceae - Part 1: Detection and enumeration by MPN technique with pre-enrichment (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальные методы обнаружения и подсчета бактерий Enterobacteriaceae. Часть 1. Обнаружение и подсчет методом MPN с предварительным обогащением)
ISO 21528-2 Microbiology of food and animal feeding stuffs - Horizontal methods for the detection and enumeration of Enterobacteriaceae - Part 2: Colony-count method (Микробиологияпищевыхпродуктовикормовдляживотных. Горизонтальные методы обнаружения и подсчета бактерий Enterobacteriaceae. Часть 2. Метод подсчета колоний)
3 Термины и определения
В настоящем стандарте применены термины по ISO 11133-1.
4 Критерии обычного контроля качества
4.1 Общие критерии качества
4.1.1 Качество питательных сред
Качество питательных сред зависит от качества основных компонентов, правильности состава, качества процедур приготовления, устранения загрязняющих микробных агентов и надлежащих условий упаковки и хранения (см. ISO 11133-1).
Производитель или оператор в лаборатории должен действовать в соответствии с физико-химическими характеристиками питательных сред, как это установлено в соответствующем стандарте. Кроме того, оценивание качества должно гарантировать, что питательная среда соответствует установленным рекомендациям, включая следующие характеристики:
- нанесенное количество и/или толщину;
- внешний вид, цвет и гомогенность;
- консистенция геля;
- содержание воды;
- значение рН;
- буферную емкость;
- микробное загрязнение.
Индивидуальные компоненты и любые питательные или селективные добавки также должны проходить надлежащие процедуры оценки качества.
4.1.2 Качество основных компонентов сред
Питательные среды, которые описываются в стандартах, рассматриваются как удовлетворительные; вместе с тем, из-за непостоянства их качества для производителей сред может быть приемлемым изменение концентрации некоторых основных биологических компонентов, приведенных ниже:
- пептонов и мясных или дрожжевых экстрактов, питательные свойства которых непостоянны;
- агара, гелеобразующие свойства которого непостоянны;
- буферных веществ;
- солей желчных кислот, желчного экстракта и дезоксихолата, антибактериальных красителей в зависимости от их селективных свойств;
- антибиотиков в зависимости от их активности.
4.2 Микробиологические критерии качества
4.2.1 Общие положения
Испытания микробиологических эксплуатационных характеристик следует проводить с использованием пробы, которая является представительной для партии конечного продукта.
4.2.2 Микробное загрязнение
Надлежащее количество в зависимости от размера партии питательной среды должно быть испытано на микробное загрязнение путем инкубации в соответствующих условиях. Предельные значения количества загрязненных чашек или емкостей жидкой среды следует установить для каждой среды, или они должны быть установлены производителем. Производители должны составить технические условия, основываясь на компонентах сред, технологических ограничениях и типе упаковки.
Примечания
1 Пробы, которые подвергаются испытаниям, должны представлять собой по меньшей мере одну чашку или пробирку либо 1% чашек или пробирок от начала и одну чашку или пробирку, либо 1% чашек или пробирок от конца процесса разливки или распределения. Чашки или пробирки следует инкубировать по меньшей мере в течение 18 ч при 37°С или в условиях инкубации, которые обычно применяются для данной среды в соответствии с конкретным стандартом.
2 Для плана статистической выборки см. ISO 2859-1.
4.2.3 Рост
4.2.3.1 Общие положения
Для оценки каждой партии питательной среды в целом, питательных компонентов или добавок необходимо оценить рост с помощью одного из методов:
1) количественного или
2) полуколичественного, или
3) качественного.
Количественное, полуколичественное или качественное определение проводят методами, описанными в настоящем стандарте, или другими общепринятыми методами. Для интерпретации результатов испытаний необходимо проводить сравнение величины роста в испытуемой среде с этой величиной для эталонной среды. Использование конкретной эталонной среды является обязательным для количественно го метода (см. соответствующий стандарт или приложение В).
В случае полуколичественного или качественного метода использование конкретной эталонной среды (см. соответствующий стандарт или приложение В) или питательной среды, дающей "положительную" реакцию, помогает интерпретировать результаты. Эталонная среда должна быть проверенного качества, отобранная из недавно выпущенных партий или партии другого поставщика, или готовая к употреблению среда и т.п.
Помимо этого, рост целевых штаммов должен быть типичным в плане внешнего вида, размера и морфологии колоний и рост нецелевых штаммов должен быть частично или полностью ингибирован.
4.2.3.2 Продуктивность
Твердые, полутвердые или жидкие питательные среды должны быть инокулированы с использованием соответствующего инокулята (см. 5.2.1.1) рабочей культуры каждого определенного тест-микроорганизма при помощи надлежащего устройства.
Производительность должна достичь установленного минимального предела (см. соответствующий стандарт или приложение В).
Для количественного метода коэффициент производительности PR вычисляют по формуле
PR=NS/NO,
(1)
где NS - общее количество колоний, полученных на данной питательной среде при испытании (полученных на одной или более чашках);
NO - общее количество колоний, полученных на определенной эталонной питательной среде на одной или более чашках; оно должно быть ≥100 КОЕ (колониеобразующих единиц).
Примечание - Коэффициент производительности неселективной среды составляет по меньшей мере 0,7 для микроорганизмов, которые могут легко расти на этой среде. PR целевых микроорганизмов на селективной среде должен быть не менее 0,1. Обычно достигаются эти значения, вместе с тем для определенных комбинаций сред и тест-микроорганизмов могут быть приняты менее жесткие критерии (см. соответствующий стандарт или приложение В).
В случае полуколичественных методов результаты подсчета в последовательных секторах чашки с инокуляцией экометрическим методом суммируются для получения показателя роста GІ, который варьируется в зависимости от питательной среды. Таким образом, является существенным их сравнение с предыдущими показателями и/или с GІ, эталонной среды и необходимо убедиться, что имеющиеся вариации не превышают норму. Ожидаемый диапазон вариаций для каждой питательной среды также может быть установлен, как только будет наработан достаточный опыт в использовании метода.
Качественные определения проводят визуально путем локализации баллов, характеризующих рост.
4.2.3.3 Селективность
Для количественной оценки селективности селективные питательные среды и эталонную среду инокулируют с использованием надлежащего инокулята (см. 4.2.1.2) определенного тест-микроорганизма при помощи надлежащего устройства. Селективность должна достичь определенных значений (см. соответствующий конкретный стандарт или приложение В).
Фактор селективности SF вычисляют по формуле
SF=DO-DS,
(2)
где DO - наибольшее разбавление, при котором отмечается рост по меньшей мере 10 колоний на эталонной среде;
DS - наибольшее разбавление, демонстрирующее сопоставимый рост на испытуемой среде.
SF, DO и DS выражены в единицах log10.
Примечание - SF нецелевых микроорганизмов на селективной среде должен быть не менее двух. Это значение, как правило, достигается. Вместе с тем, для определенных комбинаций сред и тест-микроорганизмов могут быть приняты менее жесткие критерии (см. соответствующий стандарт или приложение В).
Для полуколичественных и качественных методов рост неселективного штамма (ов) должен быть частично или полностью ингибирован.
4.2.4 Биохимические и физиологические характеристики (селективность и специфичность)
Чтобы получить полную картину характеристик сред, необходимо определить морфологию колоний и диагностические особенности, а также степень селективности.
Должны быть определены и достигнуты существенные характеристики специфичности. Для дифференциальных сред должны быть определены качественно биохимические/физиологические характеристики целевых микроорганизмов и степень ингибирования нецелевых микроорганизмов следует определить с использованием надлежащего набора испытательных штаммов.
4.2.5 Характеристики антимикробных испытаний
Антимикробное действие антибиотиков зависит от характеристик их диффузии в агаре и любых антагонистических влияний присутствующих компонентов. Среды для испытаний присутствия или отсутствия антимикробных веществ в пробах пищевых продуктов должны соответствовать эталонным методам.
4.3 Оценка характеристик и интерпретация результатов
Партия питательной среды демонстрирует удовлетворительные эксплуатационные характеристики, если все используемые тест-микроорганизмы ведут себя в соответствии с признаками, приведенными в настоящем стандарте. Партия должна быть принята в случае, если соблюдаются общие и микробиологические критерии качества.
5 Методы проверки характеристик питательных сред
5.1 Общие положения
Описаны примеры количественного, полуколичественного и качественного методов испытаний для твердых питательных и жидких сред. В большинстве случаев полуколичественный и качественный методы, используемые в лаборатории пользователя, должны соответствовать требованиям проверки характеристик партии питательной среды.
В особых случаях, например при оценивании новой среды или нового производителя и т.п., количественные методы испытаний следует применять в лаборатории пользователя.
Предполагается, что общепринятые микробиологические методы известны и, следовательно, их полное изложение не приводится.
Релевантные тест-микроорганизмы приведены в приложении В (см. также ISO 11133-1).
Примечание - В новые и пересматриваемые стандарты по определению или подсчету конкретных микроорганизмов или групп микроорганизмов следует включать описание релевантных тест-микроорганизмов, которые будут использоваться вместе с критериями приемлемости для каждой культуры в стандарте.
Для жидких сред взаимодействия, приводящие к успешному росту микроорганизмов, более сложные; таким образом, устанавливаемые методы эксплуатационных испытаний менее эффективны, чем для твердых сред.
Для успешной изоляции целевых микроорганизмов в многостадийном методе, например, определении Salmonella, на каждой стадии роста имеют место несколько сложных взаимодействий. В данном случае следует провести контрольное испытание с использованием надлежащих проб, культуры и эталонных веществ, чтобы продемонстрировать продуктивность или соответственно селективность всего метода. Кроме того, можно продемонстрировать, что каждый компонент среды соответствует целям.
5.2 Тест-микроорганизмы
Релевантные эталонные штаммы целевых (продуктивность) и нецелевых (селективность) микроорганизмов для каждой питательной среды приведены в приложении В. Тест-микроорганизмы должны соответствовать требованиям, изложенным в ISO 11133-1 (пункт 5.2.2), например, речь идет о жизнестойких, медленно растущих, биохимически неактивных или поврежденных штаммах, когда это целесообразно.
Методические указания по консервированию и сохранению эталонных штаммов приводятся в приложении В.
5.2.1 Приготовление рабочей культуры
Рабочие культуры следует готовить в виде чистой культуры в стационарной фазе роста в неселективном бульоне из эталонных исходных культур.
Могут использоваться различные методы, но они должны гарантировать чистоту инокулята, а также его стандартность, которая позволит использовать его в последующей стадии.
Примечание - Замороженные инокуляты можно использовать, если будет показано, что данный микроорганизм способен выживать в течение выбранного периода.
5.2.1.1 Рабочая культура для испытаний на продуктивность
Для количественных испытаний чашечной среды для требуемых микроорганизмов используется инокулят, содержащий приблизительно 102 КОЕ.
Для полуколичественных или качественных испытаний чашечной среды необходим инокулят, содержащий 103 – 104 КОЕ.
Для испытаний на продуктивность жидких сред используется инокулят, содержащий 10 - 100 КОЕ.
5.2.1.2 Рабочая культура для испытаний на селективность
Для испытаний питательных сред на селективность в чашку или в пробирку со средой инокулируют суспензию нецелевых микроорганизмов, содержащую от 104 до 106 КОЕ.
5.2.1.3 Условия инкубации
Инокулированные питательные среды инкубируют с соблюдением условий, описанных в соответствующем стандарте и приведенных в соответствующих таблицах приложения В.
5.3 Методы, применяемые в отношении твердых питательных сред
5.3.1 Количественный метод
5.3.1.1 Общие положения
Это обычный метод, пригодный для большинства плотных питательных сред. Он может быть непригодным для испытаний некоторых видов плесневых грибов.
5.3.1.2 Процедура
Используют рабочие культуры в соответствии с 5.2.1.
Отбирают соответствующее число чашек, которое является представительными для каждой партии, подлежащей испытаниям, и обеспечивают правильное высушивание поверхности каждой чашки. Чашки с эталонной средой готовят аналогичным образом.
По поверхности испытуемых и эталонных чашек распределяют инокулят разбавленной рабочей культуры с целью внесения количества, которое входит в рекомендуемые пределы, приведенные в 5.2.1.
Примечания - Может также использоваться чашечный метод для питательных сред, обычно применяемых для подсчета таким образом.
Чашки инкубируют в соответствующих условиях, как это установлено в соответствующих стандартах.
Проводят подсчет колоний, присутствующих в каждой чашке или в каждой капле, по обстоятельствам. Оценивают размер и внешний вид колоний.
5.3.1.3 Расчеты
Исходя из объема, распределенного на чашках, и фактора разбавления можно рассчитать среднее количество микроорганизмов в среде. В случае использования капельных методов необходимо принимать во внимание количество капель и их объем.
5.3.1.4 Интерпретация результатов
Для интерпретации результатов следует рассчитать коэффициент производительности PR (см. 5.2.3.2) или фактор селективности SF (см. 5.2.3.3).
5.3.2 Полуколичественный метод посева штрихом, основанный на экометрии
5.3.2.1 Общие положения
Метод посева штрихом пригоден для определения рабочих характеристик плотных и жидких питательных сред, данный метод является только полуколичественным. Таким образом, показатели роста являются лишь ориентировочными, и он может рассматриваться только как дополнительное испытание твердых питательных сред.
При использовании данного метода испытуемые питательные среды необходимо высушить до одной и той же степени, и вся процедура должна быть стандартизирована, чтобы можно было сравнивать результаты, полученные для различных партий.
5.3.2.2 Процедура
Чашки с агаром готовят обычным способом, используя около 15 см3 агара. Среды, обычно используемые в чашечном методе, например, агар для чашечного подсчета, могут также подвергаться испытаниям поверхностным культивированием на затвердевших средах.
Используют рабочие культуры, как это описано в 5.2.1.
В чашки делают посев штрихом, как это показано на рисунке 1, используя петлю на 1 мкл. Проводят четыре параллельные линии петлей с интервалом приблизительно 0,5 см в секторе А. Штриховую разводку повторяют для секторов В и С и завершают в секторе D одной линией. Для помощи в выполнении точного посева штрихом под чашкой можно использовать шаблон.
Соблюдают время и температуру инкубации, установленные в стандартных методах.
Примечание - В культуру необходимо погружать только петлю, но не проволоку. Петля должна быть полностью заполнена культурой. Избыточную жидкость удаляют трехкратным нажатием на расширенную часть петли, используя край емкости. При посеве штрихом угол между петлей и поверхностью агара должен быть от 20° до 30°. Давление петли на поверхность агара и скорость посева штрихом должны быть всегда соразмерны. Следует избегать погружения петли в культуру, если на поверхности бульона имеются пена и/или пузыри.
Обычно для посева штрихом всех секторов от А до D используют одну и ту же петлю без обработки в пламени между операциями посева штрихом. В некоторых случаях, когда более низкий показатель роста GІ, как ожидается, должен продемонстрировать четко выраженные различия, может быть уместной замена или стерилизация петли между операциями посева штрихом в секторах А и В.
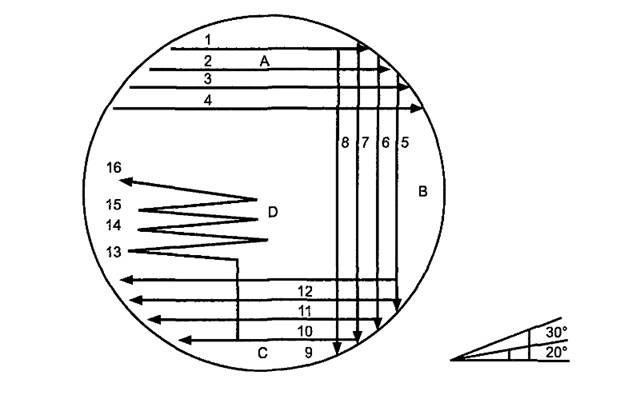
"Рисунок 1 - Образец проведения инокуляции при помощи модифицированного метода посева штрихом и угол наклона петли"
5.3.2.3 Расчеты
После инкубации оценивают внешний вид, размер колоний и интенсивность роста и вычисляют показатель роста GІ,. Каждой линии посева, которая показывает рост, приписывают 1 балл. Максимальное количество баллов для чашки равно 16. Линии приписывают 0,5 баллов, если рост наблюдается только на половине ее длины. Линия, на которой роста нет или имеется ограниченный рост (менее половины длины), оценивается в 0 баллов. Баллы суммируют с целью получения GІ. Например, если рост наблюдается в секторах А и В и в половине сектора С, GІ будет равен 10.
5.3.2.4 Интерпретация результатов
Показатель роста GІ, характеризующий целевой штамм, должен быть по меньшей мере равен 6, чтобы сделать выводы о приемлемости среды. В случае неселективных сред GІ обычно выше.
Кроме того, рост целевого штамма должен быть типичным, а рост нецелевых штаммов должен быть частично или полностью ингибирован.
5.3.3 Качественный метод посева штрихом
5.3.3.1 Общие положения
Данный метод пригоден для дополнительных эксплуатационных испытаний твердых питательных сред.
Данный метод является только качественным, и, таким образом, оценка дается только приблизительная.
5.3.3.2 Процедура
Чашки с агаром готовят обычным способом, используя около 15 см3 агара. Среды, обычно используемые в чашечном методе, например агар для чашечного подсчета, могут также подвергаться испытаниям поверхностным культивированием на затвердевших средах.
Используют рабочие культуры, как это описано в 5.2.1.
Тест-микроорганизмы наносят прямыми параллельными линиями, используя петлю на 1 мкл, на поверхность испытуемой среды. В одной и той же чашке можно осуществлять посев штрихом нескольких тест-микроорганизмов, не смешивая их.
Примечание - Возможно применение других стандартизированных методов посева штрихом.
5.3.3.3 Интерпретация результатов
Рост, наблюдаемый в чашках после инкубации, оценивается следующим образом:
- 0 соответствует нулевому росту,
- 1 соответствует слабому росту и
- 2 соответствует значительному росту.
Целевые микроорганизмы должны оцениваться в 2 балла и иметь типичный внешний вид, размер и морфологию колоний. Рост нецелевых микроорганизмов должен быть частично или полностью ингибирован (0 или 1).
5.4 Методы, применяемые в отношении жидких питательных сред
5.4.1 Общие положения
Для определения производительности жидкой среды необходимо использовать подходящий инокулят. Количественный, полуколичественный и качественный методы, описанные ниже, позволяют оценить производительность и селективность. Предлагаемые методы регистрируют степень роста после надлежа щей инкубации путем культивирования или штрихового посева из жидких сред на агаровые среды и под счета колониеобразующих единиц (КОЕ) или вычисления баллов для жидкой среды. В случае качественных методов для жидких сред характеристические реакции оценивают визуально.
5.4.2 Количественный метод разбавления для целевых и нецелевых микроорганизмов
Данный метод также пригоден для оценивания новых питательных сред или разбавителей.
5.4.2.1 Процедура
Отбирают нужное число пробирок или порций по 10 см3 каждой партии испытуемой жидкой среды.
Инокуляция целевых микроорганизмов: инокулируют испытуемый бульон и эталонный бульон, используя каждый тест-микроорганизм с малым содержанием (например, от 10 до 100 КОЕ в каждой пробирке; о приготовлении инокулята см. 5.2.1), и перемешивают.
Инокуляция нецелевых микроорганизмов: инокулируют испытуемый бульон и эталонный бульон, используя каждый тест-микроорганизм с более высоким содержанием (> 1000 КОЕ в каждой пробирке; о приготовлении инокулята см. 5.2.1), и перемешивают.
Инокуляция целевых и нецелевых микроорганизмов как смешанной культуры: для испытаний смешанных культур в селективных средах инокулируют испытуемый бульон и эталонный бульон малым количеством целевых микроорганизмов (например, от 10 до 100 КОЕ на каждую пробирку; о приготовлении инокулята см. 5.2.1) и в ту же пробирку вносят значительное количество нецелевых микроорганизмов (> 1000 КОЕ в каждую пробирку; о приготовлении инокулята см. 5.2.1), и перемешивают.
Инокуляция целевых и нецелевых микроорганизмов в разбавителях и транспортных средах: инокулируют разбавители тест-микроорганизмами (например, от 100 до 1000 КОЕ в каждую пробирку; о приготовлении инокулята см. 5.2.1), и перемешивают.
Соблюдают время и температуру инкубации, установленные в стандартных методах.
Разбавители должны инкубироваться в течение 45 мин при комнатной температуре и затем быть разлиты по чашкам. Транспортные среды должны инкубироваться при соответствующей температуре и нужное время в соответствии с обычным использованием и затем быть разлиты по чашкам.
Берут аликвотный объем или, при необходимости, разбавление каждого бульона после инкубации и распределяют в чашке с неингибирующим агаром, как это описано в 5.3.1.
Примечание - Для испытаний смешанных культур необходимо проводить распределение, когда это возможно, на чашках с неселективным агаром, которое позволяет достичь дифференциации микроорганизмов в смешанной культуре (например, для подсчета видов Escherichia coli и Salmonella используется агар для чашечного подсчета с MUG). В случае, когда невозможно различить смешанные культуры на неселективном агаре, следует использовать среды с селективным агаром при условии, что были предварительно испытаны их эксплуатационные характеристики.
5.4.2.2 Снятие результатов, расчеты и интерпретация
После инкубации проводят подсчет колоний целевых и нецелевых микроорганизмов в случае, если в смешанных культурах можно различить разные типы. Расчеты и интерпретацию следует проводить с учетом цели исследования:
1) сравнительная интерпретация между эталонным и испытуемым бульонами, используя значения PR и SF, как это описано в 4.2.3.2 и 4.2.3.3:
- для целевых микроорганизмов PR не должен быть < 0,1 (разница в росте не превышает одного порядка величины);
- для нецелевых микроорганизмов SF должен достигать по меньшей мере 2;
- в смешанных культурах рост целевых микроорганизмов не должен ингибироваться нецелевыми микроорганизмами, т.е. целевые микроорганизмы должны всегда быть доминирующей популяцией;
2) в других случаях, когда достигается фиксированное минимальное количество целевых микроорганизмов и максимальное количество нецелевых микроорганизмов, более уместно, что:
- содержание целевых микроорганизмов должно достигать от 106 КОЕ/см3 до 108 КОЕ/см3;
- содержание нецелевых микроорганизмов не должно превышать 104 КОЕ/см3 в селективном бульоне;
3) в случае разбавителей и транспортных сред не требуется ни пониженное, ни повышенное количество целевых и/или нецелевых микроорганизмов. Число микроорганизмов после инкубации в данных средах должно быть в пределах ±50% исходного количества.
Примечание - Качество жидкой среды в плане свойств оптимального роста проявляется наиболее обстоятельно на ранней стадии роста. Анализ продолжительности лог-фазы и роста в начале лог-фазы дает наиболее точную информацию относительно производительности и селективности целевых и нецелевых микроорганизмов соответственно в испытуемом и эталонном бульонах. Таким образом, если пытаются обнаружить только минимальные различия в качестве сред, следует провести посев штрихом из жидких сред в чашках после сокращенного периода инкубации продолжительностью, например, 6 или 12 ч.
5.4.3 Полуколичественный метод с одной пробиркой для целевых, нецелевых и смешанных микроорганизмов
5.4.3.1 Процедура
Отбирают нужное количество пробирок или порций по 10 мл каждой испытуемой партии.
Инокуляция целевых и нецелевых микроорганизмов как смешанной культуры: инокулируют одну пробирку испытуемого бульона примерно от 10 до 100 КОЕ целевых микроорганизмов и в ту же пробирку инокулируют повышенное число нецелевых микроорганизмов (> 1000 КОЕ на каждую пробирку), и перемешивают.
Инокуляция нецелевых микроорганизмов: инокулируют одну пробирку испытуемого бульона микроорганизмами с повышенным содержанием (> 1000 КОЕ) и перемешивают.
Соблюдают время и температуру инкубации, установленные в стандартных методах.
Отбирают 10 мкл смешанной культуры и проводят посев штрихом в чашке с конкретной селективной средой для целевых микроорганизмов.
Отбирают одну петлю (10 мкл) культуры нецелевых микроорганизмов и проводят посев штрихом в чашке с неселективной средой (например, с триптиказо-соевым агаром).
Инкубируют обе чашки в надлежащих условиях необходимое время, как это установлено в соответствующих стандартах.
5.4.3.2 Расчеты и интерпретация результатов
Производительность испытуемого жидкого бульона является удовлетворительной, если по меньшей мере 10 колоний целевых микроорганизмов выросли в чашке с селективным агаром.
Селективность испытуемого жидкого бульона является удовлетворительной, если не наблюдалось никакого роста (или менее 10 КОЕ) нецелевых микроорганизмов в чашке с неселективным агаром.
5.4.4 Качественный метод с одной пробиркой
5.4.4.1 Общие положения
Данный метод пригоден для определения рабочих концентраций жидких питательных сред. Метод является только качественным, и оценки, таким образом, приблизительные. Для испытания мутных сред, например тетратионатный бульон, этот метод неприменим.
5.4.4.2 Процедура
Для эксплуатационных испытаний жидких питательных сред рабочие культуры непосредственно инокулируют в испытуемую среду, используя петлю на 1 мкл.
Соблюдают время и температуру инкубации, установленные в стандартных методах.
5.4.4.3 Интерпретация результатов
Качественное определение следует проводить визуально путем определения баллов роста, напри мер, от 0 до 2.
Для пробирок и бутылок
- 0 соответствует нулевой мутности;
- 1 соответствует очень слабой мутности;
- 2 соответствует удовлетворительной мутности.
Число баллов для целевых микроорганизмов должно быть равно 2.
Примечания
1 Иногда рост микроорганизмов можно наблюдать только как агрегацию, осаждение клеток на дне пробирки или бутылки В этом случае оценивание и интерпретацию может улучшить тщательное встряхивание.
2 Данный метод позволяет также оценить другие характеристики, такие как образование газа, изменение цвета и т.п.
6 Документирование результатов испытаний
6.1 Информация, предоставляемая производителем
Производитель или поставщик питательных сред должен по запросу предоставлять сведения о ростовых характеристиках микроорганизмов и общую информацию, касающуюся конкретной партии питательной среды.
6.2 Прослеживаемость
Все данные обычных эксплуатационных испытаний должны быть зарегистрированы надлежащим образом и храниться в течение достаточного периода времени в соответствии с действующей системой качества. Рекомендуется использование контрольных листов для документирования и оценивания результатов испытаний (см. приложение А).
Приложение А
(рекомендуемое)
Пример таблицы регистрации результатов испытаний питательных сред, приготовленных лабораторией пользователя
![]() — Все документы — ГОСТы — ГОСТ ISO 11133-2-2011 (9.07.2014) МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ. РУКОВОДЯЩИЕ УКАЗАНИЯ ПО ПРИГОТОВЛЕНИЮ И ПРОИЗВОДСТВУ ПИТАТЕЛЬНЫХ СРЕД. Часть 2. ПРАКТИЧЕСКИЕ РУКОВОДЯЩИЕ УКАЗАНИЯ ПО ЭКСПЛУАТАЦИОННЫМ ИСПЫТАНИЯМ ПИТАТЕЛЬНЫХ СРЕД
— Все документы — ГОСТы — ГОСТ ISO 11133-2-2011 (9.07.2014) МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ. РУКОВОДЯЩИЕ УКАЗАНИЯ ПО ПРИГОТОВЛЕНИЮ И ПРОИЗВОДСТВУ ПИТАТЕЛЬНЫХ СРЕД. Часть 2. ПРАКТИЧЕСКИЕ РУКОВОДЯЩИЕ УКАЗАНИЯ ПО ЭКСПЛУАТАЦИОННЫМ ИСПЫТАНИЯМ ПИТАТЕЛЬНЫХ СРЕД Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
 Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
 «МК»: в России не отменят льготную ипотеку
«МК»: в России не отменят льготную ипотеку
 Аренда квартир в Москве подешевела на 10 %
Аренда квартир в Москве подешевела на 10 %
 Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
