![]() — Все документы — ГОСТы — ГОСТ 33163-2014 ПРОДУКЦИЯ СОКОВАЯ. ОПРЕДЕЛЕНИЕ БАКТЕРИЙ РОДА Alicyclobacillus
— Все документы — ГОСТы — ГОСТ 33163-2014 ПРОДУКЦИЯ СОКОВАЯ. ОПРЕДЕЛЕНИЕ БАКТЕРИЙ РОДА Alicyclobacillus
ГОСТ 33163-2014 ПРОДУКЦИЯ СОКОВАЯ. ОПРЕДЕЛЕНИЕ БАКТЕРИЙ РОДА Alicyclobacillus
Добавил:
Дата: [20.10.2016]
Дата введения - 1 января 2016 г.
Введен впервые
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 Разработан Некоммерческой организацией "Российский союз производителей соков" (РСПС)
2 Внесен Федеральным агентством по техническому регулированию и метрологии
3 Принят Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 5 декабря 2014 г. N 46-2014)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004-97 |
Код страны по МК (ИСО 3166) 004-97 |
Сокращенное наименование национального органа по стандартизации |
|
Азербайджан |
AZ |
Азстандарт |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
|
Узбекистан |
UZ |
Узстандарт |
|
Украина |
UA |
Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 25 марта 2015 г. N 160-ст межгосударственный стандарт ГОСТ 33163-2014 введен в действие в качестве национального стандарта Российской Федерации с 01 января 2016 г.
5 В настоящем стандарте учтены основные положения микробиологического метода ИФУ 12:2004 (Rev. 2007) "Метод определения бактерий рода Alicyclobacillus, вызывающих порчу фруктовых соков" (Международная федерация производителей фруктовых соков) [IFUMB Nr. 12 (Rev. 2007) "Method on the Detection of Taint Producing Alicyclobacillus in Fruit Juices" (International Federation of Fruit Juice Produces)]
6 Введен впервые
Настоящий стандарт распространяется на фруктовые и овощные соки, нектары, сокосодержащие напитки, фруктовые и овощные концентрированные соки, пюре и концентрированные пюре, морсы и концентрированные морсы (далее - соковая продукция), в том числе предназначенную для детского питания, и устанавливает следующие микробиологические методы выявления и определения количества бактерий рода Alicyclobacillus:
- метод мембранной фильтрации;
- метод прямого посева на плотные питательные среды;
- метод выявления с использованием предварительного обогащения путем посева определенного объема готовой соковой продукции или определенной массы концентрированной соковой продукции в жидкие питательные среды.
При определении количества бактерий рода Alicyclobacillus с использованием предварительного обогащения используют метод НВЧ (наиболее вероятного числа).
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Технические условия
ГОСТ 2493-75 Реактивы. Калий фосфорнокислый двузамещенный 3-водный. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 3652-69 Реактивы. Кислота лимонная моногидрат и безводная. Технические условия
ГОСТ 4198-75 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10929-76 Реактивы. Водорода пероксид. Технические условия
ГОСТ ISO 11133-1-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории
ГОСТ ISO 11133-2-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия*
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
ГОСТ 31904-2012 Продукты пищевые. Методы отбора проб для микробиологических испытаний
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 бактерии рода Alicyclobacillus: Кислотоустойчивые, термо- и ацидофильные, спорообразующие, грамположительные или грамвариабельные, палочковидные, факультативно-анаэробные микроорганизмы, образующие типичные колонии на плотных питательных средах.
Примечания:
1 - Бактерии рода Alicyclobacillus включают в себя виды: A. acidoterrestris, A. acidocaldarius, A. hesperidum и другие. Растут в среде от 2 до 6 ед. рН при температуре от 16°С до 70°С.
2 - Для подтверждения принадлежности к бактериям рода Alicyclobacillus отбирают все типы выросших колоний.
3.2 выявление бактерий рода Alicyclobacillus: Установление факта присутствия или отсутствия бактерий рода Alicyclobacillus в определенной массе или объеме продукта.
3.3 определение количества бактерий рода Alicyclobacillus: Подсчет числа колониеобразующих единиц (КОЕ) бактерий рода Alicyclobacillus, содержащихся в 1 г или 1 см3 продукта, в соответствии с методами, указанными в настоящем стандарте.
3.4 гваякол (2-метоксифенол): Продукт жизнедеятельности бактерий рода Alicyclobacillus, характеризующийся появлением постороннего запаха, характеризуемого как лекарственный, дымный или фенольный.
4.1 Бактерии рода Alicyclobacillus образуют споры, которые хорошо выживают в соковой продукции даже при низких значениях рН и после термообработки.
4.2 Принадлежность бактерий к роду Alicyclobacillus подтверждают путем микроскопического исследования присутствия спор в диагностических средах (см. раздел 5) при рН ниже 3,8 ед. рН.
4.3 Для стимулирования спорообразования при проведении подтверждения принадлежности бактерий к роду Alicyclobacillus, при выявлении присутствия (отсутствия) спор бактерий рода Alicyclobacillus в определенной массе или объеме соковой продукции и при определении количества спор бактерий рода Alicyclobacillus в 1 г или 1 см3соковой продукции требуется предварительная тепловая обработка (далее - тепловой удар).
4.4 Бактерии рода Alicyclobacillus, выделяющие гваякол, дают положительный результат пероксидазного теста и растут при температуре до 65°С. Штаммы бактерий рода Alicyclobacillus, растущие при температуре от 65°С и выше, преимущественно дают отрицательный результат пероксидазного теста на гваякол.
4.5 При проведении отбора проб соковой продукции для исследования ее на наличие бактерий рода Alicyclobacillus используют посуду и инструменты, стерилизованные в суховоздушном шкафу или путем автоклавирования, или используют стерильную одноразовую посуду и инструменты.
Примечание - При проведении отбора проб соковой продукции для исследования ее на наличие бактерий рода Alicyclobacillus не рекомендуется погружение в спирт и фламбирование им посуды для отбора проб, контуров, шпателей или контейнеров, так как это не гарантирует уничтожения спор этих бактерий.
5.1 Общие требования к качеству реактивов - по ГОСТ ISO 7218, проверка пригодности и обеспечение качества готовых питательных сред - по ГОСТ ISO 11133-1 и ГОСТ ISO 11133-2.
5.2 Для культивирования бактерий рода Alicyclobacillus используют жидкие среды обогащения и плотные селективные питательные среды: YSG (дрожжевой экстракт с глюкозой и крахмалом), ВАТ (Alicyclobacillus Agar), которые поддерживают рост всех известных видов Alicyclobacillus. K-агар (при культивировании при температуре 45°С) поддерживает преимущественно рост вида A. acidoterrestris и ограниченный рост прочих видов, например, A. acidocaldarius и A. acidiphilus.
Состав и порядок приготовления питательных сред указаны в приложении А.
5.3 Натрия гидроокись по ГОСТ 4328, раствор массовой концентрацией 100 г/дм3, готовят по ГОСТ 10444.1.
5.4 Кислота соляная по ГОСТ 3118, раствор массовой концентрацией 36,5 г/дм3, готовят по ГОСТ 10444.1.
5.5 Раствор физиологический, готовят по ГОСТ 10444.1.
5.6 Вода дистиллированная по ГОСТ 6709.
5.7 Спирт этиловый ректификованный по ГОСТ 18300.
5.8 Натрий хлористый по ГОСТ 4233.
Примечание - Допускается использование готовых питательных сред, растворов реактивов и наборов, аналогичных по составу указанным в 5.1 и 5.2, приложении А, зарегистрированных на территории государств, принявших стандарт.
6.1 Аппарат для суховоздушной стерилизации (сушильный шкаф) или стерилизатор паровой (автоклав), с регулирующими устройствами для поддержания заданной температуры, с допустимой погрешностью ±3°С.
6.2 Весы неавтоматического действия с наибольшим пределом взвешивания 500 г, пределами допускаемой абсолютной погрешности ±0,1 мг.
6.3 Установка с насосом для вакуумного фильтрования растворов.
6.4 Баня водяная, поддерживающая температуру 80°С с погрешностью ±1°С.
6.5 Термостаты любой конструкции, с диапазоном рабочих температур в интервале (45±5)°С.
6.6 Микроскоп оптический, обеспечивающий просмотр в проходящем свете с видимым увеличением 900 - 1000 крат, оснащенный устройством и объективами для фазово-контрастной микроскопии.
6.7 рН-метр любой конструкции с погрешностью ±0,1 ед. рН при температуре 25°С.
6.8 Термометр лабораторный ртутный, с диапазоном измерения от 0°С до 100°С и ценой деления шкалы не более 1°С.
6.9 Фильтры мембранные стерильные с диаметром пор 0,22 мкм.
6.10 Петля бактериологическая из платиноиридиевого или никель-хромового сплава диаметром около 3 мм, вмещающая за один раз около 10 мм3 культуральной среды.
6.11 Чашки Петри диаметром 90 или 120 мм по нормативным документам государств, принявших стандарт.
6.12 Колбы конические вместимостью 250 и 500 см3 по ГОСТ 25336.
6.13 Пробирки биологические П-2-16-150 по ГОСТ 25336.
6.14 Пипетки градуированные 2-го класса точности по ГОСТ 29227 вместимостью 1, 2, 5 и 10 см3.
6.15 Колбы мерные 2-го класса точности вместимостью 50, 100 и 1000 см3 исполнений 2 или 2а по ГОСТ 1770.
6.16 Цилиндры мерные 2-го класса точности по ГОСТ 1770.
6.17 Стаканы вместимостью 50, 100 и 1000 см3 по ГОСТ 25336.
6.18 Стекла предметные по ГОСТ 9284.
6.19 Допускается применение других средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также посуды и материалов по качеству не хуже указанных.
Примечание - При одинаковых технических характеристиках одноразовое оборудование предпочтительнее многоразового.
Отбор проб - по ГОСТ 31904, подготовка проб - по ГОСТ 26669 со следующим дополнением:
Количество отбираемой пробы соковой продукции должно быть массой или объемом не менее 50 г (см3), без повреждений и изменений в процессе транспортирования и хранения.
При исследовании соковой продукции, расфасованной в потребительские упаковки, для проявления жизнедеятельности бактерий рода Alicyclobacillus перед исследованием их термостатируют, не вскрывая, при температуре 45°С в течение 3 сут.
Пробы соковой продукции отбирают асептическим способом, исключающим микробное загрязнение из окружающей среды, с помощью подходящего стерильного инструмента и контейнеров. Не рекомендуются дезинфекция спиртом посуды, фламбирование шпателей или контейнеров при отборе проб соковой продукции, не гарантирующих уничтожения спор бактерий. Для этого используют посуду и инструменты, стерилизованные в суховоздушном шкафу или путем автоклавирования, или стерильную одноразовую посуду и инструменты.
8.1 Метод мембранной фильтрации
8.1.1 Сущность метода
Метод основан на фильтровании определенной массы осветленной концентрированной соковой продукции или определенного объема соковой продукции в потребительской упаковке, раствора сахара или питьевой воды или их разведений через мембранный фильтр, переносе фильтров на поверхность плотной среды, последующем инкубировании посевов на фильтрах и подсчете выросших колоний.
Метод мембранной фильтрации применяют при содержании менее 150 КОЕ в 1 см3 для осветленной соковой продукции в потребительской упаковке или менее 1500 КОЕ в 1 г для концентрированной осветленной соковой продукции.
Перед фильтрацией осветленных концентрированных соков готовят их исходное разведение.
8.1.2 Приготовление исходной суспензии и последующих десятикратных разведений
Исходную суспензию продукта и последующие десятикратные разведения из нее готовят по [1].
Для приготовления исходного разведения осветленного концентрированного сока 10 г пробы, отобранной по разделу 7, помещают в коническую колбу вместимостью 250 см3, разводят физиологическим раствором в соотношении 1:10 и тщательно перемешивают.
Последующие десятикратные разведения осветленного концентрированного сока, осветленной соковой продукции в потребительской упаковке готовят по [1] таким образом, чтобы на поверхности мембранного фильтра вырастало от 10 до 15 типичных колоний.
Готовят параллельно две исследуемые пробы.
8.1.3 Тепловой удар
При выявлении или определении количества спор бактерий рода Alicyclobacillus, а также для стимулирования образования спор при проведении подтверждения принадлежности бактерий к роду Alicyclobacillus проводят прогрев проб соковой продукции или прогрев суспензий выявленных культур микроорганизмов (тепловой удар). Задача обработки тепловым ударом состоит в стимулировании спорообразования и инактивации вегетативных клеток.
Прогревают две колбы с пробами, подготовленными по 8.1.2, содержащих по 100 см3 исходной суспензии продукта или ее разведения, в течение 10 мин при температуре (80±1)°С на водяной бане, следя за тем, чтобы уровень воды в бане был выше уровня пробы, и чтобы время достижения температуры пробы до (80±1)°С не превышало 5 мин. После прогревания извлекают колбы с пробами и быстро охлаждают их до 40°С, охлаждая колбу под струей холодной воды.
Прогрев суспензий выявленных культур микроорганизмов проводят в пробирках. Суспензии готовят из выросших колоний на физиологическом растворе.
8.1.4 Проведение посева
Подготовку чашек Петри со средой к посеву и посев проводят по ГОСТ ISO 7218.
Одновременно для контроля стерильности плотных питательных сред в контрольную стерильную чашку Петри наливают около 15 см3 среды и инкубируют вместе с посевами.
Содержимое каждой из двух колб, подготовленных по 8.1.2 или 8.1.3, фильтруют асептически с применением мембранных фильтров и смывают остатки пробы с боковых частей установки для фильтрования примерно 20 см3стерильной дистиллированной воды или физиологического раствора.
Первый мембранный фильтр асептически переносят на поверхность среды K-агар, а второй фильтр переносят на поверхность YSG-arapa или ВАТ-агара, разлитых в чашки Петри, избегая образования пузырьков воздуха между средой и фильтром. Поверхность фильтра с осевшими на ней бактериями должна быть обращена вверх.
Посевы и контрольные чашки Петри со средой инкубируют вместе при одинаковых условиях.
8.1.5 Культивирование посевов
Переворачивают чашки Петри с посевами (см. 8.1.4) и с контролем плотных питательных сред крышкой вниз, помещают в термостат и инкубируют при температуре (45±1)°С в течение (48±2) ч.
При термостатировании посевов проводят ежедневные наблюдения за появлением признаков развития микроорганизмов.
Если после двух суток термостатирования в посевах нет признаков роста бактерий, то общее время инкубации продлевают еще на (72±2) ч.
Примечание - Посевы следует защищать от высыхания во время инкубации, поместив их в стерильный пластиковый пакет или иной герметичный контейнер.
8.1.6 Подтверждение принадлежности выросших колоний к бактериям рода Alicyclobacillus
Подтверждение принадлежности выросших колоний проводят по разделу 9.
Для этого из посевов выбирают репрезентативное количество колоний (по пять колоний каждого типа), с которыми будут выполнены последующие исследования, подтверждающие их принадлежности к бактериям рода Alicyclobacillus.
Если в посевах выросло менее пяти колоний, то для подтверждения принадлежности к бактериям рода Alicyclobacillus, отбирают все выросшие колонии.
Примечание - Среды YSG и ВАТ поддерживают рост всех известных видов бактерий рода Alicyclobacillus. Поэтому велика вероятность, что в данных средах будет виден более широкий спектр колоний по сравнению с K-агаром.
8.1.7 Обработка результатов
8.1.7.1 При подсчете числа выросших колоний на K-агаре, YSG-агаре или ВАТ-агаре, по окончании культивирования посевов по 8.1.5 отбирают чашки Петри с фильтрами и подсчитывают выросшие колонии в том случае, если их число отвечает требованиям, указанным в 8.1.2. Если на каждой из параллельных чашек Петри число колоний менее 10 - 15 КОЕ, то допускается использовать для подсчета суммарное количество колоний, выросших на двух параллельных чашках, а также допускается использовать чашки Петри, на которых выросло в сумме менее 15 колоний.
Примечание - Если подсчитанное количество колоний менее 15, то результаты выражают, пользуясь ГОСТ 26670 (справочное приложение) или по ГОСТ ISO 7218.
Пример - Количество подсчитанных колоний равно А (менее 15), а в скобках указывают нижнюю и верхнюю границу для 95%-го доверительного интервала. Если на чашках выросло более 15 отдельных колоний, то эти чашки также используют для подсчета.
Пересчет количества бактерий рода Alicyclobacillus на 1 г (см3) в соковой продукции и запись результатов проводят по ГОСТ 26670 или по ГОСТ ISO 7218.
Конечный результат подсчета количества бактерий рода Alicyclobacillus выражают в следующем виде: "В 1 г или 1 см3 соковой продукции обнаружено число КОЕ бактерий рода Alicyclobacillus".
8.1.7.2 При выявлении присутствия (отсутствия) бактерий рода Alicyclobacillus методом мембранной фильтрации или методом прямого посева на плотные питательные среды подсчета количества выросших колоний не проводят.
8.1.7.3 Результаты оценивают по каждой пробе отдельно и регистрируют в протоколе согласно ГОСТ ИСО/МЭК 17025 с указанием метода и настоящего стандарта.
8.2 Метод прямого посева на поверхность питательной среды
8.2.1 Сущность метода
Метод основан на посеве определенного объема (массы) соковой продукции или ее разведений на поверхность плотной селективной питательной среды, последующем инкубировании чашек с посевами и подсчете числа типичных выросших колоний.
Метод прямого посева на питательные среды применяют для осветленных, неосветленных концентрированных соков, осветленных соков, соков с мякотью или клетками цитрусовых фруктов и концентрированных пюре при обсемененности не менее 1500 КОЕ в 1 г для концентрированной соковой продукции и не менее 150 КОЕ в 1 см3для готовой соковой продукции.
В случаях, когда проводят выявление присутствия в соковой продукции бактерий рода Alicyclobacillus в виде спор или определяют их количество, проводят их дополнительную обработку тепловым ударом по 8.1.3.
8.2.2 Приготовление исходной суспензии и последующих десятикратных разведений
Исходную суспензию продукта и последующие десятикратные разведения из нее готовят по [1].
Для приготовления исходного разведения 10 г концентрированной соковой продукции, отобранной по разделу 7, помещают в коническую колбу вместимостью 250 см3, разводят физиологическим раствором в соотношении 1:10 и тщательно перемешивают.
Последующие десятикратные разведения соковой продукции готовят по [1] таким образом, чтобы на поверхности чашки Петри вырастало от 15 до 150 типичных колоний.
Примечание - Если на чашках выросло менее 15 отдельных колоний, то эти чашки также используют для подсчета, при этом руководствуются примечанием к 8.1.7.1.
8.2.3 Посев на питательную среду
Проводят посев соковой продукции на две параллельные чашки Петри (если проба жидкая) или из первичного исходного разведения другой соковой продукции и из каждого выбранного для посева разведения. Переносят с помощью стерильной пипетки 0,1 - 0,2 см3 жидкой соковой продукции, исходной суспензии (первичное разведение) или других разведений в середину каждой чашки Петри, снабженной надписью и содержащей плотную среду.
Тщательно распределяют с помощью шпателя посевной материал равномерно и, по возможности, быстро по поверхности среды, не касаясь стенок чашки Петри, пока на поверхности агара не останется видимой жидкости.
8.2.4 Культивирование посевов
Культивирование посевов - по 8.1.5.
8.2.5 Подтверждение принадлежности выросших колоний к бактериям рода Alicyclobacillus
Подтверждение принадлежности выросших колоний проводят по разделу 9. Отбор колоний для подтверждения их принадлежности к бактериям рода Alicyclobacillus проводят по 8.1.6.
8.2.6 Обработка результатов - по 8.1.7.1 и 8.1.7.2.
8.3 Выявление присутствия (отсутствия) бактерий рода Alicyclobacillus и определение количества по методу НВЧ
8.3.1 Сущность методов
Методы основаны на использовании предварительного обогащения для выявления присутствия (отсутствия) бактерий рода Alicyclobacillus путем посева определенного объема или массы (для концентрированной соковой продукции) в жидкие питательные среды.
Для концентрированной соковой продукции готовят исходное разведение, готовую соковую продукцию высевают без разведений. Если необходимо, то из исходного разведения концентрированной соковой продукции готовят ряд последовательных десятикратных разведений. Необходимое количество соковой продукции высевают в жидкие селективные среды (см. приложение А).
При определении количества бактерий рода Alicyclobacillus в 1 г или в 1 см3 соковой продукции по методу НВЧ высевают в трехкратной повторное не менее трех объемов или массы соковой продукции, отличающиеся по количеству высеваемой соковой продукции в 10 раз.
Пример - При посеве концентрированной соковой продукции высевают по 1 см3 исходного разведения в три пробирки с жидкой селективной средой + по 1 см3 первого десятикратного исходного разведения в три пробирки с жидкой селективной средой + по 1 см3 второго десятикратного разведения в три пробирки с жидкой селективной средой.
При посеве готовой соковой продукции соответственно высевают соковую продукцию без разведения и два последующих десятикратных разведения.
Посев соковой продукции или исходного разведения, или десятикратных разведений проводят в среды в соотношении 1:10.
При посеве больших объемов исходных разведений или готовой продукции (например, 10 или 100 см3) допускается проводить посев соответственно в равные объемы сред двойной концентрации.
Посевы инкубируют при температуре (45±1)°С по 8.1.5.
8.3.2 Выделение типичных колоний
Через (48![]() 2) ч посевы на бульоне обогащения достают из термостата и аккуратно перемешивают содержимое пробирки или колбы с признаками любого роста.
2) ч посевы на бульоне обогащения достают из термостата и аккуратно перемешивают содержимое пробирки или колбы с признаками любого роста.
После перемешивания питательную среду пересеивают методом истощающего штриха по ГОСТ ISO 7218 на поверхность K-агара и на поверхность YSG-агара или ВАТ-агара.
Засеянные чашки Петри и бульон обогащения без признаков роста помещают в термостат и термостатируют при температуре (45±1)°С.
Если после двух суток культивирования по 8.1.5 в посевах на чашки Петри отсутствуют признаки роста колоний, типичных для бактерий рода Alicyclobacillus, то общее время инкубации чашек продлевают еще на (72±2) ч. Из пробирок или колб, в которых появились признаки роста, проводят пересевы петлей на поверхность плотных сред. Культивирование посевов проводят по 8.1.5.
По окончании культивирования посевов отбирают чашки Петри, на которых обнаружен рост микроорганизмов.
8.3.3 Подтверждение принадлежности выросших колоний к бактериям рода Alicyclobacillus
Подтверждение принадлежности выросших колоний проводят по разделу 9. Отбор колоний для подтверждения их принадлежности к бактериям рода Alicyclobacillus проводят по 8.1.6.
8.3.4 Обработка результатов
Конечный результат выявления присутствия (отсутствия) бактерий рода Alicyclobacillus выражают в следующем виде: "В X г или X см3 соковой продукции обнаружены (не обнаружены) бактерии рода Alicyclobacillus", где X - масса (объем) пробы соковой продукции, взятой на исследование, г (см3).
При определении количества бактерий рода Alicyclobacillus по методу НВЧ после подтверждения принадлежности выросших на жидких средах бактерий к роду Alicyclobacillus пересчет их количества на 1 г или 1 см3 соковой продукции проводят по ГОСТ 26670 или ГОСТ ISO 7218.
Обработка результатов - по 8.1.7.1 и 8.1.7.2.
9.1 Для дальнейшего подтверждения выделенных культур изучают их отношение к окраске по Граму, способности к росту при 3,7 ед. рН и способности к образованию гваякола (пероксидазный тест, см. приложение Б).
9.2 Определение способности к росту при 3,7 ед. рН
9.2.1 Из каждой выбранной колонии засевают штрихами по ГОСТ ISO 7218 по одной чашке Петри с нейтральной средой (например, мясопептонным агаром, триптическим соевым агаром), K агаром, ВАТ-агаром и две чашки с YSG-агаром.
9.2.2 Термостатируют посевы на нейтральной среде, K-агаре и ВАТ-агаре и YSG-агаре при температуре (45±1)°С в течение 3 - 5 сут. Вторую чашку с посевом на среде YSG-агар термостатируют при температуре (65±1)°С в течение 2 - 3 сут.
9.2.3 На нейтральной среде рост бактерий рода Alicyclobacillus не наблюдается. Если в этой среде отмечен рост колоний, то они не относятся к роду Alicyclobacillus.
Результат подтверждения - отрицательный.
9.2.4 Если рост колоний на K-агаре при температуре 45°С отсутствует, то рост колоний проверяют на YSG-агаре при той же температуре.
Вероятность того, что вызывающие порчу штаммы бактерий рода Alicyclobacillus будут расти на YSG-агаре при температуре (65±1)°С, минимальна. Если при температуре 65°С наблюдается рост колоний, то они не относятся к роду Alicyclobacillus.
Результат подтверждения - отрицательный.
9.3 Окраска по Граму
Приготовление мазков из культур, выросших на поверхности питательных сред, и окраску их по Граму проводят по ГОСТ 30425.
Бактерии рода Alicyclobacillus - грамположительные палочки**.
9.4 Проверка наличия спорообразования
9.4.1 Проверяют культуры, выросшие на ВАТ-агаре, на наличие у них спорообразования путем просмотра с помощью фазово-контрастной микроскопии живого препарата, приготовленного методом раздавленной капли или путем окрашивания препаратов по Граму по ГОСТ 30425 или используют специальные красители для спор по ГОСТ 30425.
На YSG-агаре спорообразование бактерий рода Alicyclobacillus не происходит. Для подтверждения наличия спор используют ВАТ-агар, со значением рН менее 4 ед. рН, чтобы исключить рост прочих кислотоустойчивых спорообразующих бактерий, например, В. coagulans.
Если в приготовленных препаратах с ВДТ-агара спор не обнаружено, то для инициации образования спор проводят прогрев суспензий обнаруженных микроорганизмов (тепловой удар) по 8.1.3. После прогрева 0,1 - 0,2 см3 суспензии высевают на поверхность ВАТ-агара. Посевы термостатируют по 8.1.5, затем готовят из выросших культур препараты для определения наличия спор.
9.5 Колонии, которые образуют споры при 3,7 ед. рН и не растут при рН выше 6 ед. рН и температуре 65°С, идентифицируют как предполагаемые штаммы Alicyclobacillus.
9.6 Проведение пероксидазного теста на гваякол (дополнительный тест)
Чашку с YSG-агаром (после культивирования при 45°С) сохраняют для пероксидазного теста на выявление гваякола (см. приложение Б).
По результатам дополнительного подтверждения к бактериям рода Alicyclobacillus относят факультативно-анаэробные, образующие споры грамоположительные палочки, дающие положительную реакцию на гваякол.
9.7 Схемы выявления бактерий рода Alicyclobacillus в соковой продукции приведены в справочных приложениях В и Г***.
_____________________________
* На территории Российской Федерации действует ГОСТ Р 55878-2013 "Спирт этиловый технический гидролизный ректификованный. Технические условия".
** Возможна вариабельность (неоднородность) окрашивания для культур более 24 ч.
*** В приложениях В и Г при выявлении и определении количества спор бактерий рода Alicyclobacillus в концентрированной и готовой соковой продукции проводят посев пробы соковой продукции, подвергнутой тепловому удару.
Приложение А
(обязательное)
А.1 Питательная среда K-агар*
А. 1.1 Состав:
- дрожжевой экстракт - 2,0 г;
- пептон мясной ферментативный - 5,0 г;
- глюкоза - 1,0 г;
- твин 80 - 1,0 г;
- агар питательный - от 15 до 18 г;
- вода - 1000 см3.
А.1.2 Приготовление
Компоненты среды растворяют в дистиллированной воде, стерилизуют путем автокпавирования в течение 15 мин при температуре 121°С, После автокпавирования охлаждают до температуры 50°С и доводят до (3,7±0,1) ед. рН соляной или ортофосфорной кислотой.
Готовую среду хранят в холодильнике при температуре от 2°С до 8°С в соответствии с ГОСТ 10444.1.
Готовая среда имеет бледно желтую окраску, слегка опалесцирует.
А.1.3 Ростовые характеристики эталонных штаммов через 3 - 5 сут при температуре 45°С - 46°С приведены в таблице А.1.
Таблица А.1
|
Штаммы микроорганизмов |
Рост |
|
Alicyclobacillus acidocaldarius (27009) Alicyclobacillus acidoterrestris (49028) Alicyclobacillus acidocaldarius (43030) Escherichia coli (25922) Staphylococcus aureus (25923) |
Скудный или хороший Обильный Скудный или хороший Нет роста Нет роста |
|
Примечание - В скобках указан номер штамма в коллекции АТСС (American Type Culture Collection - Американская коллекция типовых культур). | |
А.2 Питательная среда VSG-агар*
А.2.1 Состав:
- дрожжевой экстракт - 2,0 г;
- глюкоза - 1,0 г;
- крахмал растворимый - 2,0 г;
- агар питательный - 15,0 г;
- вода - 1000 см3.
А.2.2 Приготовление
Компоненты среды растворяют в дистиллированной воде, стерилизуют путем автокпавирования в течение 15 мин при температуре 121°С. После автокпавирования охлаждают примерно до температуры 50°С и доводят до (3,7±0,1) ед. рН соляной кислотой.
Готовую среду хранят в холодильнике при температуре от 2°С до 8°С в течение 1 сут.
Готовая среда имеет бледную окраску, слегка опалесцирует.
А.2.3 Ростовые характеристики эталонных штаммов через 3 - 5 сут при температуре 45°С приведены в таблице А.2.
Таблица А.2
|
Штаммы микроорганизмов |
Рост |
|
Alicyclobacillus acidocaldarius (27009) Alicyclobacillus acidoterrestris (49028) Alicyclobacillus acidocaldarius (43030) |
Обильный Обильный Обильный |
|
Примечание - В скобках указан номер штамма в коллекции АТСС. | |
А.3 Питательная среда YSG-бульон
Состав питательной среды YSG-бульон аналогичен составу среды YSG-агар, за исключением агара.
При приготовлении YSG-бульона рекомендуется отрегулировать рН перед автоклавированием (в отличие от приготовления YSG-агара).
А.4 Питательная среда ВАТ-Агар*
А.4.1 Состав:
- дрожжевой экстракт - 2,0;
- глюкоза - 5,0;
- хлорид кальция CaCl2·2H2O- 0,26066;
- магния сульфат MgSO4·7H2O - 0,50;
- аммония сульфат (NH4)2SO4 - 0,20;
- калия дигидрофосфат KH2PO4 - 3,0;
- цинка сульфат ZnSO4·7H2O - 0,00018;
- меди сульфат CuSO4·5H2O - 0,00016;
- марганца сульфат MnSO4·7H2O - 0,00015;
- кобальта хлорид CoCl2·6H2O - 0,00018;
- борная кислота H3BO3- 0,00010;
- натрия молибдат Na2MoO4·2H2O - 0,00030;
- агар питательный - от 18 до 20 г (в зависимости от желирующих свойств агара);
- вода - 1000 см3.
А.4.2 Приготовление
Компоненты среды растворяют в дистиллированной воде, нагревают, при необходимости, для полного растворения и стерилизуют автоклавированием при 1,1 атм (121°С) в течение 15 мин.
Кислотность среды доводят до (4,0±0,2) ед. рН с помощью соляной кислоты или раствора NaOH. После автоклавирования среду охлаждают примерно до температуры 50°С и разливают в стерильные чашки Петри.
Готовую среду хранят в холодильнике при температуре от 2°С до 8°С в течение 1 сут.
Готовая среда имеет бледно-янтарную окраску, слегка опалесцирует.
А.4.3 Ростовые характеристики эталонных штаммов через 3 - 5 сут при температуре 45°С или через два - три дня при температуре 65°С приведены в таблице А.4.
Таблица А.4
|
Штаммы микроорганизмов |
Рост |
|
Alicyclobacillus acidocaldarius (27009) Escherichia coii (25922) Staphylococcus aureus (25923) Saccharomyces cerevisiae (19615) Candida albicans (10231) |
Хороший или обильный Нет роста Нет роста Нет роста Нет роста |
|
Примечание - В скобках указан номер штамма в коллекции АТСС. | |
А.5 Питательная среда ВАТ-бульон
Состав питательной среды ВАТ-бульон аналогичен составу среды ВАТ-агар за исключением агара. При приготовлении ВAT-бульона рекомендуется выполнить регулировку рН перед автоклавированием (в отличие от приготовления ВАТ-агара).
_____________________________
* Готовая среда выпускается фирмой HiMedia Pvt., Индия. Данная информация приведена для удобства пользователей настоящего стандарта и не исключает возможность применения других сред,
Приложение Б
(рекомендуемое)
Б.1 Сущность
Пероксидазный тест может применяться для подтверждения способности исследуемых микроорганизмов образовывать гваякол из ванилиновой кислоты. Такие виды, как А. acidoterrestris, A. acidiphilus, A. herbarius и пр., могут давать положительные результаты в данном тесте, но необязательно будут продуцировать гваякол во всей соковой продукции. Такие виды, как A. acidocaldarius, дают отрицательный результат в этом тесте. Поскольку результаты могут варьироваться в зависимости от активности исследуемой культуры и видов, важно включить в тест положительные и отрицательные контрольные культуры, т.е. A. acidoterrestris и A. acidocaldarius, соответственно, которые были выращены в тех же условиях, что и тестируемые колонии.
Определение основано на изменении цвета среды YSG с ванилиновой кислотой после реакции окисления пероксидом водорода. Реакция окисления катализируется пероксидазой. Гваякол окисляется до органического соединения красно-коричневого цвета, 3,3'-диметокси-4,4'-дифенилхинона (тетрагваякол) по следующей схеме:
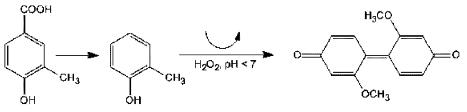
Использование YSG-бульона с ванилиновой кислотой позволяет за короткий промежуток времени накопить концентрации гваякола на уровне 10 мг/дм3.
Б.2 Средства измерений, вспомогательное оборудование, посуда и материалы
Средства измерений, вспомогательное оборудование, посуда и материалы - по разделу 6.
Б.3 Приготовление реагентов*
Б.3.1 Для проведения пероксидазного теста на наличие гваякола используют следующие реактивы:
- кислота 4-гидрокси-2-метоксибензойная (ванилиновая), C8H8O4, с массовой долей основного вещества не менее 97%;
- пероксид водорода по ГОСТ 10929 с массовой долей пероксида водорода 29% - 35%;
- пероксидаза хрена, лиофилизированный препарат с показателем чистоты RZ≥3, раствор с ферментативной активностью 5 Е/мг;
- кислота лимонная по ГОСТ 3652, раствор с массовой концентрацией 200 г/дм3, готовят по ГОСТ 10444.1;
калий фосфорнокислый однозамещенный по ГОСТ 4198 или двузамещенный 3-водный по ГОСТ 2493.
Б.3.2 Приготовление YSGVA-бульона с содержанием 250 мг/дм3 ванилиновой кислоты
Взвешивают на весах 0,125 г ванилиновой кислоты и растворяют в стакане при перемешивании в 500 см3 YSG-бульона.
Стерилизуют бульон путем автоклавирования в течение 10 мин при температуре 120°С. После автоклавирования разливают по 2 см3 в пробирки.
Б.3.3 Приготовление фосфатного буферного раствора
97 г двузамещенного фосфорнокислого натрия растворяют в мерной колбе вместимостью 500 см3 в дистиллированной воде, доводят до метки и перемешивают.
Стерилизуют путем автоклавирования в течение 10 мин при температуре 120°С.
Буферный раствор хранят в склянке из темного стекла с плотно закрытой пробкой - не более 1 мес.
Б.3.4 Приготовление раствора пероксида водорода с объемной долей 1%
3,5 см3 пероксида водорода переносят пипеткой в мерную колбу вместимостью 100 см3 и доводят объем дистиллированной водой до метки.
Раствор готовят непосредственно перед применением.
Б.3.5 Приготовление раствора гваякола с содержанием 1000 мг/дм3(контрольный раствор)
Взвешивают на весах 1,0 г гваякола и растворяют в мерной колбе вместимостью 1000 см3 в дистиллированной воде, доводят до метки и перемешивают.
Стерилизуют путем автоклавирования в течение 10 мин при температуре 120°С.
Срок хранения раствора в холодильнике при температуре не более 10°С - не более 1 мес.
Б.4 Обнаружение
Б.4.1 Для каждой группы исследуемых колоний готовят по пять пробирок с 2 см3 YSGVA-бульона.
Б.4.2 В первую пробирку с YSGVA-бульоном с помощью петли переносят несколько колоний (около 5 - 10, в зависимости от их размеров) с посева YSG-агара, культивированного при температуре (45±1)°С так, чтобы получилась умеренно густая суспензия. Тщательно перемешивают.
Б.4.3 Засевают положительную (A. acidoterrestris) и отрицательную (A. acidocaldarius) контрольные культуры в дополнительные YSGVA-бульоны. Тщательно перемешивают.
Б.4.4 Параллельно инкубируют еще два YSGVA-бульона без инокуляции: один используется в качестве холостой пробы, а второй - для контроля гваякола. В пробирку для контроля на гваякол добавляют 100 мм3 раствора гваякола.
Б.4.5 Инкубируют все пробирки при температуре (45±1)°С на водяной бане не менее 3 ч. Затем охлаждают содержимое пробирок до комнатной температуры.
Б.4.6 В каждую из трех пробирок с культурами последовательно добавляют:
- 1 см3 фосфатного буфера;
- 20 мм раствора H2O2;
- 20 мм3 раствора пероксидазы.
Б.4.7 Перемешивают содержимое пробирок и оставляют на 5 - 10 мин.
Б.4.8 Оценивают изменение цвета в пробирках и сравнивают с изменениями в контрольной пробе и пробиркой с гваяколом:
- положительная пробирка с культурой (коричневый цвет);
- отрицательная пробирка с культурой (бледный бежево-коричневый цвет, но без изменений);
- холостая проба (бледный бежево-коричневый цвет, но без изменений);
- контрольная пробирка на гваякол (густой коричневый/оранжевый цвет).
Б.4.9 Записывают результаты теста на гваякол как положительные для пробирок, показавших положительную реакцию, и как отрицательные для пробирок, показавших отрицательную реакцию.
Тест оценивают, как положительный или отрицательный для каждой группы исследованных колоний. Если результат промежуточный, то исследование повторяют с применением более насыщенной посевной культуры и соответствующих контрольных проб (положительной и отрицательной) или увеличивают период культивирования.
_____________________________
* Набор для пероксидазного теста выпускается компаниями Doehler и Kyokuto Pharmaceutical Industrial Со Ltd, Япония. Данная информация приведена для удобства пользователей настоящего стандарта, не является рекламой указанных реагентов и не исключает возможность применения других наборов.
Приложение В
(справочное)
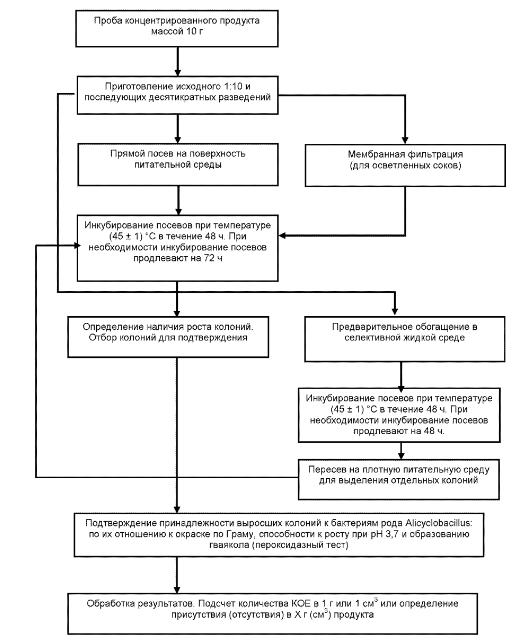
"Рисунок В1 - Схема выявления и определения количества бактерий рода Alicyclobacillus в концентрированной соковой продукции"
Приложение Г
(справочное)
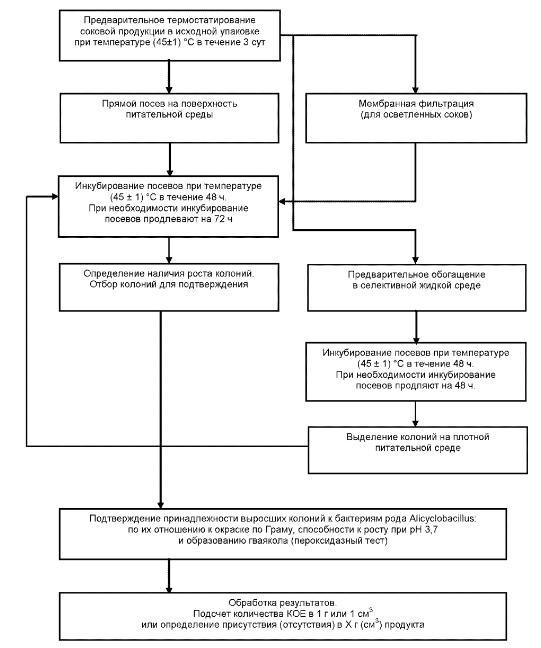
"Рисунок Г.1 - Схема выявления и определения количества бактерий рода Alicyclobacillus в готовой соковой продукции"
Библиография
|
[1] |
ISO 6887-1:1999 |
Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений |
(Нет голосов) |
-
29.05.2025
Слухи о скорой заморозке вкладов в России объяснили
 Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
-
29.05.2025
Дачникам рассказали о штрафах за нескошенную траву
 Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
-
29.05.2025
Вероятность исчезновения в России наличных денег оценили
 Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
-
29.05.2025
Перспективы исламского банкинга в России оценили
 Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
-
30.04.2025
Россиянам объяснили опасность зарплаты в конвертах
 Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии
Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии