Введен в действие приказом Федерального агентства по техническому регулированию и метрологии от 19 августа 2014 г. N 904-ст
Межгосударственный стандарт ГОСТ 32743-2014
"ДОБАВКИ ПИЩЕВЫЕ. МЕТОД ПОТЕНЦИОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ ЛИМОННОЙ КИСЛОТЫ И ЦИТРАТ-ИОНОВ В КОМПЛЕКСНЫХ ПИЩЕВЫХ ДОБАВКАХ"
Food additives. Method of potentiometric determining of citric acid and citric ions in the complex food additives
Дата введения - 1 января 2016 г.
Введен впервые
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
1 Область применения
Настоящий стандарт распространяется на комплексные пищевые добавки, содержащие лимонную кислоту (Е330) и ее натриевые (Е331), калиевые (Е332) и кальциевые (Е333) соли, и устанавливает потенциометрический метод определения массовых концентраций цитрат-ионов и лимонной кислоты в комплексных пищевых добавках в диапазоне измерений от 1·10-3 до 1·102 г/дм3.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.2.007.0-75 Система стандартов безопасности труда. Изделия электротехнические. Общие требования безопасности
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 12.4.103-83 Система стандартов безопасности труда. Одежда специальная защитная, средства индивидуальной защиты ног и рук. Классификация
ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 908-2004 Кислота лимонная моногидрат пищевая. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4234-77 Реактивы. Калий хлористый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25794.1-83 Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования
ГОСТ 27752-88 Часы электронно-механические кварцевые настольные, настенные и часы-будильники. Общие технические условия
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети "Интернет" или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Отбор проб
Отбор проб - по ГОСТ 908.
4 Требования безопасности
4.1 При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 и ГОСТ 12.4.103.
4.2 Помещение, в котором проводят анализы, должно быть оборудовано общей приточно-вытяжной вентиляцией по ГОСТ 12.4.021.
4.3 Электробезопасность при работе с электроустановками - по ГОСТ 12.2.007.0.
4.4 Организация обучения работающих безопасности труда - по ГОСТ 12.0.004.
4.5 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
4.6 Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
5 Метод анализа
5.1 Сущность метода
Метод потенциометрического определения лимонной кислоты и цитрат-ионов в комплексных пищевых добавках основан на способности электрохимического датчика - цитрат-селективного электрода (с жидкостным внутренним заполнением) - реагировать только на потенциалопределяющие ионы в сложных по составу водных растворах в присутствии других ионов.
В ходе анализа протекает следующая реакция
 (1)
(1)Цитрат-селективный электрод позволяет определить молярную концентрацию цитрат-ионов в растворе. Молярную концентрацию лимонной кислоты определяют по реакции (1).
Мешающими являются ацетат-ионы, хлорид-ионы, нитрат-ионы, бромид-ионы. Степень влияния мешающих ионов определяется коэффициентом селективности К. Чем меньше К, тем выше избирательность электрода к цитрат-ионам. Цитрат-ионы можно определять при 100-кратном избытке ацетат-ионов (K=10-2), при 10-кратном избытке хлорид-ионов (K=10-1), 60-кратном избытке нитрат-ионов (К = 0, 6). Присутствие бромид-ионов нежелательно (К = 2).
5.2 Условия проведения анализа
5.2.1 При подготовке и проведении анализа должны быть соблюдены следующие условия:
- температура окружающего воздуха ........................ от 15°С до 25°С;
- диапазон рабочих температур анализируемых растворов .... от 5°С до 35 °С;
- напряжение в электросети ............................... 220 В;
- частота тока в электросети ............................. от 49 до 51 Гц;
- рабочая область рН ..................................... от 5, 5 до 7, 5 ед. рН.
5.2.2 Требования к квалификации оператора
К проведению анализов допускаются специалисты, изучившие методику и прошедшие обучение для работы на приборах и инструктаж по технике безопасности.
5.3 Средства измерений, вспомогательное оборудование и устройства, посуда, материалы и реактивы
Весы неавтоматического действия по ГОСТ OIML R 76-1 специального класса с пределами допускаемой абсолютной погрешности ±0, 0005 г.
Весы неавтоматического действия по ГОСТ OIML R 76-1 специального класса с пределами допускаемой абсолютной погрешности ±0, 01 г.
Термометр жидкостный стеклянный с диапазоном измерения температуры от 0°С до 100°С, ценой деления шкалы 1°С по ГОСТ 28498.
Часы электронно-механические кварцевые по ГОСТ 27752.
рН-метр-милливольтметр-иономер с входным сопротивлением не менее 1010 Ом с диапазоном измерений рН от 0 до 14, окислительно-восстановительного потенциала от минус 999, 9 до 999, 9, от минус 1999 до минус 1000, от 1000 до 1999, пределами допускаемой основной абсолютной погрешности измерения рН ±0, 05 и окислительно-восстановительного потенциала ±1, 0.
Электрод цитрат-селективный (с жидкостным внутренним заполнением) с диапазоном определяемых молярных концентраций цитрат-ионов от 1·10-5 до 1·10-1 моль/дм3, значением потенциала (350 ±250) мВ в растворе цитрата натрия концентрацией 1·10-3 моль/дм3, электрическим сопротивлением при температуре (20 ±5)°С не более 2·108 Ом.
Электрод вспомогательный лабораторный хлорсеребряный или с солевым мостиком с электрическим сопротивлением при температуре 0°С не более 2·104 Ом, скоростью истечения раствора хлористого калия через электролитический ключ электрода при температуре (20±5)°С от 0, 3 до 3, 5 см3/сут.
Электроплитка бытовая по ГОСТ 14919.
Мешалка магнитная.
Колбы мерные 1-100(500, 1000)-2 по ГОСТ 1770.
Стаканы стеклянные В(Н)-1-100, В(Н)-1-250 по ГОСТ 25336.
Пипетки 4-1-1-1 по ГОСТ 29227.
Цилиндр мерный 1-100-1 по ГОСТ 1770.
Палочки стеклянные с оплавленным концом.
Бумага фильтровальная лабораторная по ГОСТ 12026.
Калий хлористый по ГОСТ 4234.
Натрий хлористый по ГОСТ 4233.
Натрий лимоннокислый трехзамещенный пищевой 2-водный (цитрат натрия) с массовой долей основного вещества не менее 99%.
Натрия гидроокись по ГОСТ 4328, х.ч.
Кислота серная плотностью 1, 83 г/см3 по ГОСТ 4204, х.ч.
Вода дистиллированная по ГОСТ 6709.
Допускается применение других средств измерений, вспомогательного оборудования и устройств, материалов и посуды, не уступающих вышеуказанным по метрологическим и техническим характеристикам и обеспечивающих необходимую точность измерения, а также реактивов, по качеству не хуже вышеуказанных.
5.4 Подготовка к анализу
5.4.1 Приготовление исходного раствора цитрата натрия молярной концентрации с (Na3C6H5O7) = 0, 1 моль/дм3
В предварительно взвешенном стеклянном стакане вместимостью 100 см3 взвешивают 2, 94 г цитрата натрия трехзамещенного 2-водного, растворяют в дистиллированной воде, затем количественно переносят в мерную колбу вместимостью 100 см3 и доводят объем дистиллированной водой до метки.
Срок хранения раствора в плотно закрытой емкости в условиях по 5.2.1 - не более 1 мес.
5.4.2 Приготовление насыщенного при температуре 20°С раствора хлористого калия
В предварительно взвешенном стеклянном стакане вместимостью 250 см3 взвешивают 160, 00 г хлористого калия, растворяют в дистиллированной воде, затем количественно переносят в мерную колбу вместимостью 500 см3 и доводят объем раствора дистиллированной водой до метки. Колбу с раствором ставят на электроплитку, доводят раствор до кипения и кипятят от 5 до 10 мин до полного растворения кристаллов хлористого калия. Раствор охлаждают до температуры 20°С. После охлаждения на дне колбы выпадут кристаллы хлористого калия.
Срок хранения раствора в плотно закрытой емкости в условиях по 5.2.1 - не более 1 мес.
5.4.3 Приготовление раствора хлористого калия с массовой концентрацией 250 г/дм3
В предварительно взвешенном стеклянном стакане вместимостью 100 см3 взвешивают 25, 00 г хлористого калия, растворяют в дистиллированной воде, затем количественно переносят в мерную колбу вместимостью 100 см3 и доводят объем раствора дистиллированной водой до метки.
Срок хранения раствора в плотно закрытой емкости в условиях по 5.2.1 - не более 1 мес.
5.4.4 Приготовление раствора серной кислоты молярной концентрации с (1/2 H2SO4) = 0, 1 моль/дм3
Раствор серной кислоты молярной концентрации с (1/2 H2SO4) = 0, 1 моль/дм3 готовят по ГОСТ 25794.1.
Срок хранения раствора в стеклянном сосуде в условиях по 5.2.1 - не более 6 мес.
5.4.5 Приготовление раствора гидроокиси натрия молярной концентрации с (NaOH) = 0, 1 моль/дм3
Раствор гидроокиси натрия молярной концентрации с (NaOH) = 0, 1 моль/дм3 готовят по ГОСТ 25794.1.
Срок хранения раствора в стеклянном сосуде в условиях по 5.2.1 - не более 6 мес.
5.4.6 Приготовление градуировочных растворов цитрата натрия
Для построения градуировочного графика используют градуировочные растворы цитрата натрия молярной концентрации c(Na3C6H5O7) = 0, 1 моль/дм3, 0, 01 моль/дм3, 0, 001 моль/дм3, 0, 0001 моль/дм3 и 0, 00001 моль/дм3.
Градуировочные растворы цитрата натрия готовят последовательным десятикратным разбавлением исходного раствора цитрата натрия молярной концентрации с (Na3C6H5O7) = 0, 1 моль/дм3, приготовленного по 5.4.1, дистиллированной водой. Значение рН градуировочных растворов измеряют рН-метром и доводят до 6 ед. рН, добавляя по каплям раствор серной кислоты молярной концентрации с (1/2 H2SO4) = 0, 1 моль/дм3 (см. 5.4.4).
5.4.7 Приготовление раствора хлористого натрия молярной концентрации с (NaCI) = 0, 005 моль/дм3
В предварительно взвешенном стеклянном стакане вместимостью 100 см3 взвешивают 0, 2923 г хлористого натрия, растворяют в дистиллированной воде, затем количественно переносят в мерную колбу вместимостью 1000 см3 и доводят объем раствора дистиллированной водой до метки.
Срок хранения раствора в плотно закрытой емкости при температуре от 15°С до 25°С - не более 1 мес.
5.4.8 Подготовка к работе цитрат-селективного электрода (с жидкостным внутренним заполнением)
5.4.8.1 Извлекают внутренний электрод сравнения. Заполняют цитрат-селективный электрод с помощью градуированной пипетки вместимостью 1 см3 1-го класса точности раствором в количестве от 1, 0 до 1, 5 см3, содержащим цитрат натрия с концентрацией 0, 01 моль/дм3 (см. 5.4.6) и хлористого натрия с концентрацией 0, 005 моль/дм3 (см. 5.4.7) в соотношении (1:1). Устанавливают внутренний электрод сравнения. Замену внутреннего раствора рекомендуется производить не реже, чем один раз в шесть месяцев.
5.4.8.2 Вымачивают цитрат-селективный электрод не менее 1 сут в 0, 01 моль/дм3 растворе цитрата натрия (см. 5.4.6).
5.4.8.3 После вымачивания цитрат-селективный электрод тщательно отмывают дистиллированной водой до возможно более высокого значения электродного потенциала 600 мВ.
5.4.8.4 При частом использовании цитрат-селективного электрода подготовку к работе начинают непосредственно с тщательной отмывки электрода дистиллированной водой без замачивания в растворе цитрата натрия.
5.4.8.5 Цитрат-селективный электрод хранят в растворе цитрата натрия концентрацией с (Na3C6H5O7) = 0, 01 моль/дм3, приготовленного по 5.4.6. Если перерыв в работе составляет более 5 сут, то электрод следует хранить в сухом месте.
5.4.9 Подготовка к работе вспомогательного лабораторного хлорсеребряного электрода
5.4.9.1 Осторожно вывинчивают пробку электрода. Через заливочное отверстие промывают полость электрода дистиллированной водой и заливают с помощью градуированной пипетки вместимостью 1 см3 1-го класса точности насыщенным при температуре 20°С раствором хлористого калия (см. 5.4.2) [для измерений при температуре ниже 5°С электрод заполняют раствором хлористого калия с массовой концентрацией 250 г/дм3 (см. 5.4.3). Выдерживают электрод в насыщенном растворе хлористого калия в течение 48 ч].
5.4.9.2 Уровень раствора в электроде должен быть выше уровня раствора в ячейке с контролируемым раствором. В процессе подготовки и измерений пробка должна быть удалена.
5.4.9.3 При резком уменьшении истечения полость электрода промывают дистиллированной водой и заполняют в соответствии с 5.4.9.1. Кипятят в дистиллированной воде в течение 20 мин нижнюю часть электрода - электролитический ключ.
5.4.9.4 В промежутках между измерениями электрод хранят заполненным насыщенным раствором хлористого калия (см. 5.4.2). При длительном хранении из полости электрода удаляют насыщенный раствор хлористого калия, промывают дистиллированной водой, высушивают, закрывают пробкой и хранят в упаковочной коробке.
5.4.10 Построение градуировочного графика
5.4.10.1 Подготавливают рН-метр-милливольтметр-иономер и электроды в соответствии с инструкциями по эксплуатации прибора и электродов.
5.4.10.2 В пять стеклянных стаканов вместимостью 100 см3 с помощью мерного цилиндра наливают по 50 см3 градуировочных растворов цитрата натрия: первый стакан - молярной концентрации с (Na3C6H5O7) = 0, 00001 моль/дм3, второй стакан - молярной концентрации с (Na3C6H5O7) = 0, 0001 моль/дм3, третий стакан - молярной концентрации с (Na3C6H5O7) = 0, 001 моль/дм3, четвертый стакан - молярной концентрации с (Na3C6H5O7) = 0, 01 моль/дм3 и пятый стакан - молярной концентрации с (Na3C6H5O7) = 0, 1 моль/дм3. В каждый стакан последовательно помещают цитрат-селективный электрод (с жидкостным внутренним заполнением) и вспомогательный лабораторный хлорсеребряный электрод (не промывая электроды перед каждым измерением), и при постоянном перемешивании, используя магнитную мешалку с фиксированной скоростью, в течение 2 мин проводят измерение потенциала электрода. Измерения выполняют не менее трех раз. На основании полученных результатов строят градуировочную кривую, откладывая на оси абсцисс с логарифмическими делениями содержание цитрат-иона (моль·10-3), введенного с градуировочными растворами, а на оси ординат - значение электродного потенциала в милливольтах.
Градуировочную кривую необходимо проверять каждый раз перед работой по двум градуировочным растворам по 5.4.6 с молярной концентрацией цитрат-ионов 0, 01 и 0, 001 моль/дм3.
5.4.11 Подготовка пробы
5.4.11.1 В предварительно взвешенном стеклянном стакане вместимостью 100 см3 взвешивают 10, 0 г анализируемой пробы комплексной пищевой добавки, растворяют в дистиллированной воде, затем количественно переносят в мерную колбу вместимостью 100 см3 и доводят объем раствора дистиллированной водой до метки. Мутные растворы перед проведением анализа фильтруют через фильтровальную бумагу.
5.4.11.2 Для анализа готовят растворы анализируемой пробы последовательным десятикратным разбавлением исходного раствора пробы, приготовленного по 5.4.11.1, до массовой концентрации 10, 0; 1, 0; 0, 1; 0, 01; 0, 001; 0, 0001 г/дм3 дистиллированной водой. Значение рН анализируемых растворов измеряют рН-метром и доводят до 6 ед. рН, добавляя по каплям раствор серной кислоты молярной концентрации с (1/2 H2SO4) = 0, 1 моль/дм3 или раствором гидроокиси натрия молярной концентрации с (NaOH) = 0, 1 моль/дм3.
5.5 Проведение анализа
В шесть стеклянных стаканов вместимостью 100 см3 с помощью мерного цилиндра наливают по 50 см3 раствора анализируемой пробы массовой концентрации 0, 0001; 0, 001; 0, 01; 0, 1; 1, 0; 10, 0 г/дм3. В раствор массовой концентрации 0, 0001 г/дм3 помещают цитрат-селективный электрод (с жидкостным внутренним заполнением) и вспомогательный лабораторный хлорсеребряный электрод и при постоянном перемешивании с помощью магнитной мешалки с фиксированной скоростью в течение 2 мин проводят измерение потенциала электрода. Затем последовательно проводят измерение потенциала электрода в растворах от меньшей молярной концентрации к большей, не промывая электроды перед каждым измерением.
По градуировочной кривой находят содержание цитрат-ионов (моль·10-3) в 1 дм3 раствора анализируемой пробы.
5.6 Обработка и оформление результатов анализа
5.6.1 Массовую концентрацию цитрат-ионов в анализируемой пробе X1, г/дм3, вычисляют по формуле
X1=C3·F·M,
(2)
где C3 - молярная концентрация цитрат-ионов в растворе пробы, определенная по графику, моль/дм3;
F - фактор разведения анализируемой пробы, рассчитанный как отношение объема разведенной пробы (см. 5.4.11.2) к объему, взятому для разведения (см. 5.4.11.1);
М - молярная масса цитрат-иона; М = 189 г/моль.
5.6.1.1 Контроль точности результатов анализа
За окончательный результат анализа принимают среднеарифметическое значение двух параллельных определений X1cp, г/дм3, если выполняются условия приемлемости, представленные в таблице 1.
Таблица 1
|
Диапазон измерений массовой концентрации цитрат ионов и лимонной кислоты, г/дм3
|
Предел повторяемости r, % отн, при Р = 0, 95, n = 2
|
Предел воспроизводимости R, г/дм3 отн, при Р = 0, 95, m = 2
|
Границы относительной погрешности, ±δ, %, при Р = 0, 95
|
|
1·10-3 до 1·102
|
3
|
4, 5
|
3
|
5.6.2 Массовую концентрацию лимонной кислоты в пробе X2, г/дм3, вычисляют по формуле
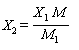
,
(3)
где X1 - массовая концентрация цитрат-ионов в пробе, г/дм3;
М - молярная масса цитрат-иона, М = 189 г/моль;
M1 - молярная масса лимонной кислоты, M1 = 192 г/моль.
5.6.2.1 Контроль точности результатов анализа
За окончательный результат анализа принимают среднеарифметическое значение двух параллельных определений X2cp, г/дм3, если выполняются условия приемлемости, представленные в таблице 1.
![]() — Все документы — ГОСТы — ГОСТ 32743-2014 ДОБАВКИ ПИЩЕВЫЕ. МЕТОД ПОТЕНЦИОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ ЛИМОННОЙ КИСЛОТЫ И ЦИТРАТ-ИОНОВ В КОМПЛЕКСНЫХ ПИЩЕВЫХ ДОБАВКАХ
— Все документы — ГОСТы — ГОСТ 32743-2014 ДОБАВКИ ПИЩЕВЫЕ. МЕТОД ПОТЕНЦИОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ ЛИМОННОЙ КИСЛОТЫ И ЦИТРАТ-ИОНОВ В КОМПЛЕКСНЫХ ПИЩЕВЫХ ДОБАВКАХ Годовая инфляция в сентябре замедлилась в России до 8,63 %
Годовая инфляция в сентябре замедлилась в России до 8,63 %
 Эксперт Бондарь предупредил о начислении пени за неуплату платежей за ЖКХ
Эксперт Бондарь предупредил о начислении пени за неуплату платежей за ЖКХ
 В ЦБ раскритиковали льготную ипотеку словами о завещании ипотечных долгов
В ЦБ раскритиковали льготную ипотеку словами о завещании ипотечных долгов
 «БелНовости»: избавиться от запаха канализации в доме удастся с помощью уксуса
«БелНовости»: избавиться от запаха канализации в доме удастся с помощью уксуса
 Зампред ЦБ Заботкин заявил о возможном снижении ключевой ставки в 2026 году
Зампред ЦБ Заботкин заявил о возможном снижении ключевой ставки в 2026 году
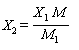 ,
,