![]() — Все документы — ГОСТы — ГОСТ Р 54904-2012 ПРОДУКТЫ ПИЩЕВЫЕ, ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ. МЕТОД ОПРЕДЕЛЕНИЯ ОСТАТОЧНОГО СОДЕРЖАНИЯ СУЛЬФАНИЛАМИДОВ, НИТРОИМИДАЗОЛОВ, ПЕНИЦИЛЛИНОВ, АМФЕНИКОЛОВ С ПОМОЩЬЮ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ С МАСС-СПЕКТРОМЕТРИЧЕСКИМ ДЕТЕКТОРОМ
— Все документы — ГОСТы — ГОСТ Р 54904-2012 ПРОДУКТЫ ПИЩЕВЫЕ, ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ. МЕТОД ОПРЕДЕЛЕНИЯ ОСТАТОЧНОГО СОДЕРЖАНИЯ СУЛЬФАНИЛАМИДОВ, НИТРОИМИДАЗОЛОВ, ПЕНИЦИЛЛИНОВ, АМФЕНИКОЛОВ С ПОМОЩЬЮ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ С МАСС-СПЕКТРОМЕТРИЧЕСКИМ ДЕТЕКТОРОМ
ГОСТ Р 54904-2012 ПРОДУКТЫ ПИЩЕВЫЕ, ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ. МЕТОД ОПРЕДЕЛЕНИЯ ОСТАТОЧНОГО СОДЕРЖАНИЯ СУЛЬФАНИЛАМИДОВ, НИТРОИМИДАЗОЛОВ, ПЕНИЦИЛЛИНОВ, АМФЕНИКОЛОВ С ПОМОЩЬЮ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ С МАСС-СПЕКТРОМЕТРИЧЕСКИМ ДЕТЕКТОРОМ
Добавил:
Дата: [04.08.2017]
ГОСТ Р 54904-2012 ПРОДУКТЫ ПИЩЕВЫЕ, ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ. МЕТОД ОПРЕДЕЛЕНИЯ ОСТАТОЧНОГО СОДЕРЖАНИЯ СУЛЬФАНИЛАМИДОВ, НИТРОИМИДАЗОЛОВ, ПЕНИЦИЛЛИНОВ, АМФЕНИКОЛОВ С ПОМОЩЬЮ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ С МАСС-СПЕКТРОМЕТРИЧЕСКИМ ДЕТЕКТОРОМ
Food products, food raw materials. Method for determination of sulfonamides, nitroimidazoles, penicillins, amphenicols by high performance liquid chromatography - mass spectrometry
Дата введения - 1 июля 2013 г.
Введен впервые
Предисловие
1 Разработан Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ")
2 Внесен Техническим комитетом по стандартизации ТК 335 "Методы испытаний агропромышленной продукции на безопасность"
3 Утвержден и введен в действие приказом Федерального агентства по техническому регулированию и метрологии от 17 мая 2012 г. N 71-ст
4 Введен впервые
1 Область применения
Настоящий стандарт распространяется на пищевые продукты в части молока, молочных продуктов, яиц, яичного порошка, мяса и мясных продуктов, мяса и продуктов из мяса птицы, меда, рыбы, морепродуктов, а также продовольственное сырье и устанавливает метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием для определения остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов.
Диапазон измерений для хлорамфеникола от 0,2 до 1000 мкг/кг, для остальных соединений - от 1,0 до 1000,0 мкг/кг.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 12.1.019-2009 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ Р 51447-99 (ИСО 3100-1-91) Мясо и мясные продукты. Методы отбора проб
ГОСТ Р 52121-2003 Яйца куриные пищевые. Технические условия
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ Р 53597-2009 Мясо птицы, субпродукты и полуфабрикаты из мяса птицы. Методы отбора проб и подготовка их к испытаниям
ГОСТ Р 53669-2009 Пищевые продукты переработки яиц сельскохозяйственной птицы. Методы отбора проб и органолептического анализа
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требований безопасности
ГОСТ 12.2.085-2002 Сосуды, работающие под давлением. Клапаны предохранительные. Требования безопасности
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 5848-73 Реактивы. Кислота муравьиная. Технические условия
ГОСТ 13867-68 Продукты химические. Обозначения чистоты
ГОСТ 19792-2001 Мед натуральный. Технические условия
ГОСТ 26809-86 Молоко и молочные продукты. Правила приемки, методы отбора и подготовка проб к анализу
ГОСТ 31339-2006 Рыба, нерыбные объекты и продукция из них. Правила приемки и методы отбора проб
ГОСТ 29245-91 Консервы молочные. Методы определения физических и органолептических показателей
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Сущность метода
3.1 Определение остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов проводят методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС/МС).
3.2 Количественное определение остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов проводят методом внутреннего стандарта по площади пика идентифицированных соединений при помощи градуировочной кривой.
3.3 Детектирование анализируемых проб проводят в режиме регистрации выбранных реакций.
4 Условия выполнения измерений
При выполнении измерений соблюдают следующие условия:
- температура окружающего воздуха ..................от 15°С до 30°С;
- атмосферное давление ................................(90±16) кПа;
- относительная влажность воздуха ....................от 20% до 80%.
Хроматографические измерения проводят в условиях, указанных инструкцией по эксплуатации соответствующего прибора.
5 Средства измерений, вспомогательное оборудование, посуда, материалы и реактивы
5.1 Для определения остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов применяют следующие средства измерений, вспомогательное оборудование и материалы:
- масс-спектрометр, диапазон измерений от 50 до 500 атомных единиц массы (а.е.м.), массовым разрешением не менее 500, точностью измерения массы не ниже 0,1 а.е.м., режимом получения и анализа фрагментных ионов (режим МС/МС);
- систему высокоэффективную жидкостную хроматографическую, состоящую из бинарного насоса со смесителем, термостата хроматографической колонки, обеспечивающего нагрев температуры до 50°С;
- компьютер с установленным программным обеспечением для управления масс-спектрометром и обработки результатов измерений;
- весы I класса точности по ГОСТ Р 53228 с действительной ценой деления шкалы не более 0,1 мг;
- пипетки одноканальные переменного объема 1 - 10, 10 - 100, 200 - 1000 мм3 с допустимой относительной погрешностью дозирования по гексану, метанолу и ацетонитрилу ±2% (Transferpettor Brand, Германия)*;
- модуль термостатируемый нагревательный с системой отдувки растворителей инертным газом и максимальной температурой термостатирования 50°С;
- измельчитель-гомогенизатор лабораторный;
- встряхиватель вибрационный для пробирок орбитального типа движения с амплитудой встряхивания 3 мм и диапазоном скоростей от 150 до 2500 об/мин;
- центрифугу лабораторную рефрижераторную со скоростью вращения ротора не менее 5000 об/с и диапазоном температур охлаждения от 4°С до 20°С, с адаптерами для пробирок вместимостью 15 см3 и микроцентрифужных пробирок вместимостью 1,5 см3;
- баню ультразвуковую с рабочей частотой не менее 20 кГц и объемом не менее 1 дм3;
- колонку хроматографическую обращенно-фазную длиной не менее 150 мм с размером диаметра частиц сорбента не более 3,5 мкм;
- устройство вакуумное для твердофазной экстракции;
- картриджи для твердофазной экстракции объемом не менее 12 см3, заполненные обращенно-фазным сорбентом с размером диаметра частиц не более 50 мкм;
- пробирки полипропиленовые вместимостью 15 см3 с герметично закрывающимися пластмассовыми крышками;
- фильтры мембранные с размером диаметра пор не более 0,2 мкм;
- виалы (флаконы) стеклянные вместимостью 2 см3 с завинчивающимися крышками и тефлоновыми прокладками диаметром 9 мм;
- пробирки мерные стеклянные П-2-10-14/23 по ГОСТ 1770;
- колбы мерные стеклянные 2-100-2, 2-1000-2 по ГОСТ 1770.
5.2 При определении остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов применяют следующие реактивы:
- метанол, х.ч.;
- н-Гексан, х.ч.;
- кислоту муравьиную по ГОСТ 5848, ч.д.а.;
- ацетонитрил, ч.д.а.;
- воду деионизованную.
Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч.д.а.) по ГОСТ 13867.
5.3 При определении остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов применяют:
5.3.1 Стандартные образцы сульфаниламидов:
- сульфахлорпиридазин с содержанием основного вещества не менее 99,0% (HPLC, Sigma)**;
- сульфатиазол с содержанием основного вещества не менее 99,0% (HPLC, Sigma)**;
- сульфадиметоксин с содержанием основного вещества не менее 99,0% (HPLC, Sigma)**;
- сульфахиноксалина натриевая соль с содержанием основного вещества не менее 95,0% (HPLC, Sigma)**;
- сульфапиридин с содержанием основного вещества 99% (HPLC, Sigma)**;
- сульфаметазин с содержанием основного вещества не менее 99,5% (HPLC, Sigma)**;
- сульфамеразин с содержанием основного вещества не менее 99,9% (HPLC, Sigma)**;
- сульфадиазина натриевая соль с содержанием основного вещества не менее 99,0% (HPLC, Sigma)**;
- триметоприм с содержанием основного вещества не менее 99,1%(HPLC, Fluka)**;
- сульфамоксол с содержанием основного вещества не менее 99,1% (HPLC, Sigma)**;
- сульфаэтоксипиридазин с содержанием основного вещества не менее 99,5%, (Fluka)**;
- сульфаметоксазол с содержанием основного вещества не менее 99,9% (HPLC, Sigma)**;
- сульфагуанидин моногидрат с содержанием основного вещества не менее 99,8% (HPLC, Sigma)**;
- сульфаметоксипиридазин с содержанием основного вещества не менее 99,2% (HPLC, Sigma)**;
- сульфаниламид с содержанием основного вещества не менее 99,9% (HPLC, Sigma)**.
5.3.2 Стандартные образцы нитроимидазолов:
- ронидазол с содержанием основного вещества не менее 99,9% (HPLC, Witega)**;
- диметридазол с содержанием основного вещества не менее 99,9% (HPLC, Witega)**;
- метронидазол с содержанием основного вещества не менее 99,5% (HPLC, Witega)**;
- гидроксиметронидазол с содержанием основного вещества не менее 99,5% (HPLC, Witega)**;
- ипронидазол с содержанием основного вещества не менее 99,0% (HPLC, Witega)**;
- гидроксиипронидазол с содержанием основного вещества не менее 99,0% (HPLC, Witega)**;
- гидроксиметилметронидазол с содержанием основного вещества не менее 99,0% (HPLC, Witega)**;
- тинидазол с содержанием основного вещества не менее 99,0% (HPLC, Sigma)**;
- тернидазол с содержанием основного вещества не менее 99,0% (HPLC, Witega)**.
5.3.3 Стандартные образцы пенициллинов:
- оксацилин с содержанием основного вещества не менее 99,3% (HPLC, Riedel-de Haen)**;
- амоксициллина тригидрат с содержанием основного вещества не менее 98,7% (HPLC, Riedel-de Haen)**;
- клоксациллина натриевая соль с содержанием основного вещества не менее 98,1% (HPLC, Riedel-de Haen)**;
- диклоксациллина натриевая соль с содержанием основного вещества не менее 98,5% (HPLC, Riedel-de Haen)**;
- ампициллина тригидрат с содержанием основного вещества не менее 99,8% (HPLC, Riedel-de Haen)**;
- бензилпенициллин с содержанием основного вещества не менее 99,7% (HPLC, Riedel-de Haen)**;
- феноксиметилпенициллин с содержанием основного вещества не менее 99,7% (HPLC, Riedel-de Haen)**.
5.3.4 Стандартные образцы амфениколов:
- хлорамфеникол с содержанием основного вещества не менее 99,1% (HPLC, Sigma)**;
- флорфеникол амин с содержанием основного вещества не менее 99,3% (KRKA)**;
- флорфеникол с содержанием основного вещества не менее 99,37% (HPLC, Laboratories HIPRA)**.
5.3.5 Внутренние стандарты сульфаниламидов:
- сульфатиазол-Д4 с содержанием основного вещества 99% (Isotopic purity, TRC)**;
- сульфадиметоксин- Д4 с содержанием основного вещества 99% (Isotopic purity, TRC)**;
- сульфаметазин- Д4 с содержанием основного вещества 99% (Isotopic purity, TRC)**;
- сульфадиазин- Д4 с содержанием основного вещества 99% (Isotopic purity, TRC)**;
- триметоприм- Д9 с содержанием основного вещества 99% (Isotopic purity, TRC)**;
- сульфаметоксазол- Д4 с содержанием основного вещества 99% (Isotopic purity, TRC)**.
5.3.6 Внутренние стандарты нитроимидазолов:
- ронидазол- Д3 с содержанием основного вещества 99,8% (HPLC, Witega)**;
- диметридазол- Д3 с содержанием основного вещества 99,5% (HPLC, Witega)**;
- метронидазол- Д3 с содержанием основного вещества 99,0% (HPLC, Witega)**;
- гидроксиметронидазол- D3 с содержанием основного вещества 99,5% (HPLC, Witega)**;
- ипронидазол- Д3 с содержанием основного вещества 99,0% (HPLC, Witega)**;
- гидроксиипронидазол- Д3 с содержанием основного вещества 99,5% (HPLC, Witega)**.
5.3.7 Внутренний стандарт пенициллинов:
- бензилпенициллин- Д7 с содержанием основного вещества не менее 99,7% (HPLC, Witega)**.
5.3.8 Внутренний стандарт амфениколов:
- хлорамфеникол- Д5 с содержанием основного вещества 99% (Fluka)**.
5.4 Допускается применение других средств измерений, вспомогательного оборудования, не уступающих вышеуказанным по метрологическим и техническим характеристикам и обеспечивающим необходимую точность измерения, а также реактивов и материалов по качеству не хуже вышеуказанных.
6 Подготовка к проведению измерений
6.1 Подготовка лабораторной посуды и реактивов
6.1.1 Мойку и сушку посуды проводят в отдельном помещении, оборудованном приточно-вытяжной вентиляцией. Не допускается проведение подготовки посуды в данном помещении для других анализов. Для сушки лабораторной посуды и подготовки реактивов необходимо использовать отдельные сушильные шкафы.
6.1.2 Стеклянную посуду подвергают стандартной процедуре очистки лабораторной посуды с последующей промывкой органическим растворителем ацетоном (дважды).
6.1.3 Процедуру промывки ацетоном следует проводить в вытяжном шкафу. Рекомендуется на стадиях промывки использовать ультразвуковую баню. Окончательную сушку посуды проводят в сушильном шкафу, установленном в вытяжном шкафу, при температуре от 105°С до 110°С.
6.1.4 Каждую новую партию реактивов проверяют на отсутствие контаминации анализируемыми соединениями путем проведения холостого опыта в соответствии с процедурой анализа.
6.2 Приготовление растворов
6.2.1 Приготовление растворов элюентов
6.2.1.1 Для приготовления раствора элюента мобильной фазы А в мерную колбу вместимостью 1000 см3 вносят 1000 см3 деионизированной воды.
Срок хранения раствора при 4°С - не более 1 мес.
6.2.1.2 Для приготовления раствора элюента мобильной фазы Б в мерную колбу вместимостью 1000 см3 вносят 1000 см3 метанола.
Срок хранения раствора при 4°С - не более 1 мес.
6.2.3 Приготовление раствора метанола
Для приготовления раствора метанола в мерной колбе вместимостью 1000 см3 смешивают 500 см3 деионизированной воды и 500 см3 метанола. Колбу помещают на ультразвуковую баню на 5 мин.
Срок хранения раствора при температуре от 0°С до 8 °С - не более 3 мес.
6.2.4 Приготовление градуировочных растворов
6.2.4.1 Приготовление градуировочных растворов C0
Для приготовления градуировочных растворов на аналитических лабораторных весах с пределом абсолютной допускаемой погрешности ±0,01 мг взвешивают по 2 мг каждого стандартного образца и переносят в отдельные мерные пробирки вместимостью 15 см3. Добавляют 8 см3 метанола, помещают в ультразвуковую баню на одну мин, доводят полученный раствор до метки 10 см3 раствором метанола (см. 6.2.3).
Массовая концентрация каждого аналита в растворе C0 составляет 200 мкг/см3.
Срок хранения растворов при температуре от 0°С до 8°С - не более 3 мес.
6.2.4.2 Приготовление градуировочных растворов C1
Для приготовления градуировочных растворов C1 переносят по 0,05 см3 каждого раствора C0 в мерные пробирки вместимостью 15 см3, доводят до метки метанолом и тщательно перемешивают.
Массовая концентрация каждого аналита в растворе C1 составляет 1 мкг/см3.
Срок хранения растворов при температуре от 0°С до 8°С - не более 3 мес.
6.2.4.3 Приготовление градуировочных растворов D0 (внутренних стандартов анализируемых соединений)
Для приготовления градуировочных растворов D0 на аналитических весах с пределом абсолютной допускаемой погрешности ±0,01 мг взвешивают по 2 мг чистого вещества стандартного образца и переносят в отдельные мерные пробирки вместимостью 15 см3. Добавляют 8 см3 метанола (пенициллин G- D7 растворяют в 8 см3 деионизированной воды), перемешивают и помещают в ультразвуковую баню на одну мин, доводят полученный раствор до метки 10 см3 метанолом.
Массовая концентрация каждого аналита в растворе D0 составляет 200 мкг/см3.
Срок хранения растворов при температуре от 0°С до 8°С - не более 3 мес.
6.2.4.4 Приготовление градуировочных растворов D1 (внутренних стандартов анализируемых соединений)
Для приготовления градуировочных растворов D1 переносят по 0,02 см3 каждого раствора D0 в мерные пробирки вместимостью 15 см3, доводят до метки 10 см3 деионизированной водой и перемешивают.
Массовая концентрация каждого аналита в растворе D1 составляет 400 нг/см3.
Срок хранения растворов при температуре от 0°С до 8°С - не более 3 мес.
6.2.4.5 Приготовление градуировочных растворов C2
Для приготовления градуировочного раствора C2 к сухому остатку после упаривания "чистой" пробы, полученной в соответствии с условиями подготовки проб (раздел 7), переносят по 0,1 см3 растворов C1 и D1 и доводят до метки 1 см3 деионизированной водой.
Массовая концентрация аналита в растворе C2 составляет 100 нг/см3. Массовая концентрация внутреннего стандарта в растворе C2 составляет 40 нг/см3.
Срок хранения растворов при температуре от 0°С до 8°С - не более 3 мес.
6.2.4.6 Приготовление градуировочных растворов C3
Для приготовления градуировочного раствора C3 к сухому остатку после упаривания "чистой" пробы, полученной в соответствии с условиями подготовки проб (раздел 7), переносят 0,01 см3 раствора C1 и 0,1 см3 раствора D1 и доводят до метки 1 см3 деионизированной водой.
Массовая концентрация аналита в растворе C3 составляет 10 нг/см3. Массовая концентрация внутреннего стандарта в растворе C3 составляет 40 нг/см3.
Срок хранения растворов при температуре от 0°С до 8°С - не более 3 мес.
6.2.4.7 Приготовление градуировочных растворов C4
Для приготовления градуировочного раствора C4 к сухому остатку после упаривания "чистой" пробы, полученной в соответствии с условиями подготовки проб (раздел 7), переносят 0,001 см3 раствора C1 и 0,1 см3 раствора D1 и доводят до метки 1 см3 деионизированной водой.
Массовая концентрация аналита в растворе C4 составляет 1 нг/см3. Массовая концентрация внутреннего стандарта в растворе C4 составляет 40 нг/см3.
Срок хранения растворов при температуре от 0°С до 8°С - не более 3 мес.
6.3 Построение градуировочной характеристики
6.3.1 Градуировочную характеристику строят при помощи матричной градуировки. Для этого проводят обработку "чистых" проб, не содержащих сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов, в зависимости от типа анализируемой матрицы. На стадии перерастворения остатка после упаривания элюата после твердофазной экстракции перед введением в хроматограф в анализируемую "чистую" пробу добавляют смеси градуировочных растворов анализируемых соединений и их внутренних стандартов (см. 6.2.4.5 - 6.2.4.7).
6.3.2 Для получения градуировочных данных используют не менее четырех уровней массовых концентраций матричных градуировочных растворов. Определяемые в анализируемой пробе массовые концентрации анализируемых соединений должны находиться в диапазоне массовых концентраций градуировочной характеристики.
6.3.3 При построении градуировочной характеристики для количественного определения остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов в инжектор хроматографа вводят по 50 мм3 и не менее двух раз градуировочные растворы (см. 6.2.4.5 - 6.2.4.7) различных уровней массовых концентраций. Фактические массовые концентрации рассчитываются с учетом чистоты стандарта и молекулярного веса соединения в диссоциированном состоянии. Используя программное обеспечение для сбора и обработки хроматографических данных, для анализируемых соединений устанавливают градуировочные характеристики в виде зависимостей отношения площадей хроматографических пиков соответствующего соединения к площади пика внутреннего стандарта от массовой концентрации соединения в пробе в соответствии с таблицей 1.
При построении градуировочной характеристики используют функцию, обеспечивающую наилучшее совпадение с матричными точками (отклонение массовых концентраций, вычисленных при помощи градуировочной характеристики, от известных массовых концентраций должно быть минимальным).
Градуировочная характеристика считается приемлемой, если рассчитанное значение квадрата коэффициента корреляции для градуировочной характеристики каждого фрагментного иона составит не менее 0,98.
6.3.4 Вычисление площади пика проводят для каждого дочернего иона анализируемых соединений. Допускается проведение количественных измерений по одному наиболее интенсивному дочернему иону. Для подтверждения наличия сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов рассчитывают массовые концентрации по площадям пиков менее интенсивных дочерних ионов.
Таблица 1 - Соответствие между анализируемыми соединениями и внутренними стандартами
|
Наименование сульфаниламида, нитроимидазола, пенициллина, амфеникола |
Наименование внутреннего стандарта |
|
Нитроимидазолы | |
|
Диметридазол |
Диметридазол- Д3 |
|
Ронидазол |
Ронидазол- Д3 |
|
Ипронидазол |
Ипронидазол- Д3 |
|
Гидроксиипронидазол |
Гидроксиипронидазол- Д3 |
|
Метронидазол |
Метронидазол- Д3 |
|
Гидроксиметронидазол |
Метронидазол- Д3 |
|
Гидроксиметилметронидазоп |
Гидроксиметипметронидазол- Д3 |
|
Тернидазол |
Ронидазол- Д3 |
|
Тинидазол |
Ронидазол- Д3 |
|
Амфениколы | |
|
Хлорамфеникол |
Хлорамфеникол- Д5 |
|
Флорфеникол |
Хлорамфеникол- Д5 |
|
Флорфеникол амин |
Хлорамфеникол- Д5 |
|
Сульфаниламиды | |
|
Сульфапиридин |
Сульфадиазин- Д4 |
|
Сульфадиазин |
Сульфадиазин- Д4 |
|
Сульфатиазол |
Сульфатиазол- Д4 |
|
Сульфамеразин |
Сульфадиазин- Д4 |
|
Сульфаметазин |
Сульфаметазин- Д4 |
|
Сульфахлорпиридазин |
Сульфаметазин- Д4 |
|
Сульфахиноксалин |
Сульфадиазин- Д4 |
|
Сульфаэтоксипиридазин |
Сульфаметаксазол- Д4 |
|
Сульфагуанидин |
Сульфадиазин- Д4 |
|
Сульфаметаксазол |
Сульфаметаксазол- Д4 |
|
Сульфаметоксипиридазин |
Сульфаметаксазол- Д4 |
|
Сульфамоксол |
Сульфаметаксазол- Д4 |
|
Сульфаниламид |
Сульфаметазин- Д4 |
|
Сульфадиметоксин |
Сульфадиметоксин- Д4 |
|
Триметоприм |
Триметоприм- Д9 |
|
Пенициллины | |
|
Бензилпенициллин |
Бензилпенициллин- Д7 |
|
Феноксиметилпенициллин |
Бензилпенициллин- Д7 |
|
Ампициллин |
Бензилпенициллин- Д7 |
|
Оксациллин |
Бензилпенициллин- Д7 |
|
Амоксициллин |
Бензилпенициллин- Д7 |
|
Диклоксациллин |
Бензилпенициллин- Д7 |
|
Клоксациллин |
Бензилпенициллин- Д7 |
6.4 Условия хроматографических измерений
6.4.1 Хромато-масс-спектрометр включают и настраивают в соответствии с техническим руководством по его эксплуатации и устанавливают следующие хроматографические параметры:
- скорость потока элюента - 200 мм3/мин;
- объем вводимой пробы - 50 мм3.
Разделение проводят в режиме градиентного элюирования. При регистрации положительных ионов: в начальный момент по 0,5 мин - соотношение фазы А/Б по объему (90/10); с 0,5 по 20,0 мин - градиентное элюирование к 40% фазы Б; с 20,0 по 23,0 мин - соотношение фазы А/Б по объему (60/40); с 23,0 по 23,2 мин - переход к 100% фазы Б; с 23,2 по 25,0 мин - поддерживается 100% фазы Б; с 25,0 по 33,0 мин - уравновешивание колонки в фазе А/Б по объему (90/10).
При регистрации отрицательных ионов: в начальный момент до 0,5 мин соотношение фаз А/Б по объему (75/25); с 0,5 по 4,0 мин - градиентное элюирование до 100% фазы Б; с 4,0 по 6,5 мин поддерживается 100% фазы Б; с 6,5 по 13 мин - уравновешивание колонки растворителем А/Б по объему (75/25).
Детектирование пиков проводят методом "регистрации выбранных реакций" (MRM). Для каждого соединения измеряют сигнал для двух ионов согласно таблице 2.
Таблица 2 - Параметры воздействия на ионы в режиме MRM и условиях электроспрея с регистрацией положительных или отрицательных ионов
|
Наименование сульфаниламида, нитроимидазола, пенициллина, амфеникола |
Ион предшественник, m/z |
Дочерние ионы, m/z |
Время удерживания, мин |
|
Нитроимидазолы | |||
|
Диметридазол |
142,1 (+) |
81,1/96,1 |
9,5 |
|
Диметридазол- Д3* |
145,1 (+) |
99,1 |
9,3 |
|
Ронидазол- Д3* |
204,1 (+) |
143,1 |
6,5 |
|
Ронидазол |
201,1 (+) |
140,1/110,1 |
6,9 |
|
Ипронидазол |
170,1 (+) |
124,1/109,1 |
19,6 |
|
Ипронидазол- Д3* |
173,1 (+) |
127,1 |
19,4 |
|
Гидроксиипронидазол |
186,1 (+) |
168,1/122,1 |
15,6 |
|
Гидроксиипронидазол- Д3* |
189,1 (+) |
171,1 |
15,3 |
|
Метронидазол |
172,1 (+) |
128,1/82,1 |
7,3 |
|
Гидроксиметронидазол |
188,1 (+) |
123,1/126,1 |
4,6 |
|
Метронидазол- Д3* |
175,1 (+) |
131,1 |
7,0 |
|
Гидроксиметилметронидазол |
158,1 (+) |
140,1/55 |
5,8 |
|
Гидроксиметилметронидазол- Д3* |
161,1 (+) |
143,1 |
5,5 |
|
Тернидазол |
186,1 (+) |
128,1/82,1 |
11,3 |
|
Тинидазол |
248,1 (+) |
121,1/93,0 |
10,5 |
|
Амфениколы | |||
|
Хлорамфеникол |
321,0 (-) |
152,0/257,0/194,0 |
7,7 |
|
Хлорамфеникол- Д5* |
326,1 (-) |
157,0 |
7,7 |
|
Хлорамфеникол- Д5* |
328,1 (+) |
280,1 |
20,5 |
|
Флорфеникол |
356,1 (-) |
185,1/119,1 |
6,7 |
|
Флорфеникол амин |
248,1 (-) |
230,1/130,1 |
1,7 |
|
Сульфаниламиды | |||
|
Сульфапиридин |
250,1 (+) |
184,1/156,1 |
10 |
|
Сульфадиазин |
251,1 (+) |
156,1/108,1 |
7,1 |
|
Сульфадиазин- Д4* |
255,1 (+) |
160,1 |
6,7 |
|
Сульфатиазол |
256,1 (+) |
156,1/108,1 |
9,0 |
|
Сульфатиазол- Д4* |
260,1 (+) |
160,1 |
8,7 |
|
Сульфамеразин |
265,1 (+) |
156,1/110,1 |
10,9 |
|
Сульфаметазин |
279,1 (+) |
186,1/124,1 |
14,2 |
|
Сульфаметазин- Д4* |
283,1 (+) |
186,1 |
13,9 |
|
Сульфахлорпиридазин |
285,1 (+) 287,1 (+) |
156,1 156,1 |
15,8 |
|
Сульфахиноксалин |
301,1 (+) |
156,1/146,1 |
24,3 |
|
Сульфаэтоксипоридазин |
295,1 (+) |
156,1/140,1 |
20,8 |
|
Сульфагуанидин |
215,1 (+) |
156,1/60,1 |
2,8 |
|
Сульфаметаксазол |
254,1 (+) |
156,1/108,1 |
16,3 |
|
Сульфаметаксазол- Д4* |
258,1 (+) |
160,1 |
16,0 |
|
Сульфаметоксипиридазин |
281,1 (+) |
156,1/108,1 |
14,9 |
|
Сульфамоксол |
268,1 (+) |
156,1/113,1 |
13,6 |
|
Сульфаниламид |
173,1 (+) |
156,1/92,1 |
3,0 |
|
Сульфадиметоксин |
311,1 (+) |
156,1/245,1 |
23,2 |
|
Сульфадиметоксин- Д4* |
315,1 (+) |
160,1 |
23,0 |
|
Триметоприм |
291,1 (+) |
230,1/130,1 |
7,2 |
|
Триметоприм- Д9* |
300,1 (+) |
230,1 |
6,7 |
|
Пенициллины | |||
|
Бензилпенициллин |
333,0 (-) |
289,0/192,0 |
8,2 |
|
Бензилпенициллин- Д7* |
340,0 (-) |
199,0 |
8,5 |
|
Бензилпенициллин- Д7* |
342,1 (+) |
183,1 |
27,0 |
|
Феноксиметилпенициллин |
349,0 (-) |
208,0/305,0 |
8,3 |
|
Ампициллин |
350,1 (+) |
192,1/106,1 |
13,6 |
|
Оксациллин |
400,1 (-) |
259,0/356,1 |
8,3 |
|
Амоксициллин |
366,1 (+) |
114,1/208,0 |
3,4 |
|
Диклоксациллин |
468,0 (-) |
424,1/327,0 |
8,5 |
|
Клоксациллин |
434,1 (-) |
390,1/290,1 |
8,4 |
|
* Внутренний стандарт. | |||
7 Отбор и подготовка проб
7.1 Отбор проб
7.1.1 Отбор проб мяса и мясных продуктов - по ГОСТ Р 51447.
7.1.2 Отбор проб мяса птицы, пищевых субпродуктов и полуфабрикатов из мяса птицы - по ГОСТ Р 53597.
7.1.3 Отбор проб молока и молочных продуктов - по ГОСТ 26809.
7.1.4 Отбор проб меда -по ГОСТ 19792.
7.1.5 Отбор проб яиц и яичного порошка - по ГОСТ Р 52121 и ГОСТ Р 53669.
7.1.6 Отбор проб рыбы и морепродуктов - по ГОСТ 31339.
7.2 Подготовка проб
7.2.1 Обработка проб мяса, мясных продуктов, рыбы и морепродуктов, субпродуктов и полуфабрикатов из мяса птицы
Мышечную ткань предварительно очищают от грубой соединительной ткани и грубого хитинового покрова. 100 г анализируемой пробы измельчают на гомогенизаторе и взвешивают на весах (с пределом абсолютной допускаемой погрешности однократного взвешивания ±1,0 мг) в полипропиленовой пробирке вместимостью 50 см3 1,0 г гомогенизированной пробы. Пипеточным дозатором в пробирку вносят 0,05 см3 раствора D1 (6.2.4.4). Пробирку помещают в шейкер для перемешивания на 10 мин. Через 15 мин приливают 4 см3 ацетонитрила и помещают пробирку на 15 мин в шейкер для экстракции. Затем центрифугируют при 4000 об/мин в течение 15 мин при температуре 4°С. После центрифугирования верхний органический слой переливают в другую полипропиленовую пробирку вместимостью 15 см3, помещают на нагревательный модуль и упаривают в токе воздуха при температуре 40°С до 0,1 - 0,2 см3. К полученному остатку приливают 2 см3 деионизованной воды, перемешивают и центрифугируют со скоростью 4000 об/мин в течение 15 минут при температуре 4°С. Центрифугат используют для твердофазной экстракции.
7.2.2 Обработка проб яиц
Яйца отделяют от скорлупы и перемешивают на гомогенизаторе. Взвешивают на весах (с пределом абсолютной допускаемой погрешности однократного взвешивания ±1,0 мг) 1,0 г гомогенизированной пробы в полипропиленовой пробирке вместимостью 15 см3. Пипеточным дозатором в пробирку вносят 0,05 см3 раствора внутренних стандартов D1 (6.2.4.4). Далее обработку проб и подготовку к хроматографированию проводят по 7.2.1.
7.2.3 Обработка проб яичного порошка
1,0 г отобранной пробы яичного порошка тщательно перемешивают и взвешивают на весах (с пределом абсолютной допускаемой погрешности однократного взвешивания ±1,0 мг) в полипропиленовой пробирке вместимостью 15 см3. Пипеточным дозатором в пробирку вносят 0,05 см3 раствора внутренних стандартов D1 (6.2.4.4). и выдерживают 15 мин. Затем приливают 4 см3 ацетонитрила и помещают пробирку в шейкер на 15 мин для перемешивания. Затем центрифугируют при 4000 об/мин в течение 15 мин при температуре 4°С. После центрифугирования верхний органический слой переливают в другую полипропиленовую пробирку вместимостью 15 см3, помещают на нагревательный модуль и упаривают в токе воздуха при температуре 40°С до 0,1 - 0,2 см3. К полученному остатку приливают 2 см3 деионизованной воды, перемешивают и центрифугируют со скоростью 4000 об/мин в течение 15 минут при температуре 4°С. Центрифугат используют для твердофазной экстракции.
7.2.4 Обработка проб молока и молочных продуктов
Молоко, сливки, сметану, кисломолочные напитки и продукты, сухие молочные продукты перед анализом тщательно перемешивают.
10 г сыра, творога или творожных изделий взвешивают на часовом стекле или в чашке Петри, переносят в ступку и тщательно растирают.
Далее обработку проб и подготовку к хроматографированию проводят по 7.2.3.
100 г твердого сыра измельчают на гомогенизаторе и взвешивают на весах (с пределом абсолютной допускаемой погрешности однократного взвешивания ±1,0 мг) в полипропиленовой пробирке вместимостью 50 см3 по 1,0 г гомогенизированной пробы. Далее обработку проб и подготовку к хроматографированию проводят по 7.2.1.
Сухие молочные продукты восстанавливают по ГОСТ 29245 (пункт 3.4).
7.2.5 Обработка проб меда
1,0 г отобранной пробы меда тщательно перемешивают и взвешивают на весах (с пределом абсолютной допускаемой погрешности однократного взвешивания ±0,01 мг) в полипропиленовой пробирке вместимостью 15 см3. Далее обработку проб и подготовку к хроматографированию проводят по 7.2.3.
7.3 Очистка подготовленных проб методом твердофазной экстракции
Картриджи для твердофазной экстракции кондиционируют на вакуумном устройстве для твердофазной экстракции, пропуская последовательно: 2 см3 ацетонитрила и 2 см3 деионизированной воды. Затем через картридж пропускают анализируемую пробу, полученную в соответствии с 7.2 (на всех этапах твердофазной экстракции, кроме этапов сушки, вакуум или избыточное давление не применяют). Промывают картридж 2 см3 деионизированной воды, затем сушат картридж 10 мин. Далее элюируют аналиты 2 см3 ацетонитрила. Элюат упаривают на нагревательном модуле в токе воздуха до 0,1 см3 при температуре 40°С.
7.4 Перерастворение и подготовка к хроматографированию
Для перерастворения и подготовки к хроматографированию объем полученного упаренного элюата в мерной пробирке вместимостью 10 см3 доводят до 1 см3 деионизованной водой и помещают на ультразвуковую баню на одну минуту. Полученный экстракт фильтруют через мембранный фильтр и используют для ВЭЖХ-МС/МС анализа.
8 Порядок выполнения измерений
8.1 ВЭЖХ/МС/МС анализ
Для определения остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов проводят ВЭЖХ-МС/МС анализ в условиях, указанных в 6.4.
ВЭЖХ-МС/МС анализ выполняют в виде серии измерений, включающей:
- образец мобильной фазы А;
- образец, полученный в условиях подготовки проб, где вместо матрицы использовался 1,0 г деионизованной воды;
- образец, приготовленный ранее в соответствии с требованиями раздела 7, в зависимости от типа анализируемой матрицы;
- градуировочные растворы;
- анализируемые пробы;
- образцы с известным содержанием анализов для контроля стабильности градуировки.
Если остаточное содержание сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов в анализируемой пробе превышает значение максимального градуировочного уровня, то анализируемую пробу разводят в 10 или более раз мобильной фазой А и проводят повторные измерения.
8.2 Контроль качества измерений
8.2.1 Каждая серия измерений включает в себя несколько степеней подтверждения качества измерений.
8.2.2 10 мм3 градуировочного раствора C4 (см. 6.2.4.7) вводят в инжектор хроматографа. Полученное соотношение сигнал/шум для каждого аналита должно быть не менее 10.
8.2.3 Для исключения контаминации пробы используемыми реагентами проводят обработку заведомо чистого образца в соответствии с разделом 7 в зависимости от типа анализируемой матрицы.
8.2.4 Для учета матричного эффекта при расчете остаточных содержаний нитроимидазолов, сульфаниламидов, пенициллинов и амфениколов используют матричную градуировку (см. 6.3).
8.2.5 Для исключения возможной контаминации реагентов, используемых в процессе подготовки проб, анализируемую пробу ткани заменяют 1,0 см3 деионизованной воды.
9 Обработка результатов измерений
9.1 Расчеты остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов и площади пика выполняются системой обработки данных в автоматическом режиме.
9.2 Вычисление площади пика проводят для двух дочерних ионов (таблица 2) для каждого сульфаниламида, нитроимидазола, пенициллина, амфеникола. Отклонения относительных ионных интенсивностей ионов в анализируемой пробе от относительных ионных интенсивностей ионов, полученных при анализе градуировочных растворов, не должны превышать значений, указанных в таблице 3.
Таблица 3 - Допустимые отклонения относительных ионных интенсивностей
|
Относительная ионная интенсивность (% от основного пика) |
Максимально допустимые отклонения для ВЭЖХ-МС/МС детектирования,% |
|
Св. 50 |
±20 |
|
" 20 до 50 |
±25 |
|
" 10 " 20 |
±30 |
|
Менее или равно 10 |
±50 |
9.3 Результаты измерений округляют до второго десятичного знака и выражают в мкг/кг.
9.4 За результат измерений принимают среднеарифметическое значение результатов двух параллельных определений, если выполняется условие приемлемости:
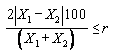 ,
,(1)
где X1, X2 - результаты двух параллельных определений массовой доли аналитов, мкг/кг;
r - значение предела повторяемости, % (r = 10%).
9.5 Если условие (1) не выполняется, проводят еще два определения. За результат измерений принимают среднеарифметическое значение результатов четырех определений, если выполняется условие
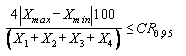 ,
,(2)
где Xmax, Xmin - максимальное и минимальное значения из полученных четырех результатов параллельных определений массовой доли аналитов, мкг/кг;
CR0,95 - значение критического диапазона для уровня вероятности Р = 0,95 и n - результатов определений
CR0,95=f(n)σr,
(3)
для n = 4
CR0,95=3,6σr,
(4)
где σr - показатель повторяемости, % (σr = 3,6%).
9.6 Если условие (2) не выполняется, выясняют причины превышения критического диапазона, устраняют их и повторяют измерения в соответствии с требованиями настоящего стандарта.
10 Метрологические характеристики
Установленный в настоящем стандарте метод обеспечивает выполнение измерений остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов с расширенной неопределенностью результатов аналитических измерений при коэффициенте охвата k = 2, указанной в таблицах 4 и 5.
Примечание - Значения относительной расширенной неопределенности, указанные в таблице 4, соответствуют границам относительной погрешности результатов измерений при Р = 0,95.
Таблица 4 - Значения расширенной относительной неопределенности Vi, %, при коэффициенте охвата k = 2 в диапазонах измерений остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов
|
Наименование сульфаниламида, нитроимидазола, пенициллина, амфеникола |
Диапазон измерений остаточного содержания, мкг/кг | ||
|
От 1,0 до 10 включ. |
Св. 10 до 100 включ. |
Св. 100 до 1000 включ. | |
|
Нитроимидазолы | |||
|
Диметридазол |
64 |
35 |
26 |
|
Ронидазол |
59 |
33 |
22 |
|
Ипронидазол |
67 |
28 |
19 |
|
Гидроксиипронидазол |
58 |
27 |
23 |
|
Метронидазол |
65 |
27 |
19 |
|
Гидроксиметронидазол |
58 |
31 |
28 |
|
Гидроксиметилметронидазол |
64 |
36 |
25 |
|
Тернидазол |
71 |
31 |
26 |
|
Тинидазол |
73 |
28 |
23 |
|
Амфениколы | |||
|
Флорфеникол |
65 |
29 |
23 |
|
Флорфеникол амин |
58 |
35 |
27 |
|
Сульфаниламиды | |||
|
Сульфапиридин |
64 |
34 |
25 |
|
Сульфадиазин |
60 |
40 |
25 |
|
Сульфатиазол |
65 |
38 |
20 |
|
Сульфамеразин |
58 |
46 |
19 |
|
Сульфаметазин |
60 |
47 |
20 |
|
Сульфахлорпиридазин |
65 |
39 |
18 |
|
Сульфахиноксалин |
47 |
35 |
17 |
|
Сульфаэтоксипоридазин |
55 |
37 |
16 |
|
Сульфагуанидин |
98 |
35 |
31 |
|
Сульфаметаксазол |
68 |
34 |
19 |
|
Сульфаметоксипиридазин |
54 |
46 |
26 |
|
Сульфамоксол |
65 |
36 |
21 |
|
Сульфаниламид |
58 |
46 |
26 |
|
Сульфадиметоксин |
67 |
43 |
32 |
|
Триметоприм |
64 |
38 |
27 |
|
Пенициллины | |||
|
Бензилпенициллин |
74 |
46 |
28 |
|
Феноксиметил пенициллин |
76 |
42 |
25 |
|
Ампициллин |
72 |
41 |
20 |
|
Оксациллин |
76 |
37 |
19 |
|
Амоксициллин |
79 |
45 |
18 |
|
Диклоксациллин |
73 |
41 |
17 |
|
Клоксациллин |
68 |
38 |
19 |
Таблица 5 - Значения расширенной относительной неопределенности Vi, %, при коэффициенте охвата k = 2 в диапазонах измерений остаточного содержания хлорамфеникола, мкг/кг
|
Наименование амфеникола |
Диапазон измерений остаточного содержания, мкг/кг | |||
|
От 0,2 до 1,0 |
Св. 1 до 10 включ. |
Св. 10 до 100 включ. |
Св. 100 до 1000 включ. | |
|
Хлорамфеникол |
93 |
81 |
31 |
24 |
11 Оформление результатов измерений
Содержание i-го сульфаниламида, нитроимидазола, пенициллина, амфеникола, мкг/кг, представляют в виде
(5)
где ![]() - среднеарифметическое значение результатов n параллельных измерений содержания i-го сульфаниламида, нитроимидазола, пенициллина, амфеникола в анализируемой пробе, мкг/кг;
- среднеарифметическое значение результатов n параллельных измерений содержания i-го сульфаниламида, нитроимидазола, пенициллина, амфеникола в анализируемой пробе, мкг/кг;
±Vi - расширенная относительная неопределенность при коэффициенте охвата k = 2 определения содержания i-го сульфаниламида, нитроимидазола, пенициллина, амфеникола, %.
12 Контроль качества результатов измерений
12.1 Контроль полноты извлечения внутренних стандартов
12.1.1 Контроль извлечения внутренних стандартов сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов выполняют в ходе каждого измерения (получения результата количественного химического анализа при соблюдении требований настоящего стандарта).
12.1.2 Рассчитанные программным обеспечением значения извлечения внутренних стандартов должны находиться в диапазоне от 35% до 130%. Если рассчитанное значение извлечения ниже или выше указанного диапазона, то результаты измерения остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов не принимают за окончательный результат. Проводят повторное определение.
12.2 Контроль правильности результатов измерений
При соблюдении требований настоящего стандарта рекомендуется в ходе анализа каждой серии образцов проводить анализ с известным содержанием анализов с использованием стандартной процедуры подготовки проб (7.2).
Результаты измерений признают удовлетворительными при выполнении следующего неравенства:
(6)
где ![]() - среднеарифметическое значение содержания i-го аналита в анализируемом образце с известным содержанием i-го анализа, мкг/кг;
- среднеарифметическое значение содержания i-го аналита в анализируемом образце с известным содержанием i-го анализа, мкг/кг;
Xia - установленное значение содержания i-го аналита по паспорту на стандартный образец, с известным содержанием i-го анализа, мкг/кг;
Vi - значение относительной расширенной неопределенности содержания i-го аналита для соответствующего диапазона измерений (таблицы 4 и 5), %.
13 Требования безопасности
13.1 Используемые в работе реактивы относятся к веществам 1-го и 2-го классов опасности по ГОСТ 12.1.007, при работе сними необходимо соблюдать требован ия безопасности, установленные для работ с токсичными, едкими и легковоспламеняющимися веществами по ГОСТ 12.1.005.
13.2 Помещения, в которых проводят анализ и подготовку проб, должны быть оборудованы приточно-вытяжной вентиляцией.
13.3 Операции по приготовлению градуировочных растворов следует проводить под тягой в вытяжном шкафу.
13.4 При проведении испытаний следует соблюдать требования ГОСТ 12.2.085 и правила устройства и безопасной эксплуатации сосудов, работающих под давлением [1].
13.5 При выполнении измерений на хромато-масс-спектрометре следует соблюдать правила электробезопасности в соответствии с ГОСТ Р 12.1.019 и инструкцией по эксплуатации прибора.
13.6 К выполнению измерений методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием допускаются лица, владеющие техникой ВЭЖХ-МС/МС и изучившие инструкции по эксплуатации используемой аппаратуры.
_______________________________
* Указанные материалы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
** Стандартный образец является рекомендуемым к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
Приложение А
(обязательное)
Контроль стабильности результатов измерений
Периодичность контроля стабильности результатов измерений регламентируют в руководстве по качеству лаборатории.
Контроль стабильности результатов измерений в лаборатории при реализации метода настоящего стандарта осуществляют по ГОСТ Р ИСО 5725-6, используя контроль стабильности среднеквадратического (стандартного) отклонения промежуточной прецизионности рутинного анализа с изменяющимися факторами "время" и "оператор".
Применяя метод контрольных карт Шухарта, проверяют стабильность этих результатов измерений и оценивают стандартное отклонение промежуточной прецизионности с изменяющимися факторами "время" и "оператор". После отбора анализируемой пробы ее подготавливают в лаборатории для анализа. Одну пробу, подвергавшуюся анализу во время смены (C1), анализирует повторно другой оператор в другую смену (C2), и результаты сравнивают. Значение стандартного отклонения промежуточной прецизионности (σI(T, O)) устанавливают в лаборатории по результатам измерений за предыдущий период. Параметры контрольной карты пределов для каждого диапазона рассчитывают следующим образом:
- среднюю линию по формуле
d2·σI(T, O)=1,128σI(T, O),
(А.1)
где σI(T, O) - среднеквадратическое отклонение промежуточной прецизионности, %;
- верхний предел действия по формуле
UCLд=3,686σI(T, O);
(А.2)
- верхний предел предупреждения по формуле
UCLп=2,834σI(T, O).
(А.3)
Расхождение (w) рассчитывают по формуле
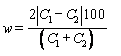 .
.(А.4)
Расхождение w наносят на карту в течение контролируемого периода.
Рекомендуется устанавливать контролируемый период так, чтобы количество результатов контрольных измерений было от 20 до 30. После этого проводят оценку стандартного отклонения промежуточной прецизионности (SI(T, O)) результатов по формуле
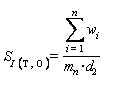 ,
,(А.5)
где mn - число измерений.
Полученное значение SI(T, O) используют для последующего контроля стабильности результатов измерений.
Библиография
|
[1] |
ПБ 03-576-2003 |
Правила устройства и безопасной эксплуатации сосудов, работающих под давлением (Утверждены Постановлением Госгортехнадзора России от 11.06.2003 N 91) |
(Нет голосов) |
-
12.04.2024
Названы города России с самым доступным жильем
 Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
-
12.04.2024
Россиянам назвали лучшее время для продажи дачи
 Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
-
12.04.2024
Предсказано будущее рынка жилья в России
 «МК»: в России не отменят льготную ипотеку
«МК»: в России не отменят льготную ипотеку
-
12.04.2024
В Москве подешевела аренда квартир
 Аренда квартир в Москве подешевела на 10 %
Аренда квартир в Москве подешевела на 10 %
-
22.03.2024
Хуснуллин назвал необходимый размер ставки по ипотеке
 Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов