![]() — Все документы — Документы Системы нормативных документов в строительстве — 1 Организационно-методические нормативные документы — к. 12 Производство — ИТС 24-2017 ПРОИЗВОДСТВО РЕДКИХ И РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
— Все документы — Документы Системы нормативных документов в строительстве — 1 Организационно-методические нормативные документы — к. 12 Производство — ИТС 24-2017 ПРОИЗВОДСТВО РЕДКИХ И РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
ИТС 24-2017 ПРОИЗВОДСТВО РЕДКИХ И РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Manufacture of rare and rare-earth metals
Дата введения - 1 июля 2018 г.
Введение
Настоящий информационно-технический справочник по наилучшим доступным технологиям "Производство редких и редкоземельных металлов" (далее - справочник НДТ) разработан на основании анализа распространенных в Российской Федерации и перспективных технологий, оборудования, сырья, других ресурсов с учетом климатических, экономических и социальных особенностей Российской Федерации.
В соответствии с положениями Федерального закона от 10 января 2002 г. N 7-ФЗ "Об охране окружающей среды" ([1]) объекты, оказывающие воздействие на окружающую среду, подразделяются на четыре категории. Производство изделий дальнейшего передела черных металлов включено в I категорию и отнесено к областям применения наилучших доступных технологий (НДТ). Профильные предприятия рассматриваются как объекты, деятельность которых оказывает значительное негативное воздействие на окружающую среду, поэтому они обязаны получать комплексные экологические разрешения на осуществление своей деятельности. Общая цель комплексного подхода к экологическому нормированию хозяйственной деятельности заключается в совершенствовании регулирования и контроля производственных процессов с целью обеспечения высокого уровня защиты окружающей среды. Хозяйствующие субъекты должны принимать все необходимые предупредительные меры, направленные на предотвращение загрязнения окружающей среды и рациональное использование ресурсов, в частности, посредством внедрения НДТ, обеспечивающих выполнение экологических требований.
Термин "наилучшие доступные технологии" определен в статье 1 Федерального закона N 7-ФЗ "Об охране окружающей среды" ([1]), согласно которому НДТ - это технология производства продукции (товаров), выполнения работ, оказания услуг, определяемая на основе современных достижений науки и техники и наилучшего сочетания критериев достижения охраны окружающей среды при условии наличия технической возможности ее применения.
Структура настоящего справочника НДТ соответствует ГОСТ Р 56828.14-2016 ([2]), формат описания технологий - ГОСТ Р 56828.13-2016 ([3]), термины приведены в соответствии с ГОСТ Р 56828.15-2016 ([4]).
Краткое содержание справочника
Введение. Представлено краткое содержание настоящего справочника НДТ.
Предисловие. Указана цель разработки настоящего справочника НДТ, его статус, законодательный контекст, краткое описание процедуры создания в соответствии с установленным порядком, а также взаимосвязь с аналогичными международными документами.
Область применения. Описаны основные виды деятельности, на которые распространяется действие настоящего справочника НДТ.
В разделе 1 представлена информация о состоянии и уровне развития в Российской Федерации производства редких и редкоземельных металлов по основным переделам. Также в разделе 1 приведен краткий обзор экологических аспектов производства.
В разделе 2 представлены сведения о технологических процессах, применяемых при производстве:
- легких редких металлов;
- рассеянных редких металлов;
- тугоплавких редких металлов;
- редкоземельных металлов;
- вспомогательных производственных процессов.
В разделе 3 дана оценка потребления энергоресурсов и уровней выбросов в окружающую среду, характерных для производства редких и редкоземельных металлов в Российской Федерации.
Раздел подготовлен на основе данных, представленных предприятиями Российской Федерации в рамках разработки настоящего справочника НДТ, а также различных литературных источников.
В разделе 4 описаны особенности подходов, примененных при разработке настоящего справочника НДТ и в целом соответствующих Правилам определения технологии в качестве наилучшей доступной технологии, а также разработки, актуализации и опубликования информационно-технических справочников по наилучшим доступным технологиям (утверждены постановлением Правительства Российской Федерации от 23 декабря 2014 г. N 1458) [5] и Методическим рекомендациям по определению технологии в качестве наилучшей доступной технологии (утверждены приказом Министерства промышленности и торговли Российской Федерации от 31 марта 2015 г. N 665) [6].
В разделе 5 приведено краткое описание НДТ для производства редких металлов включая:
- системы экологического и энергетического менеджмента, контроля и мониторинга технологических процессов;
- технические и технологические решения для повышения энергоэффективности, ресурсосбережения, снижения эмиссий загрязняющих веществ, методы обращения с отходами и побочными продуктами производства.
В разделе 6 приведены доступные сведения об экономических аспектах реализации НДТ на предприятиях Российской Федерации.
В разделе 7 приведен перечень перспективных технологий и технологий, находящихся на стадии научно-исследовательских и опытно-конструкторских работ или опытно-промышленного внедрения, позволяющих повысить эффективность производства и сократить эмиссии в окружающую среду, с указанием сроков, в течение которых перспективные технологии могут стать экономически и технически доступными.
Заключительные положения и рекомендации. Приведены сведения о членах технической рабочей группы, принимавших участие в разработке настоящего справочника НДТ и рекомендации предприятиям по дальнейшим исследованиям экологических аспектов их деятельности.
Библиография. Приведен перечень источников информации, использованных при разработке настоящего справочника НДТ.
Предисловие
Цели, основные принципы и порядок разработки справочника НДТ установлены постановлением Правительства Российской Федерации от 23 декабря 2014 г. N 1458 "О порядке определения технологии в качестве наилучшей доступной технологии, а также разработки, актуализации и опубликования информационно-технических справочников по наилучшим доступным технологиям" [5].
1 Статус документа
Настоящий справочник НДТ является документом по стандартизации, разработанным в результате анализа технологических, технических и управленческих решений для производства редких и редкоземельных металлов и содержащим описание применяемых в настоящее время и перспективных технологических процессов, технических способов, методов предотвращения и сокращения негативного воздействия на окружающую среду, из числа которых выделены решения, признанные НДТ для производства редких и редкоземельных металлов, включая соответствующие параметры экологической результативности, ресурсо- и энергоэффективности, а также экономические показатели.
2 Информация о разработчике
Настоящий справочник НДТ разработан технической рабочей группой "Производство редких и редкоземельных металлов" (ТРГ 24), созданной приказом Росстандарта от 30 декабря 2016 г. N 2060.
Перечень организаций, принимавших участие в разработке справочника, приведен в разделе "Заключительные положения и рекомендации".
Справочник НДТ представлен на утверждение Бюро наилучших доступных технологий (далее - Бюро НДТ) (www.burondt.ru).
3 Краткая характеристика
Настоящий справочник НДТ содержит описание применяемых при производстве редких и редкоземельных металлов технологических процессов, оборудования, технических способов, методов, в том числе позволяющих снизить негативное воздействие на окружающую среду, потребление воды и сырья, повысить энергоэффективность. Из описанных технологических процессов, оборудования, технических способов, методов определены решения, являющиеся НДТ. Для НДТ в настоящем справочнике НДТ установлены соответствующие технологические показатели НДТ.
4 Сбор данных
Информация о технологических процессах, технических способах, методах, применяемых при производстве редких и редкоземельных металлов в Российской Федерации, была собрана в процессе разработки настоящего справочника НДТ в соответствии с Порядком сбора данных, необходимых для разработки информационно-технического справочника по наилучшим доступным технологиям и анализа приоритетных проблем отрасли, утвержденным приказом Росстандарта от 23 июля 2015 г. N 863.
5 Взаимосвязь с другими справочниками НДТ
Взаимосвязь настоящего справочника НДТ с другими справочниками НДТ, разрабатываемыми в соответствии с распоряжением Правительства Российской Федерации от 31 октября 2014 г. N 2178-р ([7]), приведена в разделе "Область применения".
6 Информация об утверждении опубликовании и введении в действие
Настоящий справочник НДТ утвержден приказом Росстандарта от 15 декабря 2017 г. N 2849.
Настоящий справочник НДТ введен в действие с 1 июля 2018 г., официально опубликован в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru).
Область применения
Настоящий справочник НДТ распространяется на следующие основные виды деятельности:
- процессы производства легких редких металлов;
- процессы производства рассеянных редких металлов;
- процессы производства тугоплавких редких металлов;
- процессы производства редкоземельных элементов.
Настоящий справочник НДТ распространяется на методы производства редких и редкоземельных металлов. Ни один редкий металл не получают непосредственным восстановлением из сырья, первоначальное сырье обогащают или вскрывают (выщелачивание, спекание), а полученные черновые концентраты и промпродукты перерабатывают в химические соединения. Помимо рудного сырья источником получения редких металлов являются промышленные отходы цветной и черной металлургии, химических производств.
Справочник НДТ также распространяется на процессы, связанные с основными видами деятельности, которые могут оказать влияние на объемы эмиссий и (или) масштабы загрязнения окружающей среды:
- хранение и подготовка сырья;
- хранение и подготовка топлива;
- производственные процессы (пирометаллургические, гидрометаллургические и электролитические);
- методы предотвращения и сокращения выбросов и образования отходов;
- хранение и подготовка продукции.
Справочник НДТ не распространяется на:
- добычу и обогащение руд и продуктов, содержащих редкие металлы;
- процессы производства радиоактивных металлов;
- вопросы, которые касаются исключительно обеспечения промышленной безопасности или охраны труда.
Вопросы обеспечения промышленной безопасности и охраны труда частично рассматриваются только в тех случаях, когда оказывают влияние на виды деятельности, включенные в область применения настоящего справочника НДТ.
Дополнительные виды деятельности при производстве редких металлов и соответствующие им справочники НДТ (названия справочников НДТ даны в редакции распоряжения Правительства Российской Федерации от 31 октября 2014 г. N 2178-р) приведены в таблице ниже.
|
Вид деятельности |
Соответствующий справочник НДТ |
|
Методы очистки сточных вод, направленные на сокращение сбросов металлов в водные объекты |
Справочник НДТ ИТС 8-2015 "Очистка сточных вод при производстве продукции (товаров), выполнении работ и оказании услуг на крупных предприятиях" |
|
Промышленные системы охлаждения, например, градирни, пластинчатые теплообменники |
Справочник НДТ ИТС 20-2016 "Промышленные системы охлаждения" |
|
Хранение и обработка материалов |
Справочник НДТ ИТС 46-2017 "Сокращение выбросов загрязняющих веществ, сбросов загрязняющих веществ при хранении и складировании товаров (грузов)" |
|
Обращение с отходами |
Справочник НДТ ИТС 15-2016 "Утилизация и обезвреживание отходов (кроме обезвреживания термическим способом (сжигание отходов)" |
|
Выработка пара и электроэнергии на тепловых станциях |
Справочник НДТ ИТС 38-2017 "Сжигание топлива на крупных установках в целях производства энергии" |
|
Повышение энергетической эффективности |
Справочник НДТ ИТС 48-2017 "Повышение энергетической эффективности при осуществлении хозяйственной и (или) иной деятельности" |
В настоящем справочнике НДТ использованы термины и определения в соответствии с ГОСТ Р 56828.15-2016 [4].
Раздел 1. Общая информация о редкометальной промышленности
1.1 Общая информация
Редкие металлы - исторически сложившееся название большой группы элементов периодической системы Д.И. Менделеева, которые располагаются почти во всех группах и периодах и, соответственно, обладают разными свойствами. По этой причине, ни по их расположению, ни по физико-химическим свойствам эти элементы в единую группу объединить нельзя.
Содержание большинства элементов в земной коре не превышает 0, 01 % - 0, 0001 %. Такие элементы в геохимии принято называть редкими. Если редкие элементы обладают слабой способностью к концентрации, то они именуются редкими рассеянными.
Важнейшие обобщающие характеристики проявляются только в названиях подгрупп в промышленной классификации.
Общепризнанный в настоящее время термин "редкие металлы" возник в начале XX в., когда данные металлы только начали использоваться, т.е. применялись редко. И до настоящего времени этот термин в определенной степени отражает ряд их особенностей:
- сравнительно небольшие масштабы производства и потребления (один из наиболее известных редких металлов рубидий, производится в количествах, примерно в 130 раз меньших по сравнению с алюминием);
- малая распространенность в природе, их кларки не превышают 1•10-9 %; (наиболее распространенный редкий металл рубидий содержится в земной коре в количестве 0, 015 %);
- большинство редких металлов не образуют в природе самостоятельных минералов и находятся в рассеянном состоянии в кристаллических решетках других минералов, многие из них являются природными спутниками тяжелых и легких цветных металлов;
- очень низкое содержание в рудах и крайне сложный состав такого сырья;
- помимо рудного сырья, источником получения редких цветных металлов являются промышленные отходы цветной и черной металлургии, химических производств.
Редкие металлы (РМ) согласно промышленной классификации подразделяют на пять подгрупп в зависимости от физико-химических свойств, совместного нахождения в рудном сырье и сходства методов извлечения из сырья. Важнейшие обобщающие характеристики этих металлов заключены в названиях выделенных подгрупп: легкие, рассеянные, тугоплавкие, редкоземельные и радиоактивные.
В данном справочнике рассматривается четыре группы.
Легкие редкие металлы - бериллий, литий, рубидий и цезий. В данную подгруппу входят редкие металлы I и II групп периодической системы Д.И. Менделеева. Их отличают малая плотность (меньше 2 г/см3) и высокая химическая активность. Легкие редкие металлы, как и основные легкие, получают электролизом расплавов солей или металлотермическим способом.
Рассеянные редкие металлы - рений, галлий, индий, таллий, германий, гафний, селен и теллур. Эти металлы отличаются высокой рассеянностью в земной коре, большей частью они находятся в форме изоморфной смеси в малых концентрациях в решетках других минералов и извлекаются попутно из отходов металлургических и химических производств. Так, галлий содержится в алюминиевых минералах; индий, таллий и германий встречаются в сфалерите и других сульфидных минералах; германий - в каменных углях; рений, селен и теллур - в медном сульфидном сырье.
Тугоплавкие редкие металлы. К ним относятся переходные элементы IV, V и VI групп периодической системы Д.И. Менделеева, у которых происходит достройка электронного d-уровня. Эти особенности определяют физические и химические свойства рассматриваемой подгруппы металлов: высокую температуру плавления, прочность, коррозионную стойкость, а также переменную валентность, многообразие химических соединений. Все тугоплавкие редкие металлы образуют тугоплавкие и твердые карбиды, бориды и силициды. Тугоплавкие редкие металлы объединяют области применения.
Редкоземельные элементы (РЗЭ). Лантаноиды объединены сходством физико-химических свойств (от церия до лютеция) вследствие одинакового строения внешних электронных оболочек (при переходе от одного элемента к другому происходит заполнение глубоколежащего 4f-уровня). К редкоземельным элементам также относятся элементы III группы периодической системы Д.И. Менделеева: лантан, скандий, иттрий. Из рудного сырья получают редкоземельный концентрат, который поступает на разделение для получения индивидуальных элементов. Технологически допустимо частично разделить на первой стадии. Последующее разделение требует сложного дополнительного технологического оборудования и многоступенчатой стадии разделения.
К группе тугоплавких металлов относят ванадий, ниобий, тантал, цирконий, титан, вольфрам и молибден.
Редкими металлами в современной технике условно называют некоторые химические элементы, в большинстве по своим свойствам металлы, области возможного использования, природные ресурсы и технология производства которых уже достаточно определены, но которые еще редко и в относительно малых количествах применяются в промышленности, поскольку при достигнутом ранее уровне техники еще можно было обойтись без их широкого использования. Использование редких металлов началось в конце XIX века. Первым из их числа получил признание вольфрам, за ним молибден (в настоящее время в ряде документов, выведенные из классификации РМ), ниобий, тантал, а затем постепенно и остальные.
Развитие применения и производства редких металлов обусловлено возникновением потребности промышленности в новых высокоэффективных материалах. Группа редких металлов не остается неизменной, из данной группы выбывают химические элементы, получившие широкое применение в промышленности, каковыми являются вольфрам, молибден и титан, еще недавно относившиеся к редким. Однако, учитывая их высокую важность для промышленности и то, что они не нашли своего места в выпущенных ранее справочниках, они представлены в данном справочнике условно как редкие металлы.
1.2 Минерально-сырьевая база и сфера распространения редких металлов
Минерально-сырьевая база редких металлов в России по величине запасов занимает ведущее место в мире. Однако отечественные месторождения существенно уступают зарубежным аналогам по качеству руд, а именно, по содержанию полезных компонентов, а также по технологичности, горнотехническим условиям отработки и доступности.
Разрабатываемых природных источников ренийсодержащего сырья Россия практически не имеет. Сырьевой базой ниобия и тантала является комплексное Ловозерское лопаритовое месторождение (Мурманская область). Это также единственный действующий на сегодняшний день источник производства коллективных карбонатов РЗМ.
Запасы молибдена России содержатся в 36 месторождениях. К 2017 г. горно-металлургическая компания "Норильский никель" планирует запуск Бугдаинского ГОК. Почти все текущее горное молибденовое производство на данный момент сосредоточено на ООО "Сорский ГОК", действующем на Сорском месторождении в Республике Хакасии и ОАО "Жирекенский ГОК", разрабатывающем одноименное месторождение в Читинской области.
Источником бериллиевого сырья в России являются Завитинское и Ермаковское (Республика Бурятия) месторождения, которые разрабатывались Забайкальским ГОКом. Однако сейчас Завитинское месторождение не эксплуатируется, а Ермаковское месторождение законсервировано.
По объему запасов лития Россия занимает одно из ведущих мест в мире. Прогнозные ресурсы оцениваются в 260 тыс.т. лития, а запасы определены в количестве сотен тысяч тонн. Основным производителем литиевой продукции на российском рынке является НЗХК, который поставляет литий отечественным потребителям и за рубеж.
Для производства циркониевой и гафниевой продукции единственным сырьевым источником является бадделеитовый концентрат Ковдорского железорудного месторождения.
Германий - один из наиболее ценных материалов в современной полупроводниковой технике. Сырьевой базой для производства германиевой продукции является ряд месторождений германиеносных углей, прежде всего Новиковского на Сахалине, Павловского - в Приморском крае и Тарбагатайского - в Читинской области.
Сведения об использовании редких металлов приведены в таблицах 1.1-1.4.
Таблица 1.1
|
Легкие редкие металлы |
Сфера распространения, что из них производят, как они используются |
|
Бериллий Be |
Легирование сплавов, рентгенотехника, лазерные материалы, аэрокосмическая техника, ракетное топливо, огнеупорные материалы, акустика. |
|
Литий Li |
Атомная техника и электроника, металлургия, реактивная авиация и ракетная техника, химическая промышленность, медицина, оборонная промышленность, дефектоскопия, силикатная промышленность, текстильная, пищевая и косметическая промышленности. |
|
Рубидий Rb |
Катализ, электронная промышленность, специальная оптика, атомная промышленность, медицина, для переработки нефти. |
|
Цезий Cs |
Электроника, радио-, электро-, рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике. Применяется стабильный природный цезий - 133 и ограниченно его радиоактивный изотоп цезий - 137, выделяемый в реакторах атомных станций. |
Таблица 1.2
|
Рассеянные редкие металлы |
Сфера распространения, что из них производят, как они используются |
|
Рений Re |
Платинорениевые катализаторы, жаропрочные сплавы. Сплавы используются при создании деталей ракетной техники и сверхзвуковой авиации. |
|
Галлий Ga |
Галлий и его эвтектический сплав с индием используют как теплоноситель в контурах реакторов. Галлий применяют как смазочный материал, как покрытие зеркал специального назначения. |
|
Индий In |
Широко применяется в производстве жидкокристаллических экранов, в микроэлектронике. Компонент для легкоплавких припоев и сплавов |
|
Таллий Tl |
Амальгама таллия применяется для заполнения низкотемпературных термометров и в качестве теплоносителя. Соединения таллия применяются для регистрации ионизирующих излучений. |
|
Германий Ge |
Волоконная оптика, тепловизорная оптика, химические катализаторы, электроника, металлургия. |
|
Гафний Hf |
Металлический гафний применяется для производства сплавов для аэрокосмической техники, атомной промышленности, специальной оптики. |
|
Селен Se |
Основа потребления полупроводниковые свойства селена и его соединений. |
|
Теллур Te |
Теллур применяется при производстве кабелей, свинцово-кислотных аккумуляторов, детекторов рентгеновского и гамма-излучения, полупроводниковых материалов. |
Таблица 1.3
|
Редкоземельные металлы |
Сфера распространения, что из них производят, как они используются |
|
Скандий Cs |
Главное применение - алюминиево-скандиевые сплавы (мотоциклы, велосипеды, бейсбольные биты и т.п.) - это высокая прочность. Применение скандиевых сплавов в авиации и гражданском ракетостроении, для производства автомобильных двигателей. |
|
Иттрий Y |
Применение сплавов иттрия - авиакосмическая промышленность, атомная техника, автомобилестроение, применение в газофазном ракетном двигателе. |
|
Лантаноиды Ln |
Объем использования лантаноидов огромен, начиная от стекольной и заканчивая металлургической промышленностью. В качестве катализаторов на нефтеперерабатывающих заводах, люминесцентных активаторов, электрокерамических соединениях, в высокотемпературных сверхпроводниках, изготовляют постоянные магниты, входят в состав кристаллов для лазеров, в атомной технике. |
Таблица 1.4
|
Тугоплавкие редкие металлы |
Сфера распространения, что из них производят, как они используются |
|
Ванадий V |
80 % всего производимого ванадия используется в сплавах, нержавеющих и инструментальных сталей. |
|
Ниобий Nb |
Ниобий применяется в ракетостроении, авиационной и космической технике, радиотехнике, электронике, химическом аппаратостроении, атомной энергетике. |
|
Тантал Ta |
Танталовая проволока применяется для изготовления сеток электронных ламп. Жаропрочные и коррозионностойкие сплавы для химической промышленности, теплообменники для ядерно-энергетических систем. |
|
Цирконий Zr |
Металлический цирконий и его сплавы применяются в атомной энергетике для изготовления конструкций атомных реакторов. |
|
Титан Ti |
Авиа-, ракето-, кораблестроение, химическая, военная, автомобильная, сельскохозяйственная, пищевая, промышленность, металлургия, медицина и техника. |
|
Вольфрам W |
Нити накаливания в осветительных приборах, кинескопах и других вакуумных трубках, основа тяжелых сплавов в военной технике, |
|
Молибден Mo |
Молибден используют для легирования сталей (жаропрочных и коррозионностойких). |
1.3. Анализ отрасли по отдельным металлам
Ускоренное возрождение производств редких металлов является задачей ближайших лет. С распадом СССР за пределами южных границ России остались как эксплуатируемые месторождения собственно редкометального сырья, так и химико-металлургические предприятия, которые перерабатывали различные минеральные концентраты с извлечением редкометальной продукции - Li, Be, Na, Nb, индивидуальных редких земель, а также рения, индия и других рассеянных редких металлов (РРМ). С ними в основном связаны перспективы редкометального ренессанса, необходимого для развития ОПК и гражданских высокотехнологичных отраслей промышленного производства России.
С ХХ в. уровни производства и потребления редких элементов стали рассматриваться в качестве индикаторов экономической и национальной безопасности промышленно развитых и развивающихся стран. За последние 10 лет мировое потребление Li, Ta, Nb, V и некоторых других редких металлов увеличилось в 1, 5-3 раза, а наиболее дефицитных, стратегически важных рассеянных металлов - Re и In - в 7-12 раз. Это обусловлено ростом их использования как в традиционных отраслях промышленного производства (металлургия, создание керамических и композиционных материалов, электротехника и электроника, ядерная энергетика), так и в принципиально новых высокотехнологичных отраслях (инфракрасная, микроволновая и СВЧ-техника, телекоммуникационная и волоконно-оптическая связь, новые сплавы, топливные элементы и источники энергии, сверхпроводимость и т.д.).
В сравнении с ведущими промышленно-развитыми странами мира и, прежде всего США и Японией, не обеспеченными многими видами собственного редкометального сырья, Россия, также превратившаяся в их импортера, потребляет в настоящее время в 5-10 раз меньше, чем каждая из них Li, Zr, в 10-25 раз меньше Ta, в сотни раз - Re и In, и т.д. При мировом лидерстве России в общей протяженности нефтегазопроводов потребление ею феррониобия для микролегирования стали и трубопроводов в начале 2000-х гг. составляло 8 г/т, в то время как в странах ЕС и Японии - по 40 г/т, в США - 70 г/т. Бразилия как мировой монополист в производстве феррониобия и ниобия превосходит Россию в десятки раз по объемам их производства и экспорта.
Необходимо заметить, что даже в советский период СССР импортировал трубы большого диаметра для нефтегазопроводов, легированных феррониобием, цирконовые концентраты для производства циркония и сопутствующего гафния, ильменитовые концентраты - как источник титана и сопутствующего скандия, поллуцитовые - как источник церия и рубидия и некоторые другие.
В России сложилась устойчивая зависимость от импорта более широкого круга редкометальной продукции из стран ближнего и дальнего зарубежья, включая такие стратегически важные и дефицитные виды редкометального сырья и химико-металлургической продукции как литий, бериллий, цирконий, гафний, РЗМ и др. Собственное производство из отечественного сырья сохраняется только для германия и ванадия в объемах, обеспечивающих возможности их экспорта, а также для тантала и ниобия, производство которых в сравнении с советским периодом сократилось более чем в два раза.
1.3.1 Легкие редкие металлы
1.3.1.1 Бериллий самый легкий из конструкционных материалов.
Металлический бериллий был получен восстановлением его хлорида. Производство соединений бериллия металла и его сплавов возникло в 20-30 годах прошлого столетия.
Среднее содержание бериллия в земной коре (по А.П. Виноградову) равно 3, 8•10-3. Известно около 40 минералов бериллия, представляющих преимущественно различные сложные селикаты. Промышленное значение имеют берилл, хризоберилл, гельвин, бертрандит и даналит.
Производство бериллия в нашей стране пока не соответствует ее потребностям и потенциальным возможностям. Единственное традиционно эксплуатируемое месторождение бериллиевого сырья "Изумрудные копи" представлено флогопит-маргарит-бериллиевыми рудами плагиоклазитов. Их эксплуатация осуществляется Малышевским РУ, специализированным на выпуск драгоценного кристаллосырья - изумрудов с сопутствующим александритом. Попутно в советское время выпускался преобладающий количественно берилловый концентрат при содержании в исходной руде 0, 14 % BeO. Кроме того, берилл (с танталоколумбитом) извлекался из пегматитов соседних месторождений (Квартальное, Липовый Лог), характеризующихся Ta-Nb-Be-й специализацией. Попутные берилловые концентраты выпускались также Забайкальским ГОКом, специализированным на производстве профилирующей литиевой (сподумен) продукции, и Белогорским ГОКом (Казахстан), специализированным на выпуске танталовых концентратов.
Сложнее будет решаться задача глубокой химико-металлургической переработки различного бериллиевого сырья, которая в СССР осуществлялась на Ульбинском химико-металлургическом заводе в г. Усть-Каменогорске. Тем более что ее решение предусматривалось нереализованной Федеральной программой "ЛИБТОН" Росатома (1996 г.). Предпринимаемые в настоящее время попытки ее реанимировать на базе приостановленных, дезинтегрированных и частично утраченных мощностей бывшего Забайкальского ГОКа в пос. Первомайском с использованием остаточных руд и техногенных ресурсов с недопустимо низкими содержаниями редких металлов, нерешенными технологическими задачами их извлечения и потребительского спроса по-прежнему представляются нереальными.
Потребности России в бериллии частично (в пределах 1, 5-2 т) удовлетворяются за счет импорта из Казахстана продукции Ульбинского ХМЗ. В перспективе на 2020 г. ежегодные потребности в целом оцениваются в 70 т (в СССР порядка 100 т) при условии роста его использования высокотехнологичными производствами (аэроракетно-космическая техника, оборонно-промышленный комплекс, атомными, телекоммуникационными и др.). Поэтому необходимо государственное решение бериллиевой проблемы как за счет мобилизации собственных ресурсов, так и за счет привлечения их из стран ЕврАзЭС, включая организацию совместных производств на ОАО "Ульяновский моторный завод" и увеличение импорта из зарубежных стран как сырья, так и конечной бериллиевой металлопродукции.
Бериллий, благодаря оптимальному сочетанию физических, химических и механических свойств, оценивается в современном мире как космический металл: один из самых легких, прочных, тугоплавких, коррозионно устойчивых и сохраняющих размерность при температурных колебаниях. В АРКТ используются облегченные конструкции из бериллиевых материалов ("Шаттл"). Наиболее заметно расширяется использование бериллиевых сплавов - от традиционного производства наиболее известных бериллиевых бронз - Cu-Be (от 0, 2 % - 0, 7 % до 2 % Be) и Al-Be-х (до 68 % Be) до создания фирмой BWI уникального сплава Alloy 390ТМ для мобильных телефонов.
1.3.1.2 Литий был открыт в 1817 г. в минерале петалите (алюмосиликате лития), из которого его выделили в виде сульфата. В элементарном виде литий был получен разложением его оксида электрическим током. В 1855 г. был разработан промышленный способ получения лития электролизом его хлорида.
Литий - элемент I группы периодической системы Д.И. Менделеева, самый легкий из металлов. Природный литий содержит смесь двух изотопов 6Li (7, 52 %) и 7Li (92, 48 %). Изотопы лития резко отличаются по значению поперечного сечения захвата тепловых нейтронов.
Порядковый номер - 3.
Плотность, г/см3 - 0, 531.
Температура, плавления - 180, 5 °С.
Вместе с тем литий - самый электроотрицательный элемент в водной среде. Эта аномалия объясняется сильной гидратацией иона лития. В расплавленных средах, где отсутствует гидратация, потенциал лития выше, чем других щелочных металлов, что согласуется с величинами ионизационных потенциалов.
В сухом воздухе при обычной температуре литий медленно реагирует с кислородом и азотом, покрываясь пленкой, содержащей оксид и нитрид лития. Реагирование ускоряется в присутствии влаги. В кислороде (-200 °С) литий горит голубым пламенем, образуя оксид. Литий энергично разлагает воду с выделением водорода и образованием раствора гидроксида. С водородом при температуре 500-600 °С литий образует гидрид LiH, с азотом выше 250 °С - нитрид Li3N. Фтор, хлор и бром реагируют с литием на холоде, йод - при нагревании. Сера, углерод и кремний при нагревании взаимодействуют с литием с образованием соответственно сульфида Li2S, карбида Li2C2 и силицида Li6Si2. Углекислый газ активно реагирует с литием, образуя карбонат лития.
Большинство металлов и сплавов координирует в жидком литии. Никель и сплавы никеля с хромом удовлетворительно стойки в жидком литии до температуры 225 °С. Наиболее устойчивы против действия лития до температуры 1000 °С ниобий, тантал и молибден. Кварц, стекло и фарфор быстро растворяются в литии при температуре 200 °С.
Литий занимает особое положение среди щелочных металлов, сближаясь по ряду свойств со щелочно-земельными, особенно с магнием. Это сходство проявляется в относительно малой растворимости карбоната, фосфата и фторида лития, а также в более резко выраженной, чем у остальных щелочных металлов, способности к образованию двойных солей с остальными представителями группы.
Оксид лития Li2O - бесцветное кристаллическое вещество, образующееся при окислении лития кислородом, а также термическом разложении гидроксида, карбоната или нитрата лития. Оксид растворяется в воде с сильным разогревом с образованием раствора гидроксида LiOH.
Растворимость гидроксида лития в воде примерно в пять раз ниже растворимости гидроксидов натрия и калия:
|
Температура, °С |
0 |
20 |
50 |
80- |
100 |
|
Растворимость LiOH в воде, % (по массе) |
10, 64 |
10, 99 |
12, 2 |
14, 21 |
16, 05 |
При выпарке из раствора кристаллизуется моногидрат лития - сильная щелочь. В твердом состоянии и в концентрированных растворах уже при обычной температуре он разрушает стекло и фарфор, поэтому его хранят в таре из пластмассы.
Карбонат лития LiCO3, отличается сравнительно малой растворимостью в воде: 1, 26 % (при 25 °С) и 0, 83 % (при 75 °С).
Сульфат лития Li2SO4 - хорошо растворимая соль: 25, 7 % при 20 °С и 23, 1 % при 80 °С. В отличие от сульфатов натрия и калия сульфат лития не образует двойных солей типа квасцов.
Хлорид лития LiCl - бесцветное вещество (tпл = 614 °С, tкип = 1380 °С). Соль хорошо растворима в воде (80, 6 % при 20 °С). В отличие от хлоридов натрия и калия хлорид лития растворяется в органических растворителях (спиртах, кетонах, хлороформе и др.) с образованием литийорганических соединений.
Фтористый литий - белое кристаллическое вещество (tпл = 848, tкип = 1680 °С). Соль малорастворима в воде (0, 133 % при 25 °С, не растворяется в соляной кислоте, но легко растворяется в азотной и серной кислотах.
Гидрид лития LiH - твердое вещество белого цвета (t = 690 °С). Получается взаимодействием расплавленного лития с водородом при температуре 680-700 °С. В отсутствие водорода термически разлагается при температуре 800-850 °С. Водой энергично разлагается с выделением водорода:
LiH + Н2O = LiОН + Н2
В связи с этим гидрид лития используют как источник водорода. В технике, кроме гидрида, используют алюмогидрид LiAlH4, и боргидрид NaВН4. Бордейтерид и бортритид лития служат источниками получения дейтерия и трития.
Литий за последние десятилетия приобрел исключительно важное значение в современной технике и является, безусловно, необходимым для ее дальнейшего развития. Несмотря на некоторые колебания в развитии производства литиевой продукции, в последние годы наметилось устойчивое повышение спроса на литий и его соединения, составляющие за последнее десятилетие 9, 4 %.
Уровни производства и промышленного использования лития в настоящее время служат индикаторами развития инновационного энергетического потенциала передовых зарубежных стран (США, Японии, Германии). Как за рубежом, так и в России эйфория по поводу ожидаемого использования лития, помимо термоядерного оружия, в управляемых процессах плазменной энергетики сменилась планомерным развитием производств литий-ионных батарей с формированием трех энергетических рынков: бытовой электроники, хранения энергии в сетях, электромобилей.
Однако в настоящее время в России отсутствуют горная добыча литиевого сырья и производство конечной литиевой продукции из собственных ресурсов, которые со времен СССР остаются неосвоенными. В 1997 г. в Забайкалье был закрыт единственный рудник - производитель литиевых концентратов. Альтернативой его закрытию спустя почти 20 лет может явиться промышленное освоение значительно более крупных и качественных по содержаниям лития и сопутствующих редких металлов разведанных пегматитовых месторождений Кольского региона, сосредоточенных в Воронья-Колмозерской зоне, месторождения Тастыг в Республике Тыва и нескольких месторождений в Иркутской области - Гольцово-Тагнинского, Урикского и др. Все эти месторождения соответствуют мировым стандартам как по содержанию лития, так и по его запасам, но отличаются друг от друга степенью транспортной доступности и перспективами промышленного освоения.
С этих позиций наиболее перспективным представляется Тастыгское месторождение наиболее богатых литием (1, 43 % LiO2) сподуменовых пегматитов, залегающих в карбонатных породах, и связанное автодорогой с югом Красноярского края. Тем самым обеспечиваются возможности не только создания на месте горно-обогатительного предприятия, но и производства карбоната лития для последующей его транспортировки в Красноярский край на дальнейшую глубокую переработку на одном из незагруженных из-за отсутствия литиевого сырья ПАО "ХМЗ". Тем более, что в дальнейшем открывается перспектива использования строящейся железнодорожной магистрали Кызыл - Курагино.
Месторождение Полмос-Тундра в пределах Воронья-Колмозерской зоны распространения редкометальных гранитных пегматитов в Кольском регионе представляется с геолого-экономических позиций конкурентоспособным объектом рекомендуемого промышленного освоения сравнительно с Тастыгом в Тыве. По содержанию лития (1, 25 % LiO2) сподуменовые руды этого месторождения лишь немного уступают тастыгским. Доступность определяется возможностями транспортировки грузов от Мурманска к востоку по автодороге через р. Воронья по плотине Серебрянской ГЭС и в обратном направлении со строительством в этом районе или пос. Туманный обогатительной фабрики, от которой до будущего рудника на месторождении может быть проложена местная автодорога. К ПАО "ХМЗ" в Красноярском крае по железной дороге будут доставляться на переработку сподуменовые концентраты.
Следует заметить, что в обоих вариантах выбора рекомендуемых источников литиевого сырья его обогащение, обжиг концентрата и гидрометаллургический передел с получением литиевой химической продукции по схеме бывшего Забайкальского ГОКа представляются традиционными и воспроизводимыми на стандартном оборудовании.
В то же время попытки реанимирования Федеральной программы "ЛИБТОН" (литий, бериллий, тантал, олово, ниобий), закрытой по совокупности причин в 1996 г., предпринимаемые некоторыми малыми предприятиями под эгидой госкорпорации "Росатом" в целях организации производства лития на базе оставшихся запасов бывшего ГОКа (0, 03 % - 0, 4 % LiO2) и складированных отходов обогащения (0, 2 % LiO2) при достигнутом извлечении лития из первичного сырья порядка 70 %, представляются нереальными. Тем более, что обогатимость различных источников редкометального сырья и эффективность переработки соответствующих концентратов не были изучены должным образом ни в 1990-е гг., ни в настоящее время.
1.3.1.3 Рубидий в земной коре содержится в количестве 1, 5•10-2 %, что примерно равно суммарному содержанию никеля, меди и цинка. По распространенности в земной коре рубидий находится примерно на 20-м месте, однако в природе он находится в рассеянном состоянии, рубидий - типичный рассеянный элемент. Собственные минералы рубидия неизвестны. Рубидий встречается вместе с другими щелочными элементами, он всегда сопутствует калию. Обнаружен в очень многих горных породах и минералах, найденных, в частности, в Северной Америке, Южной Африке и России, но его концентрация там крайне низка. Только лепидолиты содержат несколько больше рубидия, иногда 0, 2 %, а изредка и до 1 %-3 % (в пересчете на Rb2О). Соли рубидия растворены в воде морей, океанов и озер. Концентрация их и здесь очень невелика, в среднем порядка 100 мкг/л. В отдельных случаях содержание рубидия в воде выше: в Одесских лиманах оно оказалось равным 670 мкг/л, а в Каспийском море - 5700 мкг/л. Повышенное содержание рубидия обнаружено и в некоторых минеральных источниках Бразилии. Из морской воды рубидий перешел в калийные соляные отложения, главным образом, в карналлиты. В страссфуртских и соликамских карналлитах содержание рубидия колеблется в пределах от 0, 037 % до 0, 15 %. Минерал карналлит - сложное химическое соединение, образованное хлоридами калия и магния с водой; его формула - KCl•MgCl2•6H2O. Рубидий дает соль аналогичного состава RbCl•MgCl2•6H2O, причем обе соли - калиевая и рубидиевая - имеют одинаковое строение и образуют непрерывный ряд твердых растворов, кристаллизуясь совместно. Карналлит хорошо растворим в воде, поэтому вскрытие 13 минерала не составляет большого труда. Сейчас разработаны и описаны в литературе рациональные и экономичные методы извлечения рубидия из карналлита попутно с другими элементами. Минералы, содержащие рубидий (лепидолит, циннвальдит, поллуцит, амазонит), находятся на территории Германии, Чехии, Словакии, Намибии, Зимбабве, Туркмении и других стран [8].
1.3.1.4 Цезий в природе находится в минерале поллуците. Содержание его в земной коре составляет 3, 7•10-4 %. В виде примесей цезий входит в ряд алюмосиликатов: лепидолит, флогопит, биотит, амазонит, петалит, берилл, циннвальдит, лейцит, карналлит. Также содержится в редком минерале авогадрите. В качестве промышленного сырья используются поллуцит и лепидолит. По добыче цезиевой руды (поллуцита) лидирует Канада - в месторождении Танко (англ.) русск. (юго-восточная Манитоба, северо-западный берег озера Берник-Лейк) сосредоточено около 70 % мировых запасов цезия. Поллуцит также добывается в Намибии и Зимбабве. В России месторождения поллуцита есть на Кольском полуострове, в Восточном Саяне и Забайкалье. Месторождения поллуцита также имеются в Казахстане, Монголии и Италии (о. Эльба), но они обладают малыми запасами и не имеют важного экономического значения. Мировая добыча обогащенной руды цезия составляет около 20 т в год. Мировой объем производства металлического (чистого) цезия - около 9 т в год. Некоторые источники [9] утверждают, что потребности в цезии более чем в 8, 5 раз превышают его добычу, что положение в металлургии цезия еще более тревожное, чем, например, в металлургии тантала или рения и производители не могут обеспечить постоянно растущий спрос на металлический цезий. Наблюдается некоторое увеличение содержания цезия от ультраосновных пород (0, 1 г/т) к кислым (5 г/т). Основная его масса в природе находится в рассеянной форме и лишь незначительная часть заключена в собственных минералах. Постоянно повышенные количества цезия наблюдаются в морганите (1 % - 4 %), родиците (около 5 %), авогадрите и лепидолите (0, 85 %). По кристаллохимическим свойствам цезий наиболее близок к рубидию, калию и таллию. В повышенных количествах цезий находится в калиевых минералах. Цезий, как и рубидий, имеет тенденцию накапливаться на поздних стадиях магматических процессов, и в пегматитах его концентрации достигают наивысших значений. Среднее содержание цезия в гранитных пегматитах около 0, 01 %, а в отдельных пегматитовых жилах, содержащих поллуцит, даже достигает 0, 4 %, что примерно в 40 раз выше, чем в гранитах. Наиболее высокие концентрации цезия наблюдаются в редкометально замещенных микроклин-альбитовых пегматитах со сподуменом. При пневматолито-гидротермальном процессе повышенные количества цезия связаны с массивами грейзенезированных аляскитов и гранитов с кварц-берилл-вольфрамитовыми жилами, где он присутствует главным образом в мусковитах и полевых шпатах. В зоне гипергенеза (в поверхностных условиях) цезий в небольшом количестве накапливается в глинах, глинистых породах и почвах, содержащих глинистые минералы, иногда в гидроокислах марганца. Роль глинистых минералов сводится к сорбции, цезий вовлекается в межпакетное пространство в качестве поглощенного основания. Активная миграция этого элемента в водах очень ограничена. Основное количество цезия мигрирует "пассивно", в глинистых частичках речных вод. В морской воде концентрация цезия составляет около 0, 5 мкг/л. [10] Из числа собственно цезиевых минералов наиболее распространены поллуцит (Cs, Na)[AlSi2O6]•nH2O (22 % - 36 % Cs2O), цезиевый берилл (морганит) Be2CsAl2(Si6O18) и авогадрит (KCs)BF4. Последние два минерала содержат до 7, 5 % окиси цезия.
1.3.2. Рассеянные редкие металлы
Группа рассеянных редких металлов, извлекаемых попутно в процессах химико-металлургических переделов различного минерального сырья, продуктов и отходов его обогащения, а также глубокой переработки отходов металлургических производств, включает Re, Ga, In, Tl, Ge, Hf, Se, Te. Уровни их потребления и производства в настоящее время являются индикаторами экономической и национальной безопасности промышленно развитых стран, которые в возрастающих масштабах используют эффективные инновационные свойства редких металлов, в том числе рассеянных как продуктов попутных производств. С начала 1990-х гг. зарубежное потребление Ge увеличилось более чем на 30 %, Te - в 1, 5-2 раза, Ga - в 4 раза, Re - в 7 раз и In - в 12 раз. При этом в связи с возникшим дефицитом многократно возросла стоимость Re, Ga, In, Tl, Ge, Hf, Se, Te. Несмотря на указанные и другие негативные тенденции в развитии потребления рассматриваемых металлов, в зарубежном мире обеспечивается устойчивый его рост за счет сбалансированного обеспечения возрастающих потребностей собственными ресурсами и их импортом, закупками впрок и созданием государственных стратегических запасов, гибкой геоэкономической политикой и международным распределением труда.
С этих позиций представляется своевременным и целесообразным проанализировать ситуацию, сложившуюся в России после распада СССР, с обеспеченностью ее собственными ресурсами рассеянных редких металлов и перспективами развития их производств в обозримом будущем. Россия производит ванадий и германий, соответственно, извлекаемые при переработке титаново-железорудного и угольного сырья в количествах, позволяющих осуществлять их частичный экспорт. Значительно может увеличиться выпуск галлия на базе действующих глиноземно-алюминиевых производств, добывающих и перерабатывающих нефелиновое и бокситовое сырье. Обнадеживают перспективы создания и развития производств рения из различных сырьевых источников, включая новые: зоны обогащения ураном в бурых углях с применением ПСВ, продукты современной вулканогенной деятельности, природные битумы и продукты их переработки и т.д.
1.3.2.1 Рений - редкий рассеянный и наименее распространенный элемент. Среднее содержание его в земной коре очень низкое -7•10-8 % по массе.
Общие мировые запасы рения составляют около 13 000 т, в том числе 3 500 т в молибденовом сырье и 9 500 т - в медном. При перспективном уровне потребления рения в количестве 40-50 т в год человечеству этого металла может хватить еще на 250-300 лет.
В общем балансе производства рения в мире на них приходится более 80 %. Остальное в основном приходится на вторичное сырье [20].
Основные сырьевые источники получения рения - молибденовые концентраты (0, 01 % - 0, 04 % Re), медные концентраты (0, 002 % - 0, 003 % Re). Отходы от переработки медистых сланцев (0, 04 % Re), отходящие газы обжига молибденовых концентратов и конвертирования медных штейнов, а также сбросные воды гидрометаллургической переработки бедных молибденовых концентратов (10-50 мг/л Re). При переработке концентратов для получения парамолибдата аммония попутно извлекают рений.
При избытке воздуха содержащийся в молибдените сульфид рения (ReS2) окисляется с образованием высшего оксида - гептаоксида (Re2O7). Гептаоксид рения при обжиге возгоняется, уносится отходящими газами и улавливается специальной системой газопылеулавливания.
Рений встречается в виде редкого минерала джезказганита (CuReS4), найденного вблизи казахстанского города Джезказган. Кроме того, в качестве примеси рений входит в колумбит, колчедан, а также в циркон и минералы редкоземельных элементов [21]. Месторождение в кальдере на вершине вулкана представлено фумарольным полем размерами ~ 50 х 20 м с постоянно действующими источниками высокотемпературных глубинных флюидов - фумаролами. Это означает, что месторождение активно формируется по сегодняшний день: по разным оценкам, с газами в атмосферу уходит от 10 до 37 т рения в год.
1.3.2.2 Галий - типичный рассеянный элемент, обладающий двойной геохимической природой. Среднее содержание галлия в земной коре - 1, 9•10-3 %. Ввиду близости его кристаллохимических свойств с главными породообразующими элементами (Al, Fe и др.) и широкой возможности изоморфизма с ними галлий не образует больших скоплений, несмотря на значительную величину кларка. Выделяются следующие минералы с повышенным содержанием галлия: сфалерит (0 % - 0, 1 %), магнетит (0 % - 0, 003 %), касситерит (0 % - 0, 005 %), гранат (0 % - 0, 003 %), берилл (0 % - 0, 003 %), турмалин (0 % - 0, 01 %), сподумен (0, 001 % - 0, 07 %), флогопит (0, 001 % - 0, 005 %), биотит (0 % - 0, 1 %), мусковит (0 % - 0, 01 %), серицит (0 % - 0, 005 %), лепидолит (0, 001 % - 0, 03 %), хлорит (0 % - 0, 001 %), полевые шпаты (0 % - 0, 01 %), нефелин (0 % - 0, 1 %), гекманит (0, 01 % - 0, 07 %), натролит (0 % - 0, 1 %). Концентрация галлия в морской воде 3•10-5 мг/л. Месторождения галлия известны в Юго-Западной Африке, России, странах СНГ [11].
1.3.2.3 Индий рассеянный редкий металл, среднее содержание индия в земной коре - 2, 5•10-5 % и его соединения с уникальными свойствами получили промышленное признание в высокотехнологичных отраслях производства в 1970-1990 гг. прошлого столетия. Он является естественным спутником Zn, Cu, Pb и Sn, т.е. особо ценным компонентом различных видов сульфидного сырья с содержанием 20 г/т индия и получаемых из них минеральных концентратов - цинковых (2-800 г/т), медных (до 100 г/т), свинцовых (1-10 г/т) и оловянных (10-124 г/т).
Основные зарубежные производства индия преимущественно базируются на импорте его концентратов из Китая. Собственным производством индия страны потребители обеспечены примерно на 30 %. Однако, в ближайшие 20 лет прогнозируется истощение зарубежных запасов цинковых руд как основного источника индия.
Россия импортирует как индийсодержащие цинковые концентраты, прежде всего, из Казахстана (Акжал), так и в небольших объемах металл высокой чистоты. Экспортируется порядка 2 т индия технического сорта. Главным предприятием-производителем металлического индия является ОАО "Челябинский цинковый завод" (ОАО "ЧЦЗ"), мощности которого составляют 12 т/год, а производство снизилось из-за недостатка сырья. Цинковые (сфалеритовые) концентраты поставляются ОАО "Учалинский ГОК" и "Гайский ГОК" холдинга УГМК, который приобрел ОАО "Электроцинк", перенаправил туда необходимые концентраты и планирует выпуск индия до 5 т/год. Всего с извлечением индия на Урале разрабатываются шесть медно-колчеданных месторождений с коэффициентом извлечения в сфалеритовый концентрат на Учалинской ОФ 48, 67 %, а на Сибайской - 3, 7 %. Если в рудах Учалинского ГОКа содержание индия составляет 5, 6-9, 7 (до 12) г/т, а в складируемых пиритных отходах обогащения 9, 5 г/т, то в хвостохранилище накоплено более 184 т индия. В шлаках медеплавильных заводов Урала содержится 8, 5-44 г/т и накоплено 153, 4 т индия.
Запасы индия в России учитываются в 59 месторождениях Cu-Zn-х колчеданных и полиметаллических, свинцово-цинковых жильных и скарновых, оловянно-сульфидных руд, из которых 17 эксплуатируется без извлечения индия с запасами в них до 30 % от учтенных. В нераспределенном фонде 32 месторождения с запасами индия более 50 % от учтенных. С медно-колчеданными месторождениями Урала связано 60 % запасов индия, который ассоциирует с Sb, Ge, Ga, Se, Te, возможно с Re, благородными металлами, а также с Cd, As, Tl и другими особо ценными и экологически лимитируемыми микрокомпонентами.
Таким образом, Россия обладает достаточными природными и техногенными ресурсами, а также технологическим потенциалом развития производств индиевой и другой сопутствующей особо ценной металлопродукции, в том числе в целях поэтапного импортозамещения и инновационного развития экономики.
1.3.2.4 Таллий - рассеянный элемент, его содержание в земной коре 1•10-4 %. Содержится в обманках и колчеданах цинка, меди и железа, в калийных солях и слюдах. Таллий - тяжелый металл. Известно лишь семь минералов таллия (круксит (Cu, Tl, Ag)2Se, лорандит TlAsS2, врбаит Tl4Hg3Sb2As8S20, гутчинсонит (Pb, Tl)S•Ag2S•5As2S5, авиценнит Tl2O3), все они крайне редкие. Главная масса таллия связана с сульфидами и прежде всего с дисульфидами железа. В пирите он установлен в 25 % проанализированных образцов. Его содержание в дисульфидах железа нередко составляет 0, 1 % - 0, 2 %, а иногда достигает 0, 5 %. В галените содержание таллия колеблется от 0, 003 % до 0, 1 % и редко более. Высокие концентрации таллия в дисульфидах и галенитах характерны для низкотемпературных свинцово-цинковых месторождений в известняках. Содержание таллия, достигающее 0, 5 %, отмечается в некоторых сульфосолях. Небольшое количество таллия встречается во многих других сульфидах, например, в сфалеритах и халькопиритах некоторых медно-колчеданных месторождений, содержание колеблется от 25 до 50 г/т. Наибольшее геохимическое сходство таллий имеет с K, Rb, Cs, а также с Pb, Ag, Cu, Bi. Таллий легко мигрирует в биосфере. Из природных вод он сорбируется углями, глинами, гидроксидами марганца, накапливается при испарении воды (например, в озере Сиваш до 5•10-8 г/л). Содержится в калиевых минералах (слюде, полевых шпатах), сульфидных рудах: галените, сфалерите, марказите (до 0, 5 %), киновари. Как примесь присутствует в природных оксидах марганца и железа [9].
Среднее содержание таллия (по массе):
- в земной коре 4, 5•10-5 %
- в ультраосновных породах 10-6 %
- в основных породах 2•10-5 %
Природный таллий состоит из двух стабильных изотопов: 205Tl (содержание 70, 5 % по массе) и 203Tl (29, 5 %). В ничтожных количествах встречаются радиоактивные изотопы таллия: 201Tl, 204Tl (Т1/2 = 3, 56 года), 206Tl (Т1/2 = 4, 19 мин), 207Tl (Т1/2 = 4, 78 мин), 208Tl (Т1/2 = 3, 1 мин) и 210Tl (Т1/2 = 1, 32 мин), являющиеся промежуточными членами рядов распада урана, тория и нептуния.
1.3.2.5 Германия общее содержание в земной коре 1, 4•10-4 % по массе, т.е. больше, чем, например, сурьмы, серебра, висмута. Германий вследствие незначительного содержания в земной коре и геохимического сродства с некоторыми широко распространенными элементами обнаруживает ограниченную способность к образованию собственных минералов, внедряясь в кристаллические решетки других минералов. Поэтому собственные минералы германия встречаются исключительно редко. Почти все они представляют собой сульфосоли: германит Cu2(Cu, Fe, Ge, Zn)2 (S, As)4 (6 % - 10 % Ge), аргиродит Ag8GeS6 (3, 6 % - 7 % Ge), конфильдит Ag8(Sn, Ge) S6 (до 2 % Ge) и другие редкие минералы (ультрабазит, ранерит, франкеит). Основная масса германия рассеяна в земной коре в большом числе горных пород и минералов. Так, например, в некоторых сфалеритах содержание германия достигает в энаргитах до 5 кг/т, в пираргирите до 10 кг/т, в сульваните и франкеите 1 кг/т, в других сульфидах и силикатах - сотни и десятки г/т. Германий концентрируется в месторождениях многих металлов - в сульфидных рудах цветных металлов, в железных рудах, в некоторых окисных минералах (хромите, магнетите, рутиле и др.), в гранитах, диабазах и базальтах. Кроме того, германий присутствует почти во всех силикатах, в некоторых месторождениях каменного угля и нефти. Концентрация германия в морской воде 6•10-5 мг/л [14].
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоемких операций по обогащению руды и ее концентрированию германий выделяют в виде оксида GeO2.
1.3.2.6. Гафния общее содержание в земной коре 1, 0•10-4 %. Как спутник циркония, в основном, извлекается из цирконовых (ZrSiO4) концентратов, добываемых из прибрежно-морских россыпных месторождений (Австралия, ЮАР, в меньшей степени США, Бразилия, Индия, Украина). Однако, его извлечение осуществляется из 3 % - 5 % цирконовых концентратов, перерабатываемых в целях получения циркония для ядерных реакторов; преобладающее количество циркона используется в производствах огнеупоров, стекол и керамики. Соотношение гафния с цирконием в цирконах варьируется от 1:50 до 1:100.
Россия обладает различными технологиями производства металлического (электролиз хлоридов и фторидов) и особо чистого гафния (йодистым способом с электронно-лучевой плавкой). Разработана кальциетермическая технология восстановления тетрафторида гафния с использованием индукционных печей и получением слитков до 400 кг, которая, однако, не позволяет получать гафний, соответствующий требованиям атомной энергетики. Применение на АО "Чепецкий механический завод" (АО "ЧМЗ") в г. Глазове (Удмуртия) технологии, основанной на различной растворимости в воде фторидов циркония и гафния, обусловило накопление складских запасов 6 % - 8 % гафниевых концентратов при дефиците реакторного гафния.
Сырьевые ресурсы гафния в нашей стране представлены разведанными запасами циркония в месторождениях Ti-Zr-х россыпных месторождений европейской части (Центральное, Лукояновское, Бешпагирское и др.) и юга Сибири (Туганское, Тарское). Все они легкодоступны, но различаются содержанием таких сопутствующих высоколиквидных компонентов как к.п.ш., глауконит, монацит и др., а также и лимитируемых (хром, торий, уран), и мощностями пород вскрыши. Наиболее ценное циркон-рутил-ильменитовое сырье сосредоточено в двух лицензированных месторождениях - Лукояновском (Нижегородская обл.) и Туганском (Томская обл.). Это позволяет рассчитывать на решение в ближайшей перспективе проблемы обеспечения российской промышленности и, прежде всего, производств госкорпорации "Росатом" как собственным цирконем, так и сопутствующим ему гафнием.
Однако пока единственным источником минеральной циркониевой продукции с сопутствующим гафнием в нашей стране является ОАО "Ковдорский ГОК". Эта продукция представлена уникальным бадделеитовым концентратом, который нигде в мире, кроме Ковдора, не выпускается. В результате изучения коренных апатитмагнетитовых руд, содержащих бадделеит, и хвостов их обогащения, установлена и реализована возможность извлечения из этих отходов ковдорского производства апатита и бадделеита. Согласно исследованиям ОАО "Гинцветмет" в бадделеитах Ковдора, кроме естественных радионуклидов, выявлено стабильно высокое содержания гафния (13-15 кг/т) как изоморфного спутника циркония, а также скандия (200 г/т), оксидов тантала (1-1, 5 кг/т) и ниобия (1, 8-4, 7 кг/т), суммы оксидов редких земель (130-150 г/т). Таким образом, содержание указанных редких металлов определяет повышенную извлекаемую ценность ковдорского бадделеита, что ориентирует на увеличение стоимости товарных бадделеитовых концентратов не только как природного диоксида циркония, но и как высококомплексного редкометального продукта, не имеющего аналогов за рубежом. Соотношение гафния с цирконием в бадделеитовых концентратах Ковдора 1:6 значительно выше, чем в цирконах, что ориентирует на использование их в качестве источника реакторного компонента с организацией извлечения на АО "ЧМЗ".
В связи с организацией промышленного освоения лопарит-эвдиалитовых руд Ловозера в качестве крупного и стабильного источника иттриевоземельных среднетяжелых РЗМ с сопутствующим цирконием представляется целесообразным оценить и перспективы извлечения гафния из эвдиалитовых концентратов. Содержание в них 1, 6-1, 8 кг/т гафния ниже, чем в цирконовом сырье примерно в 10 раз, в то время как соотношение гафния с цирконием примерно сопоставимо. Однако, эвдиалитовое сырье выгодно отличается практически неограниченными запасами, доступностью, локализацией в пределах инфраструктуры действующего Ловозерского ГОКа, комплексностью и высокой ликвидностью содержащихся в нем редких металлов, отсутствием радиоактивности, легкой растворимостью и легкоплавкостью и наличием разработанных технологических схем как обогащения, так и переделов.
1.3.2.7 Селена содержание в земной коре 5•10-6 %. Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se, S)3, хастит CoSe2, платинит PbBi2(S, Se)3, ассоциирующие с различными сульфидами, а иногда также с касситеритом. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4•10-4 мг/л [7]. На территории Кавказских Минеральных Вод встречаются источники с содержанием Se от 50 мкг/дм3. Значительные количества селена получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения: окислительный обжиг с возгонкой SeO2; нагревание шлама с концентрированной серной кислотой, окисление соединений селена до SeO2 с его последующей возгонкой; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se (IV) и их восстановление до элементарного селена действием SO2.
1.3.2.8 Теллура содержание в земной коре 1•10-7 % по массе. Известно около 100 минералов теллура. Наиболее часты теллуриды меди, свинца, цинка, серебра и золота. Изоморфная примесь теллура наблюдается во многих сульфидах, однако изоморфизм Te - S выражен хуже, чем в ряду Se - S, и в сульфиды входит ограниченная примесь теллура. Среди минералов теллура особое значение имеют алтаит (PbTe), сильванит (AgAuTe4), калаверит (AuTe2), гессит (Ag2Te), креннерит [(Au, Ag)Te], петцит (Ag3AuTe2), мутманнит [(Ag, Au)Te], монбрейит (Au2Te3), нагиагит ([Pb5Au(Te, Sb)]4S5), тетрадимит (Bi2Te2S). Встречаются кислородные соединения теллура, например, ТеО2 - теллуровая охра. Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0, 17 % Те и 0, 06 % Se). Большая часть упомянутых минералов развита в низкотемпературных золото-серебряных месторождениях, где они обычно выделяются после основной массы сульфидов совместно с самородным золотом, сульфосолями серебра, свинца, а также с минералами висмута. Несмотря на развитие большого числа теллуровых минералов, главная масса теллура, извлекаемого промышленностью, входит в состав сульфидов других металлов. В частности, теллур в несколько меньшей степени, чем селен, входит в состав халькопирита медно-никелевых месторождений магматического происхождения, а также халькопирита, развитого в медно-колчеданных гидротермальных месторождениях. Теллур находится также в составе пирита, халькопирита, молибденита и галенита месторождений порфировых медных руд, полиметаллических месторождений алтайского типа, галенита свинцово-цинковых месторождений, связанных со скарнами, сульфидно-кобальтовых, сурьмяно-ртутных и некоторых других. Содержание теллура в молибдените колеблется в пределах 8-53 г/т, в халькопирите 9-31 г/т, в пирите - до 70 г/т. Основной источник - шламы электролитического рафинирования меди и свинца.
1.3.3. Редкоземельные металлы
К группе редкоземельных металлов (РЗМ) относится семейство из 14 элементов с порядковыми номерами от 58 (церий) до 71 (лютеций), расположенных в VI периоде периодической системы Д.И. Менделеева. Обычно в эту группу включают и лантан, а элементы называют лантаноидами. Кроме того, к лантаноидам примыкает химический аналог лантана - элемент третьей группы иттрий и скандий. Он близок по свойствам к лантаноидам и часто сопутствует им в минеральном сырье. По физико-химическим свойствам лантаноиды сходны между собой.
В отличие от лития и бериллия задачи возрождения и развития производств РЗМ в России решаются в рамках государственной подпрограммы N 15 "Развитие промышленности редких и редкоземельных металлов", которая предусматривает реализацию НИОКР в 2013-2016 гг. Россия вынуждена фактически заново воссоздавать всю технологическую последовательность редкоземельных производств - от добычи и обогащения исходного сырья до химико-металлургических переделов, выпуска групповых концентратов РЗМ, индивидуальных редкоземельных оксидов и других соединений и готовых изделий, причем в условиях внешней конкурентной среды и отсутствия внутреннего рынка.
Сырьевая база РЗМ Российской Федерации является одной из крупнейших в мире.
Особенность минерально-сырьевой базы России состоит в том, что РЗМ в основном выступают в качестве попутных компонентов в комплексных рудах. В большинстве российских месторождений массовая доля РЗМ ниже, чем в зарубежных, и редко превышает 1 %. Большая часть запасов РЗМ учитывается в апатит-нефелиновых месторождениях, где их содержание невелико, а извлечение, как правило, нерентабельно даже при условии разработки этих месторождений на другие виды сырья. Имеющиеся в России крупные объекты с уникально богатыми рудами часто размещены в отдаленных районах со слабо развитой инфраструктурой, а руды их труднообогатимы. За рубежом разрабатываемые на РЗМ месторождения сложены в основном мономинеральными легкообогатимыми рудами со средним содержанием до 10 % ∑TR2O3. Это бастнезитовые карбонатиты Китая и США, богатые россыпи с монацитом и ксенотимом в Индии, Австралии, Бразилии, коры выветривания щелочных гранитов и алюмосиликатных пород в Китае и Бразилии.
Распределение запасов и прогнозных ресурсов по территории страны неравномерно. Более 90 % запасов РЗМ категорий А+В+С1+С2 сосредоточено в двух регионах - Мурманской области и Республике Саха (Якутия). В девяти апатит-нефелиновых месторождениях Хибинской группы в Мурманской области заключено около 11 млн т РЗМ или 55 % российских запасов категорий А+В+С1+С2. Основным компонентом их руд является фосфор, РЗМ играют роль попутных при низких их концентрациях: среднее содержание составляет 0, 34 % ∑TR2O3.
Еще около 16 % запасов редкоземельных металлов, преимущественно цериевой группы сосредоточено в лопаритовых рудах титан-ниобий-тантал-редкоземельного Ловозерского месторождения. Это единственный объект в России, где ведется извлечение попутных РЗМ в концентраты для их дальнейшей переработки в индивидуальные оксиды и соединения РЗМ. Содержание в рудах отрабатываемых участков Карнасурт и Кедыквырпахк - 1, 39 % ∑TR2O3. Месторождения, подобные Ловозерскому, нигде более в мире на РЗМ не разрабатываются.
Прогнозные ресурсы РЗМ в Мурманской области не локализованы.
В Республике Саха (Якутия) сосредоточено 4, 5 млн т запасов РЗМ категорий А+В+С1+С2 или 16, 8 % российских. Здесь располагаются Томторское и Селигдарское коренные месторождения и техногенное золото-редкоземельное россыпное Куларское месторождение.
Томторское месторождение имеет небольшие разведанные запасы, но по прогнозным ресурсам является одним из крупнейших в мире. Месторождение также характеризуется значительными запасами фосфора, железа, скандия и ниобия. Основное количество запасов редких и редкоземельных металлов Томторского месторождения разведано в пределах Буранного участка; они составляют 119, 3 тыс. т или 0, 4 % российских. Комплексные редкометальные руды, приуроченные к корам выветривания карбонатитов, содержат 12, 4 4 % ∑TR2O3, имеют сложный состав, по набору минералов не имеющий аналогов в мире, характеризуются тонкодисперсными выделениями рудных минералов, их тесными взаимопрорастаниями и весьма сложны для переработки. Месторождение находится в районе с суровыми климатическими условиями и неразвитой инфраструктурой.
На участках Северный и Южный Томторского рудного поля локализовано около 214, 5 тыс. т прогнозных ресурсов категории Р1 и 3, 8 млн т категории Р2.
В рудах крупного Селигдарского апатитового месторождения, связанного с карбонатитами, РЗМ цериевой группы выступают как попутные компоненты, с низкой концентрацией в рудах (около 0, 35 %). При этом их запасы достигают 4, 4 млн т или 16, 4 % российских.
В Забайкальском крае разведано крупное Катугинское тантал-ниобиевое месторождение, связанное с редкометальными щелочными гранитами, с запасами РЗМ категории С2 в количестве 791, 8 тыс. т или 2, 9 % российских. Среднее содержание ∑TR2O3 в его рудах - около 0, 25 %, при этом относительная массовая доля тяжелых РЗМ составляет от 30 % до 40 %, на отдельных участках содержание элементов иттриевой группы достигает 0, 8 % - 1, 2 %. Преимуществом объекта является его приуроченность к горнопромышленному узлу, включающему Удоканское, Чинейское и другие месторождения.
Прогнозные ресурсы РЗМ в Забайкальском крае не выявлены.
С редкометальными щелочными гранитами связано и среднее по запасам РЗМ Улуг-Танзекское тантал-ниобиевое месторождение в Республике Тыва. Концентрации редких земель в его рудах убогие, всего 0, 06 % ∑TR2O3.
Прогнозные ресурсы РЗМ республики локализованы в Арысканском рудопроявлении редкоземельноциркониевых руд в щелочных гранитах (30 тыс. т категории Р1); в его пределах выявлены зоны с богатым жильным и вкрапленным оруденением, причем в рудах преобладают РЗМ иттриевой группы (тулий).
Определенные перспективы наращивания запасов связываются с Карасугским месторождением в бастнезитовых карбонатитах, аналогичных карбонатитам Байюнь-Обо и Маунтин-Пасс, прогнозные ресурсы категории Р1 составляют 115 тыс. т.
В Иркутской области расположено крупное Белозиминское апатит - редкометальное месторождение, приуроченное к коре выветривания карбонатитов. Его запасы, разведанные по категории С2, насчитывают 1, 6 млн т. Прогнозные ресурсы в Иркутской области не выявлены.
В Красноярском крае разведано среднее по запасам РЗМ Чуктуконское ниобий-редкоземельное месторождение руд, связанное с корами выветривания карбонатитов, сходное с Томторским месторождением; его запасы категории С2 составляют 486 тыс. т. Тонкодисперсные пирохлор-монацитовые руды очень богаты РЗМ и содержат 7, 32 % ∑TR2O3. На флангах Чуктуконского месторождения локализованы ресурсы РЗМ категории Р1 в количестве 1200 млн т.
На территории Республики Коми располагается небольшое по запасам РЗМ Ярегское нефтетитановое месторождение, представляющее собой древнюю погребенную литифицированную россыпь, в убогих рудах которой содержится в среднем 0, 039 % ∑TR2O3, в основном в лейкоксене и цирконе.
Государственным балансом запасов полезных ископаемых Российской Федерации по состоянию на начало 2016 г. учитываются 17 месторождений с запасами редкоземельных металлов. В распределенном фонде недр учитываются 13 месторождений с запасами в количестве 12, 2 млн т, не переданы в освоение четыре объекта, заключающие 14, 7 млн т ∑TR2O3, в том числе Чуктокунское месторождение богатых редкометально-редкоземельных руд.
Государственным балансом запасов полезных ископаемых впервые учитываются запасы РЗМ месторождения апатит-нефелиновых руд Участок Ийолитовый отрог в Мурманской области, подсчитанные в количестве 6, 16 тыс. т категории С1 в ходе переоценки, проведенной АО "Апатит". Компания ведет подготовку к эксплуатации участка открытым способом.
В 2015 г. ГУГГП РС(Я) "Якутскгеология" велись геологоразведочные работы на участках Южный и Северный Томторского месторождения с целью оценки запасов редкометальных руд. Ожидается, что по результатам оценочных работ запасы ∑TR2O3 категорий C1 + C2 превысят 1 млн т.
ЗАО УГРК "Уранцветмет" на средства федерального бюджета ведет доразведку техногенных отвалов Куларского россыпного месторождения в Республике Саха (Якутия), расположенного в МО "Усть-Янский улус (район)". Предусмотрена разработка ТЭО временных разведочных кондиций с подсчетом запасов РЗМ и попутного россыпного золота, а также локализация прогнозных ресурсов.
Прирост запасов РЗМ за счет геологоразведочных работ в 2015 г. был незначительным, весь он получен за счет постановки на государственный учет запасов попутных РЗМ месторождения Участок Ийолитовый отрог. Это позволило компенсировать менее 10 % убыли запасов категорий А + В + С1 при добыче.
В результате переоценки по новым разведочным кондициям уменьшились запасы РЗМ категорий А + В + С1 на Юкспорском месторождении на 202, 9 тыс. т, на Кукисвумчоррском - на 20, 2 тыс. т.
С учетом прироста по итогам геологоразведочных работ, добычи, потерь при добыче, переоценки, списания и других причин 2015 г. запасы РЗМ категорий А + В + С1 уменьшились на 311, 2 тыс. т или на 1, 7 %, запасы категории С2 - на 1, 9 тыс. т или на 0, 1 %.
Добыча редкоземельных металлов в России незначительна, она составляет 8090 тыс. т в год, причем из этого количества извлекается в концентраты и поступает на дальнейшую переработку менее 5 % добытых РЗМ. В 2015 г. добыто 87, 2 тыс. т, что на 2, 9 % больше, чем годом ранее.
Вся добыча РЗМ сосредоточена в Мурманской области. Большую часть (79, 8 % в 2015 г.) извлекает из недр объединение АО "Апатит", в состав которого входят Кировский, Расвумчоррский и Восточный рудники. Добыча ведется на шести месторождениях апатит-нефелиновых руд - Юкспорском, Апатитовый цирк, Плато Расвумчорр, Ньоркпахкском, Коашвинском и Кукисвумчоррском. В 2015 г. добыто 69, 6 тыс. т РЗМ, что на 4 % меньше, чем годом ранее. Из добываемых апатит-нефелиновых руд вырабатывается апатитовый и нефелиновый концентраты. Содержащиеся в апатитовых концентратах редкие земли не извлекаются, однако на ряде российских предприятий (ПАО "ФосАгро", г. Великий Новгород, ОАО "Гидрометаллургический завод" в г. Лермонтов Ставропольского края, ГК "Скайград" в г. Юбилейный Московской обл., АО "ФосАгроЧереповец" в г. Череповец) велось опытное производство РЗМ-продукции из апатита и фосфогипса.
ЗАО "Северо-Западная фосфорная компания" на апатит-нефелиновом месторождении Олений Ручей в 2015 году добыла 14, 9 тыс. т РЗМ. Относительно предыдущего года добыча увеличилась на 5 тыс. т или 33, 5 % и составила 17 % от всей российской добычи.
ООО "Ловозерский ГОК" ведет добычу лопаритовых руд, содержащих попутные РЗМ цериевой группы Ловозерского месторождения в Мурманской области. Добыча ведется на двух участках - Карнасурт и Кедыквырпахк. Это единственное в России месторождение, из руд которого осуществляется извлечение РЗМ попутно с титаном, танталом и ниобием. В 2015 г. на руднике Карнасурт добыто 159 тыс. т руды, содержащей 2, 7 тыс. т РЗМ. По сравнению с предыдущим годом добыча РЗМ увеличилась на 0, 5 тыс. т.
Переработка добытой лопаритовой руды производится на Карнасутской обогатительной фабрике. В 2015 г. на ней переработано 394, 24 тыс. т руды с содержанием лопарита 2, 4 %, из которой получено 7816 т лопаритового концентрата с содержанием лопарита 97, 25 %.
Весь лопаритовый концентрат для дальнейшей переработки направляется на Соликамский магниевый завод (СМЗ), выпускающий из него разнообразную редкоземельную продукцию: карбонаты и оксиды Sm, Eu, Gd, La, Nd, Pr, Ce, дидима (смесь оксидов Pr + Dy), азотнокислые растворы РЗМ, а также оксиды и хлориды Nb и Ta и титановую губку. Объем переработанного на СМЗ лопаритового концентрата в 2015 г. составил 8509 т, на 10, 5 % больше, чем в предыдущем году. Производство РЗМ-продукции увеличилось на 178 т или на 8 % относительно 2014 г. и составило 2312 т. Это не превысило 2 % выпуска соединений РЗМ в мире; роль России в этой отрасли незначительна и несопоставима с вкладами ведущих продуцентов - Китая, Австралии, Индии.
Производство исходных карбонатов в 2015 г. на СМЗ составило 1553, 6 т. Карбонаты РЗМ имеют ограниченную сферу применения и в основном используются для производства частично разделенных и индивидуальных РЗМ. В 2013 г. на Соликамском магниевом заводе организована линия по разделению коллективных соединений РЗМ и ведется разделение части выпускаемого смешанного продукта. В 2015 г. на заводе выпущено 758, 7 т разделенных продуктов.
Небольшая часть (около 10 % в 2015 г.) произведенных на СМЗ соединений редкоземельных металлов, как коллективных, так и разделенных, отправляется отечественным потребителям. В 2015 г. на внутреннем рынке продано 228, 6 т, в том числе 4, 9 т в составе исходных карбонатов и 223, 7 т в составе разделенных продуктов.
Объем поставок растет второй год подряд, причем это происходит исключительно за счет разделенных продуктов. За период 2013-2015 гг. продажи коллективных соединений российским потребителям снизились почти на порядок, в то время как поставки разделенных продуктов выросли почти в тридцать пять раз.
Продукция Соликамского магниевого завода отличается высоким качеством и востребована на мировом рынке. Однако мощностей по разделению редких земель в России недостаточно, поэтому основная масса карбонатов РЗМ производства Соликамского магниевого завода поставляется компании AS Silmet в Эстонию и Иртышской редкоземельной компании в Казахстан, где эти соединения перерабатываются в разделенные продукты и металлы. Суммарно было экспортировано 2083, 7 т различных соединений РЗМ, в том числе 1548, 7 т в виде исходных карбонатов и 535 т в составе продуктов разделения.
Динамику мировых цен на редкоземельную продукцию определяет их главный поставщик - Китай. До 2010 г. продукция китайского производства продавалась на мировом рынке по демпинговым ценам, что привело к закрытию практически всех РЗМ-производств за пределами Китая из-за нерентабельности и беспрецедентной монополизации отрасли. В этот же период в КНР была налажена полная производственная цепочка от добычи РЗМ до выпуска индивидуальных элементов и синтезированных соединений по эффективной технологии, позволяющей получать металлы со степенью очистки 99, 9999 %.
В 2010 г. Китай резко сократил экспортные квоты, что привело к скачку мировых цен к середине 2011 г. в 5-10 и более раз и, как следствие, к наращиванию мощностей по производству РЗМ за пределами Китая и появлению технологий, позволяющих сократить потребности в РЗМ. Это, в свою очередь, оказало давление на цены, которые снижаются, начиная с 2012 г. Так, экспортная цена на оксид церия в начале 2012 г. достигала 45 долл./кг, а в начале 2016 г. - всего 1, 8 долл./кг, цена на оксид европия снизилась с 2000 долл./кг до 83 долл./кг.
Потребление РЗМ в Российской Федерации составляет менее 2 тыс. т в год. В то же время поставки продукции Соликамского магниевого завода удовлетворяют лишь небольшую часть внутреннего спроса на них, что связано с нехваткой мощностей по разделению редких земель.
Большая часть необходимых российской промышленности редкоземельных продуктов закупается за рубежом. Импорт в 2015 году составил 4851 т, из них 3181 т (65, 6 %) закуплены в Китае, 1399 т или 28, 8 % - в Казахстане, остальное импортировано из Эстонии, Австрии, Индии, Германии, Франции. В последние годы увеличиваются зарубежные закупки иттрия и металлов иттриевой группы.
Области применения редкоземельных металлов в России разнообразны. Порядка 70 % всех РЗМ потребляет электроника. Несколько сотен тонн РЗМ ежегодно необходимо при выпуске катализаторов для нефтепереработки; для производства постоянных Nd-Fe-B-магнитов требуется более 100 т РЗМ в год; до 40 т ежегодно используется в производстве оптического стекла и оптики. Спрос в других отраслях составляет от нескольких тонн до нескольких десятков тонн.
Ведущими потребителями РЗМ в России являются Государственная корпорация "Ростех" в лице ее предприятий АО "Росэлектроника", АО "Объединенная двигательная корпорация", холдинг "Швабе", и Государственная корпорация "Росатом". Относительно крупные закупки (более сотни тонн РЗМ в год) осуществляют нефтеперерабатывающие компании. В целом лишь около четверти РЗМ используется для производства продукции гражданского назначения, остальное - для выпуска изделий военно-технического назначения.
Сырьевая база редкоземельных металлов России очень велика и может удовлетворить потребность в них, даже в случае значительных темпов ее роста. Однако освоение отечественных месторождений сдерживается низким спросом на РЗМ из-за слабого развития в России высокотехнологичных производств.
1.3.3.1. Скандий
Несмотря на свое преимущественно рассеянное состояние в природных сырьевых источниках. Исключением является тортвейтит - (Sc, Y)2Si2O7 - собственный минерал скандия. По данным ФГУП "ИМГРЭ" тортвейтит обнаружен в хвостах обогащения флюоритового сырья в России (Кумир в Алтайском крае), где содержащие его грейзены обогащены иттрием (191 г/т) и скандием (50-150 г/т). Однако, в качестве основных и потенциальных промышленных источников скандия, как типичного элемента попутной добычи, рассматриваются месторождения урановых руд, титанового сырья (ильменита, рутила, титаномагнетита), фосфатов, бокситов, вольфрамита, касситерита, РЗМ и циркона.
Разведанное в нашей стране скандийсодержащее сырье представлено титаново-цирконовой россыпью (с рутилом и ильменитом) Туганского месторождения в Томской области (108 г/т). Наиболее реальными объектами для организации ускоренного производства скандиевой продукции представляются отходы или возобновляемые техногенные ресурсы трех действующих производств:
1) красные шламы бокситов;
2) силикатные (пироксеновые) хвосты обогащения титаножелезорудного сырья ОАО "Качканарский ГОК" со средним содержанием 100-150 г/т Sc, обнаруженным Л.Ф. Борисенко (ФГУП "ИМГРЭ") еще в середине прошлого века;
3) бадделеитсодержащие силикатные хвосты обогащения редкометально-фосфатно-железорудного сырья ОАО "Ковдорский ГОК" холдинга "Еврохим", содержащие 690 г/т Sc2О3 в отходах ММС и 580 г/т в пылях доводки при содержании в бадделеитовых концентратах от 250 до 770 г/т. Эти данные являются дополнительными аргументами в пользу рекомендуемой с начала 1990-х гг. техногеохимической ревизии производства Ковдорского ГОКа на широкий перечень дефицитных редких металлов (Ta, Hf, Sc и др.), включая вовлекаемые в добычу и обогащение новые виды сырья - апатитовые и штаффелитовые руды, а также все хвосты обогащения и промпродукты.
В России производство скандиевой продукции осуществляется Лермонтовским ПО "Алмаз" в Ставропольском крае, которое ранее производило порядка 0, 5 т/год. Это предприятие ранее перерабатывало концентрат скандия, выпускавшийся из отходов Сумского "Химпрома" и КГПО "Титан", которые производили титановые пигменты. В настоящее время на ПО "Алмаз" воссоздано опытное производство алюмоскандиевых лигатур. Подобное опытное производство организуется Инженерно-технологическим центром компании "РУСАЛ" на Уральском заводе за счет переработки красных шламов - объемного отхода обогащения бокситов. Извлечение из них скандия в концентрат достигло 43 %.
В настоящее время развитие ОПК и других высокотехнологичных отраслей промышленности России, включая космические, ориентирует на ускоренное восстановление производства скандия из отечественного сырья и соответствующее импортозамещение.
1.3.3.2 Иттрий - химический аналог лантана. Кларк иттрия 2, 9•10-3 %, содержание в морской воде - 0, 0003 мг/л [13]. Иттрий почти всегда содержится вместе с лантаноидами в минеральном сырье. Несмотря на неограниченный изоморфизм, в группе редких земель в определенных геологических условиях возможна раздельная концентрация редких земель иттриевой и цериевой подгрупп. Например, с щелочными породами и связанными с ними постмагматическими продуктами преимущественное развитие получает цериевая подгруппа, а с постмагматическими продуктами гранитоидов с повышенной щелочностью - иттриевая. Большинство фторкарбонатов обогащено элементами цериевой подгруппы. Многие тантало-ниобаты содержат иттриевую подгруппу, а титанаты и титано-тантало-ниобаты - цериевую. Главнейшие минералы иттрия - ксенотим YPO4, гадолинит Y2FeBe2Si2O10.
1.3.3.3 Лантаноиды подразделяются на две группы цериевую (La, Ce, Pr, Nd, Pm, Sm, Eu) и иттриевую (Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Y). Это деление сначала основывалось на различии в растворимости двойных сульфатов, образуемых лантаноидами с сульфатами натрия или калия. В последующем была установлена периодичность в изменении некоторых свойств внутри семейства лантаноидов, соответствующая их разделению на две подгруппы.
В последнее десятилетие лантаноиды разделяют на легкую (La, Се, Рr, Nd) и тяжелую группы (остальные). Иногда выделяют среднетяжелую группу (Sm, Eu, Gd).
Лантаноиды - металлы серебристо-белого цвета. Некоторые из них имеют слегка желтоватый цвет (например, Pr и Nd). Точки плавления элементов подгруппы церия ниже, чем элементов подгруппы иттрия. У самария, европия и иттербия, проявляющих валентность 2+, точки кипения значительно ниже, чем у других лантаноидов.
Лантаноиды высокой чистоты пластичны и легко поддаются деформации (ковке, прокатке). Все лантаноиды и лантан парамагнитны некоторые из них (Gd, Dy, Ho) проявляют ферромагнитные свойства.
Лантаноиды отличаются высокой химической активностью. Они образуют прочные оксиды, галогениды, сульфиды, реагируют с водородом, углеродом, углеводородами, оксидом и диоксидом углерода, азотом, фосфором.
Оксиды лантаноидов отличаются химической прочностью и плавятся при высоких температурах. Так, СeO2 плавится при температуре - 2500 °С, La2O3 - выше 2000 °С.
Хлориды, сульфаты и нитраты трехвалентных лантаноидов растворимы в воде и кристаллизуются большей частью в виде кристаллогидратов различного состава.
Фториды и оксалаты малорастворимы в воде и разбавленных минеральных кислотах.
К труднорастворимым в воде солям РЗМ относятся также фосфаты, карбонаты и ферроцианиды.
Соотношение между отдельными элементами в минералах сильно колеблется.
Один из основных источников получения элементов цериевой подгруппы - монацит - обычно встречается в пегматитах, иногда гранитах и гнейсах. При разрушении коренных пород он переходит в россыпи (речные и морские) вместе с ильменитом, цирконом, магнетитом и другими минералами.
В России промышленным сырьевым источником РЗМ служит лопарит, месторождения которого расположены на Кольском полуострове.
Лопаритовые руды легко обогащаются с получением концентратов, содержащих 80 % - 90 % минерала. При их переработке лантаноиды извлекают попутно с ниобием, танталом и титаном. В настоящее время получаемый на Ловозерском ГОКе концентрат поступает на Соликамский магниевый завод, который выпускает дезактивированные карбонаты РЗМ. Объем выпуска в пересчете на оксиды составляет от 2, 0 до 2, 8 тыс. т. Почти весь объем произведенных карбонатов РЗМ поставляется на экспорт, главным образом в КНР и Вьетнам.
Крупнейшими потенциальными источниками РЗМ является руда месторождения Томтор (сумма РЗМ - до 20 %), а также источником РЗМ может являться Красноуфимский монацитовый концентрат (сумма РЗМ ~ 40 %). Технологии переработки этих продуктов разработаны в рамках государственной подпрограммы "Развитие производства редких и редкоземельных металлов".
Самая значительная доля запасов РЗМ от суммы учтенных государственным балансом в РФ связана с апатитовыми рудами Хибинской группы. Несмотря на незначительное содержание РЗМ (~ 1 %), учитывая масштабы переработки апатита, его можно рассматривать как один из перспективных основных источников РЗМ. Из хибинского апатитового концентрата налажено получение оксидов РЗМ в Норвегии и на двух предприятиях Польши. Есть сведения, что по аналогичной схеме начнется переработка российского апатитового концентрата на трех предприятиях в Бельгии и Германии. По экспертной оценке ОАО "Зарубежгеология", в 2010 году в Норвегии было произведено 4, 5 тыс. т, в Польше - не менее 7 тыс. т оксидов РЗМ из российского сырья.
Организация производства по извлечению РЗМ из полупродуктов переработки апатитового концентрата на минеральные удобрения выглядит также перспективной. Хибинский апатитовый концентрат практически не содержит радиоактивных элементов; выделенные из него РЗМ также не радиоактивны и не требуют дезактивации - очистки от радиоактивных примесей. Важно отметить, что в сравнении с лопаритом, в апатите содержится значительное количество наиболее дефицитных и дорогих элементов средней и тяжелой групп РЗМ. Извлечение РЗМ может осуществляться по трем направлениям:
1. Извлечение РЗМ из нитратно-фосфатного раствора после вскрытия апатита по азотнокислотной схеме. Это реализовано на ОАО "Акрон" (г. Великий Новгород).
2. Извлечение РЗМ из экстракционной фосфорной кислоты - продукта переработки апатита по сернокислотной схеме. Опытно-промышленная установка запущена в эксплуатацию в мае 2013 года.
3. Извлечение РЗМ из фосфогипса - неизбежного крупнотоннажного отхода переработки апатита по сернокислотной схеме, содержание РЗМ 0, 35-0, 50 %.
На сегодняшний день, по разным оценкам, на территории РФ накоплено от 300 до 500 млн. тонн фосфогипса и ежегодно эти цифры увеличиваются на 10-15 млн. тонн отходов. В отвалах фосфогипса крупнейших российских предприятий находится около 1000 тыс. тонн РЗМ. Организация производства по их извлечение может существенно улучшить сырьевую базу редкоземельных элементов не только в России, но и в мировой экономике. Кроме РЗМ в фосфогипсе содержится от 80 % до 98 % гипса. Отечественный и зарубежный опыт использования фосфогипса в производстве гипсового вяжущего показал, что главным препятствием, сдерживающим промышленную переработку фосфогипса, является то, что известные технологические схемы переработки фосфогипса в гипсовые вяжущие имеют большое количество отходов в виде загрязненных промывных вод, на обезвреживание которых требуются дополнительные средства и значительные энергетические затраты [10].
Вариант выделения РЗМ из фосфогипса может быть реализован на предприятиях, перерабатывающих апатит по сернокислотной схеме. К ним относятся ОАО "Воскресенские минеральные удобрения", ОАО "Кирово-Чепецкий химический комбинат", ООО "Балаковские минеральные удобрения", ОАО "Фосфорит" и ряд других предприятий. Однако предстоит пройти сложный и долгий путь для масштабной реализации переработки фосфогипса.
При переработке редкоземельного сырья любого типа первоначально выделяют сумму РЗМ (в виде оксидов, гидроксидов, карбонатов), которые затем поступают на разделение для получения индивидуальных элементов.
В промышленной практике используют два способа разложения руд, концентратов и отходов: сернокислотный и щелочной.
Сернокислотный способ переработки монацитового концентрата состоит в разложении концентрата серной кислотой с последующим выщелачиванием водой сульфатов РЗМ и тория. Из раствора раздельно выделяют соединения тория и РЗМ.
Для выделения тория и РЗЭ из сульфатных растворов применяют способ ступенчатой нейтрализации растворов с осаждением фосфатов тория и РЗМ, основанный на различии значений pH выделения фосфата тория и фосфатов лантаноидов.
В основе щелочного способа лежит реакция взаимодействия моноцита с раствором гидроксида натрия. Концентрат разлагают гидроксидом натрия при температуре 200 °С практически полностью. Из фильтрата после осаждения тория гидроксидом натрия осаждают смесь гидроксидов РЗМ.
Преимущество щелочного метода перед методом разложения монацита серной кислотой - отделение уже на первой стадии фосфора от тория и лантаноидов с получением полезного побочного продукта - фосфата натрия. Однако сернокислотный метод экономичней и более универсален - применим к монацитовым концентратам различного происхождения.
Современные схемы разделения лантаноидов основаны на использовании эффективных методов: жидкостной экстракции и ионного обмена. В некоторых технологических схемах применяют методы избирательного окисления кислородом, хлором, пероксидом водорода либо электроокисления. Это касается в первую очередь технологии получения церия. Европий получают избирательным восстановлением цинком, амальгамами цинка и натрия либо электрохимическим восстановлением.
Для полного разделения лантаноидов применяют разные схемы с использованием перечисленных методов.
В настоящее время экстракционные методы являются основными в схемах разделения РЗМ. В промышленной практике для разделения используют преимущественно фосфорорганические экстрагенты - ТБФ, фосфорорганические и карбоновые кислоты. Перспективные экстрагенты - нефтяные сульфоксиды.
Для разделения лантаноидов методом ионного обмена применяют различные типы катионообменных смол. Они представляют собой сильнокислотные катиониты, получаемые совместной полимеризацией стирола и дивинилбензола, и содержат активные группы SO3H. Разделение осуществляют методом элюентной хроматографии.
Ввиду высокой химической прочности соединений лантаноидов (оксидов, галогенидов) чистые металлы или их сплавы получают методами металлотермии или электролиза из расплавленных сред из оксидов и безводных хлоридов и фторидов РЗМ.
РЗМ получают преимущественно из безводных хлоридов или фторидов.
Разработаны различные способы получения лантаноидов электролизом в расплавах солей. Среди них наиболее распространен электролиз безводных хлоридов РЗМ в расплавах хлоридов щелочных или щелочно-земельных металлов. Этим способом в производственных масштабах получают преимущественно мишметалл (мишметалл - естественная смесь редкоземельных элементов с атомными номерами от 57 до 71 в форме металла.), а также церий, иногда лантан, неодим и празеодим. Металлы подгруппы иттрия не получают электролизом, так как они, за исключением иттербия, имеют высокие точки плавления (от 1350 °С до 1700 °С).
Металлотермическим восстановлением галоидных солей (хлоридов, фторидов), а также окислов лантаноидов получают РЗМ более высокой чистоты, чем электролизом расплавленных сред.
Лучшие результаты в отношении выхода, хорошей выплавки слитка и чистоты металлов получены при восстановлении галогенидов кальцием. Этим способом можно получить все лантаноиды, за исключением самария, европия и иттербия, восстановление которых протекает только до низших галогенидов. Поэтому для получения этих трех лантаноидов разработан способ восстановления их окислов лантаном с одновременной вакуумной их возгонкой.
Восстановление оксидов РЗМ с одновременной дистилляцией металлов
Самарий, европий и иттербий не удается получить восстановлением их хлоридов или фторидов кальцием. Восстановление протекает только до образования дигалогенидов. Для получения этих металлов разработан способ восстановления оксидов лантаном металлическим в вакууме с одновременной дистилляцией образующихся металлов, которые имеют более высокое давление пара, чем лантан.
Рафинирование РЗМ можно осуществить дистилляцией в вакууме. Этот метод эффективен для очистки тугоплавких металлов иттриевой группы и самого иттрия.
При производстве редких и редкоземельных металлов необходимо обеспечивать экологическую безопасность и санитарно-гигиенические условия работы. Как и во всех химико-металлургических процессах, образуются жидкие, твердые и газообразные отходы, в том числе в отдельных случаях содержащие вредные химические вещества. Способы утилизации технологических отходов разработаны и непрерывно совершенствуются.
1.3.4 Тугоплавкие металлы
1.3.4.1 Ванадий относится к рассеянным элементам и в природе в свободном виде не встречается. Содержание ванадия в земной коре - 9, 0•10-3 % по массе. Наиболее высокое среднее содержание ванадия в магматических породах отмечается в габбро и базальтах (230-290 г/т). В осадочных породах значительное накопление ванадия происходит в биолитах (асфальтитах, углях, битуминозных фосфатах), битуминозных сланцах, бокситах, а также в оолитовых и кремнистых железных рудах. Близость ионных радиусов ванадия и широко распространенных в магматических породах железа и титана приводит к тому, что ванадий в гипогенных процессах целиком находится в рассеянном состоянии и не образует собственных минералов. Его носителями являются многочисленные минералы титана (титаномагнетит, сфен, рутил, ильменит), слюды, пироксены и гранаты, обладающие повышенной изоморфной емкостью по отношению к ванадию. Важнейшие минералы: патронит V(S2)2, ванадинит Pb5(VO4)3Cl и некоторые другие. Основной источник получения ванадия - железные руды, содержащие ванадий как примесь. Известны месторождения в Перу, США, ЮАР, Финляндии, Австралии, Армении, России, Турции, Англии [12].
1.3.4.2 Кларк ниобия - 2•10-3 %. Содержание ниобия увеличивается от ультраосновных (0, 2 г/т Nb) к кислым породам (24 г/т Nb). Ниобию всегда сопутствует тантал. Близкие химические свойства ниобия и тантала обусловливают совместное их нахождение в одних и тех же минералах и участие в общих геологических процессах. Ниобий способен замещать титан в ряде титансодержащих минералов (сфен, ортит, перовскит, биотит). Форма нахождения ниобия в природе может быть разной: рассеянной (в породообразующих и акцессорных минералах магматических пород) и минеральной. В общей сложности известно более 100 минералов, содержащих ниобий. Из них промышленное значение имеют лишь некоторые: колумбит-танталит (Fe, Mn) (Nb, Ta)2O6, пирохлор (Na, Ca, TR, U)2(Nb, Ta, Ti)2O6(OH, F) (Nb2O5) 30 % - 63 %), лопарит (Na, Ca, Ce) (Ti, Nb)O3 ((Nb, Ta)2O5 8 - 10 %), иногда используются эвксенит, торолит, ильменорутил, а также минералы, содержащие ниобий в виде примесей (ильменит, касситерит, вольфрамит). В щелочных - ультраосновных породах ниобий рассеивается в минералах типа перовскита и в эвдиалите. В экзогенных процессах минералы ниобия и тантала, являясь устойчивыми, могут накапливаться в делювиально-аллювиальных россыпях (колумбитовые россыпи), иногда в бокситах коры выветривания. Концентрация ниобия в морской воде 1•10-5 мг/л [7]. Месторождения ниобия расположены в США, Японии, России (Кольский полуостров), Бразилии, Канаде [14].
1.3.4.3 Тантал. В земной коре на его долю приходится 2, 5•10-4 %. В природе встречается в виде двух изотопов: стабильного 181Та (99, 9877 %) и радиоактивного (вероятно) с периодом полураспада более 1015 лет 180mТа (0, 0123 %). Последний является чрезвычайно стабильным изомером (возбужденным состоянием) изотопа 180Та, период полураспада которого всего чуть более 8 ч [15]. Известно около 20 собственно минералов тантала - серия колумбит-танталит, воджинит, лопарит, манганотанталит и др., а также более 60 минералов, содержащих тантал. Все они связаны с эндогенным минералообразованием. В минералах тантал всегда находится совместно с ниобием вследствие сходства их физических и химических свойств. Тантал - типично рассеянный элемент, так как изоморфен со многими химическими элементами. Месторождения тантала приурочены к гранитным пегматитам, карбонатитам и щелочным расслоенным интрузиям. Самые крупные месторождения танталовых руд находятся во Франции, Египте, Таиланде, Китае. Месторождения танталовых руд имеются также в Мозамбике, Австралии, Нигерии, Канаде, Бразилии, СНГ, ДРК, Малайзии. Крупнейшее мировое месторождение танталовых руд - Гринбушес - расположено в Австралии в штате Западная Австралия в 250 км к югу от Перта [12].
1.3.4.4 Циркония содержание в земной коре 1, 7•10-2 %. Россия обладает крупной минерально-сырьевой базой диоксида циркония - его балансовые запасы составляют 12, 05 млн т; еще 12, 68 млн т находится в забалансовых запасах. При этом только менее половины запасов диоксида циркония категорий А + В + С1 заключено в разрабатываемых, подготавливаемых к эксплуатации и разведываемых месторождениях; по величине этих активных запасов страна занимает четвертое место в мире. Но доля России в мировом производстве циркониевых концентратов незначительна - всего 0, 5 %; по данному показателю страна находится лишь на 14-ом месте в мире.
В отличие от основных стран-продуцентов циркониевых концентратов, в российской минерально-сырьевой базе преобладают коренные магматогенные месторождения - в них находится почти 70 % запасов диоксида циркония, в россыпных объектах - всего 30 %. Россия - единственная страна, выпускающая циркониевый бадделеитовый концентрат из руд коренного месторождения - Ковдорского бадделеит-апатит-магнетитового в Мурманской области. В месторождении сконцентрировано 2, 29 млн т, или около 20 % запасов диоксида циркония России. Цирконий, как и фосфор, является попутным компонентом в его рудах; основной компонент - железо. Содержание диоксида циркония в рудах невысокое - 0, 15 %, но минералом циркония является бадделеит - природный диоксид циркония (ZrO2), более редкий и ценный, чем содержащийся в россыпях силикат циркония - циркон (ZrSiO4). Ковдорское техногенное месторождение, представленное отходами обогащения бадделеит-апатит-магнетитовых руд, содержит 37, 7 тыс. т запасов диоксида циркония категорий А + В + С1.
Половина российских запасов диоксида циркония заключена в двух крупных коренных месторождениях, приуроченных к массивам редкометальных гранитов - циркон-пирохлоркриолитовом Катугинском (3, 09 млн т) в Забайкальском крае и циркон-пирохлор-колумбитовом Улуг-Танзекском (2, 9 млн т) в Республике Тыва. Комплексные труднообогатимые руды с танталом, ниобием, редкоземельными элементами и ураном содержат 1, 58 % ZrO2 в подготавливаемом к освоению Катугинском и 0, 4 % ZrO2 - в не переданном в освоение Улуг-Танзекском месторождении. Нигде в мире месторождения подобного типа не разрабатываются. В Катугинском рудном районе локализованы незначительные прогнозные ресурсы диоксида циркония категории P1 (11, 5 тыс. т) в циркон-пирохлор-криолитовых россыпях.
В Мурманской области Государственным балансом запасов полезных ископаемых учитываются также гигантские забалансовые запасы коренных эвдиалитовых руд участка Аллуайв Ловозерского редкометального месторождения - 7, 275 млн т диоксида циркония. В рудах цирконий находится в составе минерала эвдиалита - сложного силиката циркония и редких земель иттриевой группы; руды содержат в среднем 1, 83 % ZrO2, но на отдельных участках содержание ZrO2 достигает 5 % - 9 %.
В Западно-Сибирской россыпной провинции на территории Томской, Омской, Новосибирской областей и Ханты-Мансийского автономного округа сосредоточено 15, 5 % отечественных запасов диоксида циркония в россыпях, большей частью - в крупном Туганском и среднем Георгиевском циркон-рутил-ильменитовых месторождениях Томской области. Руды осваиваемого Туганского месторождения залегают на глубине 10-98 м, руды нелицензированного Георгиевского месторождения на глубине 120-180 м.
В Нижегородской области находится самое богатое из российских по содержанию ZrO2 Лукояновское циркон-рутил-ильменитовое месторождение среднего масштаба; в его наиболее крупной Итмановской россыпи, залегающей на глубине 40-80 м, заключено 389 тыс. т запасов диоксида циркония.
На внутренний рынок России в 2015 г. поставлено 160 т бадделеитового концентрата и 101 т цирконового концентрата. Кроме того, для нужд российской промышленности из-за рубежа было ввезено 6, 5 тыс. т цирконового концентрата, в том числе 3, 5 тыс. т из Украины, 2, 1 тыс. т из Нидерландов. В последние годы объемы экспорта бадделитового и импорта цирконового концентратов были сопоставимы, но стоимость экспорта в три раза превышает стоимость импорта. Российские предприятия выпускают широкий спектр продукции из цирконового и бадделеитового концентратов; страна является третьим мировым производителем изделий из металлического циркония и его сплавов, занимая 17 % мирового рынка циркониевого проката. В Республике Удмуртия АО "Чепецкий механический завод" (входит в состав АО "ТВЭЛ" Госкорпорации "Росатом") выпускает около 3 тыс. т/год металлического циркония и его сплавов, а также циркониевую продукцию, в том числе из циркониевых сплавов ядерной чистоты, порошки на основе диоксида циркония и керамику из диоксида циркония. Завод работ на импортном цирконовом концентрате, поставляемом Вольногорским ГОКом, разрабатывающим Малышевское россыпное ильменит-рутил-цирконовое месторождение на Украине. В Московской области ООО "Щербинский завод электроплавленных огнеупоров" выпускает бадделеитокорундовые огнеупоры для стекловаренных печей, используя бадделеитовый концентрат Ковдорского ГОКа. ООО "Управляющая Компания "Уральский Завод Инструментов и Материалов" в Пермской области, а также ЗАО "Абразивы Урала" в Челябинске производят циркониевый электрокорунд для изготовления шлифовальных кругов. В Ленинградской области ОАО "Боровичский комбинат огнеупоров" изготавливает огнеупорные изделия на основе диоксида циркония, используемые при непрерывной разливке стали; в Свердловской области ОАО "Ключевский ферросплавный завод" выпускает ферросиликоцирконий, применяемый для раскисления стали. Несмотря на наличие в стране россыпных месторождений циркония, открытая разработка которых может быть экономически эффективной (Туганское, Бешпагирское, Камбулатский участок, Константиновский участок), российская минерально-сырьевая база циркония не выдерживает конкуренции с сырьевой базой основных стран-продуцентов цирконовых концентратов, поэтому освоение собственных месторождений циркония продвигается крайне медленно.
1.3.4.5 Титан находится на 10-м месте по распространенности в природе. Содержание в земной коре - 0, 45 % по массе, в морской воде - 0, 001 мг/л [7]. В ультраосновных породах - 300 г/т, в основных - 9 кг/т, в кислых - 2, 3 кг/т, в глинах и сланцах - 4, 5 кг/т. В земной коре титан почти всегда четырехвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках. Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях [8], [10].
Балансовые запасы диоксида титана России ~ 600, 45 млн т. Запасы категорий A + B + C1 составляют немногим менее половины балансовых запасов - 261, 4 млн т, при этом лишь 45 % от этого количества находится в разрабатываемых, осваиваемых и разведываемых месторождениях; по величине этой активной части запасов Россия находится на третьем месте в мире с долей 13 %. Прогнозные ресурсы диоксида титана России огромны, причем более трети из них имеет высокую степень достоверности.
Российская минерально-сырьевая база титана характеризуется большим разнообразием с преобладанием коренных месторождений, в которых заключено 97 % запасов диоксида титана страны: 46 % запасов находится в погребенных литифицированных россыпях Ярегского нефте-титанового месторождения, 37 % - в магматогенных месторождениях в габброидах, 14 % - в магматогенных месторождениях в щелочных породах. В погребенных прибрежно-морских россыпях Восточно-Европейской и Западно-Сибирской россыпных провинций заключено только 3 % запасов диоксида титана РФ.
В мире россыпные месторождения обеспечивают около 70 % производства диоксида титана в титановых концентратах и шлаках. Остальные 30 % получают из руд коренных магматогенных месторождений в габброидах, разрабатываемых в Канаде - месторождение Лак-Тио с рудами, содержащими 34 % TiO2, в Норвегии - месторождение Теллнес (18 % TiO2), в Китае - месторождения группы Паньчжихуа (6-12 % TiO2) и в России - Куранахское месторождение (9, 8 % TiO2).
Большая часть запасов российских магматогенных месторождений в габброидах (18 % российских) представлена ильменит-титано-магнетитовыми рудами, одно месторождение (Кручининское) содержит апатит-ильменит-титаномагнетитовые руды (8 %), остальные (11 %) - титаномагнетитовые; все руды комплексные с железом, ванадием, иногда фосфором и другими элементами. Наиболее перспективны месторождения с высокой долей диоксида титана, содержащегося в ильмените, - ильменит-титаномагнетитовые, апатит-ильменит-титаномагнетитовые и ильменит-магнетитовые, поскольку извлекать диоксид титана из титаномагнетита пока не удается.
Разработка на титан магматогенных месторождений в щелочных породах нигде, кроме России, не ведется; доля диоксида титана в получаемом из них лопаритовом концентрате составляет только 0, 05 % мирового производства.
Почти половина (46 %) отечественных запасов титана сосредоточена в Тимано-Печорской титановой провинции в Республике Коми в Ярегском нефтетитановом месторождении. Оно представляет собой древнюю многопластовую литифицированную россыпь, залегающую на глубине 150-280 м. Руды месторождения - нефтеносные кварцевые песчаники с лейкоксеном, содержащие 10, 4 % диоксида титана, являются одними из самых богатых в России. Однако извлечение диоксида титана из лейкоксена представляет большую сложность из-за высокого содержания в нем кремнезема. За рубежом из подобного типа битуминозных песчаников района Атабаска в Канаде диоксид титана также до сих пор не извлекается. На флангах Ярегского месторождения и в Пижемском рудопроявлении подобного типа локализовано по 15 % российских прогнозных ресурсов диоксида титана категорий Р1 и Р2.
В Карело-Кольской титановой провинции в Мурманской области заключено более пятой части российских запасов диоксида титана. Большая их часть находится в магматогенных месторождениях с бедными рудами в щелочных породах - около 12 % в семи апатит-нефелиновых месторождениях Хибинской группы (0, 3 % - 3, 5 % TiO2) и 1 % в мелком редкометальном Ловозерском месторождении лопаритовых руд (1, 29 % TiO2). Титан является попутным компонентом и извлекается лишь из руд Ловозерского месторождения. Еще 8 % российских запасов диоксида титана находится в крупном магматогенном месторождении в габброидных породах Юго-Восточная Гремяха. Его руды имеют достаточно высокое содержание TiO2 - 8, 6 %. В апатит-титаномагнетит-ильменитовом проявлении Гремяха-Вырмес с небогатыми рудами, содержащими 6, 8 % TiO2 локализовано 12, 2 млн т, или около 4 % российских прогнозных ресурсов категории Р1; еще 2, 6 млн т ресурсов категории Р1 и 3, 1 млн т категории Р2 выявлено в Палалахтинском рудопроявлении с достаточно богатыми ильменит-магнетитовыми рудами, содержащими 10 % TiO2.
В Олекмо-Становой титановой провинции в Забайкальском крае разведано 18 % российских запасов диоксида титана. Они заключены в двух рупных месторождениях: апатит-ильменит-титаномагнетитовом Кручининском и титаномагнетитовом Чинейском. Руды Кручининского месторождения содержат 8, 4 % TiO2, Чинейского - только 6, 5 % TiO2, но они богаче по содержанию железа (33, 5 %) и пентоксида ванадия - 0, 53 % (в Кручининском - 18 % и 0, 1 % соответственно). Освоение месторождений сдерживается плохой обогатимостью руд и отсутствием технологии получения кондиционной титановой продукции. На флангах Чинейского месторождения локализованы значительные прогнозные ресурсы диоксида титана в рудах с содержанием 6, 8 % TiO2 - 34 млн т категории P1 (9 % российских).
Также в Олекмо-Становой провинции на территории Хабаровского края в апатит-ильменит-титаномагнетитовых рудах (Геранский рудный район), содержащих 5, 5 % - 8, 9 % TiO2, оценены прогнозные ресурсы диоксида титана категории Р1 в количестве 34 млн т (9 % российских). В Республике Бурятия в Витимконском рудном поле локализована почти треть прогнозных ресурсов категории P2 в титаномагнетит-ильменитовых рудах с содержанием 7, 6 % TiO2.
В Уральской титановой провинции в Челябинской области находится Медведевское ильменит-титаномагнетитовое месторождение, в котором сконцентрировано 5 % российских запасов диоксида титана. Его руды, содержащие 7 % TiO2, труднообогатимы из-за тонкого прорастания слагающих их минералов. На флангах месторождения и в россыпных проявлениях локализованы незначительные ресурсы диоксида титана категории P1 - 4 млн т и столько же категории P2.
Россия производит только 1 % выпускаемого в мире диоксида титана в титановых концентратах. В Мурманской области диоксид титана извлекается из недр апатит-нефелиновых месторождений Хибинской группы и Ловозерского редкометального месторождения. В Амурской области диоксид титана добывается на Куранахском ильменит-титаномагнетитовом месторождении, разрабатываемом на железо и не учитываемом Государственным балансом запасов титана. На шести апатит-нефелиновых месторождениях Хибинской группы - Апатитовый Цирк, Коашвинское, Ньоркпахкское, Плато Расвумчорр, Кукисвумчоррское и Юкспорское - компания АО "Апатит" добыла в 2015 г. открытым и подземным способом 24, 45 млн т руды, содержащей 344 тыс. т диоксида титана, заключенного в сфене (содержит 40, 8 % TiO2) и титаномагнетите (15, 5 % TiO2). Лишь незначительное количество сфенового концентрата извлекалось из хвостов апатитовой флотации добытых руд; весь титаномагнетит и подавляющая часть сфена складируется в хвостохранилищах. Из сфенового концентрата получают титано-кальциевый пигмент, используемый в производстве лакокрасочной продукции. На Ловозерском редкометальном месторождении в 2015 г. компанией ООО "Ловозерский ГОК" добыто подземным способом 159 тыс. т руды, содержащей 4 тыс. т диоксида титана в редкоземельно-редкометалльном минерале лопарите (35 % - 44 % TiO2). Из руды на Карнасуртской обогатительной фабрике извлечено 7, 816 тыс. т лопаритового концентрата (3, 04 тыс. т TiO2). Концентрат перерабатывался химико-металлургическим способом на Соликамском магниевом заводе в Пермском крае с получением оксидов редких и редкоземельных элементов и тетрахлорида титана, из которого произведено 1, 981 тыс. т губчатого титана. Опытно-промышленная добыча диоксида титана проводилась в Томской области на Южно-Александровском участке Туганского россыпного циркон-рутил-ильменитового месторождения. В 2015 г. компания ОАО "Туганский ГОК "Ильменит" добыла открытым способом 17, 9 тыс. куб. м рудных песков. На обогатительной фабрике из песков получено 383 т ильменит-рутил-лейкоксенового концентрата, содержащего 208 т TiO2. На не учитываемом Государственным балансом запасов титана Куранахском ильменит-титаномагнетитовом месторождении компания ООО "Олекминский рудник" в 2015 г. извлекла из недр 315 тыс. т диоксида титана в руде, из которой на Олекминской обогатительной фабрике выпущено 193, 3 тыс. т ильменитового концентрата (на 8 % больше, чем в 2014 г.), содержащего 85, 6 тыс. т диоксида титана. Всего в России в 2015 г. добыто 663 тыс. т диоксида титана - 348 тыс. т на месторождениях, учитываемых Государственным балансом запасов титана, и 315 тыс. т диоксида титана на Куранахском месторождении. В концентраты извлечено 88, 85 тыс. т диоксида титана - 3, 25 тыс. т на месторождениях, учитываемых Государственным балансом запасов титана, и 85, 6 тыс. т на Куранахском месторождении. Россия является вторым мировым (после Китая) продуцентом губчатого титана и крупнейшим в Восточной Европе продуцентом пигментного диоксида титана; оба производства базируются на импортном титановом сырье. В 2015 г. в страну ввезено 312, 22 тыс. т ильменитовых (в том числе около 10 тыс. т рутиловых) концентратов, главным образом, из Украины (279, 04 тыс. т), а также из Австралии (32, 31 тыс. т), Таиланда, Сенегала, ЮАР, Сьерра-Леоне, Индии и Вьетнама. По сравнению с 2014 г. импорт титановых концентратов вырос почти в 2, 5 раза. Ильменитовый концентрат с Куранахского месторождения Россия экспортирует; в 2015 г. вывезено 223, 7 тыс. т (в 1, 5 раза больше, чем в 2014 г.) практически полностью в Китай. Компания ПАО "Корпорация ВСМПО-АВИСМА" - основной российский продуцент губчатого и компактного титана и титановых полуфабрикатов - произвела на Березниковском титано-магниевом комбинате в Пермском крае 38 тыс. т губчатого титана (на 5 % меньше, чем в 2014 г.). Компания ОАО "Соликамский магниевый завод" выпустила на Соликамском магниевом заводе в Пермском крае 1, 98 тыс. т губчатого титана - на 2 % больше, чем в 2014 г. Всего в 2015 г. в стране произведено 40 тыс. т губчатого титана, или 18 % мирового производства. Экспортировано из страны, главным образом, в Нидерланды, Эстонию и Германию 6, 315 тыс. т губчатого титана. Остальной губчатый титан поставляется на Верхнесалдинское металлургическое производственное объединение "Корпорации ВСМПО-АВИСМА" в Свердловской области и используется для изготовления титановых слитков и полуфабрикатов из титановых сплавов. Мелкими продуцентами титановых слитков и титанового проката являются ОАО "Всероссийский институт легких сплавов", ОАО "Уральская кузница", ООО "Ступинская металлургическая компания, АО "Металлургический завод "Электросталь", АО "Чепецкий механический завод", ООО "Зубцовский машиностроительный завод", ООО "Мегаметалл" и другие. В 2015 г. в России изготовлено 65 тыс. т титановых слитков, на 5 % больше, чем в предыдущем году; страна являлась их крупнейшим мировым продуцентом. По выпуску титанового проката Россия занимает третье место в мире после Китая и США. В 2015 г. ПАО "Корпорация ВСМПО-АВИСМА" выпустила 28, 4 тыс. т титанового проката. Компания является одним из крупнейших мировых экспортеров титанового проката, поставляя его мировым авиастроительным компаниям Boeing, EADS/Airbus, Embraer S.A., Rolls-Royce plc, SNECMA, UTC Aerospace Systems, MessierBugatti-Dowty, TECT, Uniti Titanium, Blades Technology Limited и другим. В 2015 г. из России экспортировано 12, 83 тыс. т титанового проката, на 12, 5 % больше, чем годом ранее. Из отходов производства губчатого и металлического титана, а также изделий из него, несколько российских предприятий - ПАО "Корпорация ВСМПО-АВИСМА", ООО "Зубцовский машиностроительный завод", ОАО "Волговятсквторцветмет", ООО "Каскад-ABC" и другие - выпускают ферротитан, большая часть которого экспортируется; в 2015 г. вывезено 12, 396 тыс. т. Значительное падение цены на губчатый титан марки TG-tv в 2013 г. до среднегодовой 5, 54 долл./кг заставило китайских продуцентов сократить загрузку мощностей, что привело к росту цены в 2014 г. на 18 % до 6, 33 долл./кг. В первом квартале 2015 г. производство губчатого титана в Китае сократилось почти вдвое по сравнению с началом 2014 г.; в Японии загрузка мощностей составляла около 60 %, на 10 % было сокращено производство ПАО "Корпорацией ВСМПО-АВИСМА". Но потребление титана в аэрокосмическом секторе в 2015 г. оказалось ниже ранее запланированного из-за переноса запуска производства китайского среднемагистрального авиалайнера С-919. Из-за замедления развития мировой экономики снизился спрос на титан в химической промышленности и энергетике; упавшие нефтяные котировки привели к замораживанию ряда шельфовых проектов по добыче нефти, где титан используется в установках сжижения попутного газа и опреснения воды, и общее состояние рынка титана в течение года ухудшалось с падением спроса и цен на рынке. Потребности российских предприятий авиационной, космической, судостроительной, энергетической, нефтедобывающей, медицинской промышленности в металлическом титане полностью удовлетворяются продукцией ПАО "Корпорация ВСМПО-АВИСМА" и других мелких продуцентов. В 2015 г. "Корпорация ВСМПО-АВИСМА" поставила на внутренний рынок России 12, 19 тыс. т титановой продукции, на 11, 6 % меньше, чем в 2014 г. Потребности России в пигментном диоксиде титана удовлетворяются частично продукцией компании ООО "Титановые инвестиции", выпускающей ее на заводе по производству диоксида титана в г. Армянске (Республика Крым). Крупнейшее в Восточной Европе предприятие по производству 120 тыс. т/год пигментного диоксида титана работает по сульфатной технологии и снабжается ильменитовым концентратом с горнодобывающих предприятий Украины - ГОКов Междуреченский и Валки-Ильменит. В 2015 г. завод выпустил 77, 8 тыс. т пигментного диоксида титана (на 20 % меньше, чем в 2014 г.) и поставил на российский рынок около 15 тыс. т; за рубеж экспортировано 73, 84 тыс. т пигмента (часть из складских запасов). В 2015 г. Россия импортировала 66, 29 тыс. т пигментного диоксида титана, на 15 % меньше, чем в 2014 г. В 2016 г. российский импорт пигментного диоксида титана сократился еще на 35 %, до 43, 4 тыс. т, а экспорт уменьшился почти вдвое, до 38, 3 тыс. т. Пигментный диоксид титана используется в производстве товаров широкого потребления, поэтому мировой спрос на него четко коррелируется с ростом мирового ВВП. После сокращения потребления диоксида титана во время мирового финансово-экономического кризиса 2008-2009 гг. восстановление мировой экономики в 2010-2012 гг. сопровождалось ростом спроса на диоксид титана и его цены. Однако со второй половины 2012 г. рост потребления диоксида титана замедлился. Возникший избыток диоксидтитанового пигмента вызвал падение цен на него в 2013 г. Положение не изменилось и в 2014 г., цены остались практически на том же уровне. Несмотря на сокращение производства ведущими компаниями - продуцентами диоксида титана, остановить падение цен не удалось и в 2015 г., так как потребление пигмента продолжало сокращаться из-за все более замедлявшегося роста мировой экономики, в первую очередь - китайской. В первом квартале 2016 г. цены продолжали снижаться, но сокращение производства, в частности, в Китае из-за многочисленных экологических проверок, вызвало дефицит диоксида титана на рынке, что привело к постепенному росту цен во втором квартале 2016 г. Тем не менее, среднегодовые цены 2016 г. оказались на 13-18 % ниже цен 2015 г. Цены на ильменитовый и рутиловый титановые концентраты изменяются в соответствии с движением цен на пигментный диоксид титана, на производство которого в мире используется 95 % выпускаемого титанового сырья. Россия имеет крупную и разнообразную по составу минерально-сырьевую базу титана с преобладанием комплексных нефтетитановых и железо-титановых месторождений. Россыпные месторождения характеризуются часто глубоким залеганием руд, сложными горно-геологическими условиями их отработки, оптимальным способом их освоения может стать способ скважинной гидродобычи (СГД). Российские месторождения титана менее привлекательны, чем разрабатываемые за рубежом богатые коренные месторождения и поверхностные и приповерхностные россыпи, в том числе в связи с их комплексным составом и отсутствием спроса на другие основные и попутные компоненты. Поэтому освоение отечественных месторождений титана, за исключением близкого к промышленному освоению Туганского циркон-рутил-ильменитового месторождения в Томской области, откладывается на неопределенный период.
1.3.4.6 Вольфрам.
Содержание в земной коре этого элемента 1, 3•10-4 %.
Учитываемые Государственным балансом запасов полезных ископаемых запасы вольфрама значительны и составляют около 1, 34 млн т в пересчете на триоксид вольфрама. Практически в полном объеме запасы заключены в рудах разномасштабных коренных месторождений жильного, скарнового и штокверкового геолого-промышленных типов; на долю россыпей приходится менее 1 %. В зависимости от главного вольфрамсодержащего минерала они подразделяются на вольфрамитовые (более 35, 5 % запасов страны) и шеелитовые (около 64 %). Вольфрам в них присутствует и как основной, и как попутный компонент; сами руды, как правило, комплексные и помимо вольфрама могут содержать молибден, медь, висмут, олово, бериллий, золото и др. Существенно вольфрамовые руды, на долю которых приходится примерно 67, 5 % российских запасов вольфрама, по среднему содержанию WO3 в целом не уступают среднемировому уровню - в вольфрамитовых объектах оно варьирует от 0, 12 % до 2, 73 %, в среднем составляя 0, 1 9 %, в шеелитовых - от 0, 03 % до 4, 4 %, в среднем 0, 34 %.
Для отечественной МСБ вольфрама характерна высокая концентрация - более 60 % запасов страны сосредоточено в Республике Бурятия, Приморском крае и Кабардино-Балкарской Республике. Еще около 29 % приходится на долю Курганской области, Республики Саха (Якутия) и Карачаево-Черкесской Республики.
В трех месторождениях Республики Бурятия, принадлежащих Байкало-Витимской металлогенической провинции, сконцентрировано более четверти запасов вольфрама страны. Два из них сложены вольфрамитовыми рудами: крупное штокверковое Инкурское, среднее содержание WO3 в бедных рудах которого составляет 0, 149 %, и небольшое жильное Холтосонское месторождение сравнительно богатых руд (0, 748 % WO3), на котором возможен прирост запасов - здесь локализованы прогнозные ресурсы триоксида вольфрама категории Р1 в количестве 9, 6 тыс. т. Третье месторождение - молибденовое Мало-Ойногорское со значительными запасами попутного шеелита при низкой концентрации WO3 (0, 04 %).
На севере Приморского края, территория которого входит в состав Сихотэ-Алинской металлогенической провинции, сосредоточено более 18 % запасов вольфрама России. Главную роль здесь играют скарновые объекты с шеелитовыми рудами, в том числе эксплуатируемые и в значительной степени отработанные Восток-2 и Лермонтовское, в рудах которых содержится в среднем более 1 % WO3, подготавливаемое к эксплуатации крупное Скрытое месторождение рядовых руд (0, 36 % WO3) и не переданное в освоение мелкое Кордонное (0, 57 % WO3). Перспективы значимого прироста запасов есть лишь на последнем, где локализованы прогнозные ресурсы категории Р1 в количестве 16, 8 тыс. т.
Запасы вольфрама Кабардино-Балкарской Республики (более 16 % запасов страны) почти полностью заключены в крупнейшем в стране и одном из самых крупных в мире Тырныаузском скарновом месторождении шеелитовых руд рядового качества (0, 436 % WO3) с попутным молибденитом.
В Карачаево-Черкесской Республике разведано крупное штокверковое Кти-Тебердинское месторождение шеелитовых руд, заключающее около 8 % российских запасов.
Оба этих объекта приурочены к Кавказской металлогенической провинции, где прогнозные ресурсы высоких категорий не выявлены. В Курганской области в штокверковом Коклановском месторождении с попутным шеелитом в рудах убогого качества (0, 04 % WO3) сосредоточено более 10 % российских запасов вольфрама; перспективы прироста запасов отсутствуют.
В недрах Республики Саха (Якутия) заключено почти 10 % запасов вольфрама страны. Основная их часть разведана в скарновом Агылкинском месторождении богатых (1, 27 % WO3) шеелитовых руд, относящемся к Верхояно-Колымской металлогенической провинции. Локализованные на ее территории ресурсы категории Р1 незначительны.
Крупнейшим российским продуцентом вольфрамовых концентратов традиционно является ОАО "Приморский ГОК", действующее на базе месторождения Восток-2. В 2015 г. компанией было произведено 2199, 1 т концентрата, содержащего 1319, 4 т триоксида вольфрама, что составило около 40 % национального показателя (в отдельные годы доля компании превышала 80 %, но с 2010 г. она устойчиво снижается). Показатели всех остальных продуцентов заметно ниже. ЗАО "Новоорловский ГОК", разрабатывающее Спокойнинское месторождение, получило 1502, 6 т концентрата, содержащего 930, 1 т триоксида вольфрама (более 27 % отечественного производства), ООО "Лермонтовский ГОК", эксплуатирующее одноименное месторождение - 1472, 6 т концентрата, содержащего 883, 6 т триоксида вольфрама (около 27 %). Концентрат вольфрама из природных руд также выпускается ЗАО "Закаменск" и ООО "А/с "Кварц" (разрабатывают россыпь руч. Инкур и Бом-Горхонское месторождение соответственно), но объемы их производства на порядок меньше - в 2015 г. ими получено по 154 т продукта.
Полученные в России вольфрамовые концентраты направляются как на внутренний, так и на внешний рынки. В 2015 г. продажи вольфрамового сырья за рубеж сократились по сравнению с 2014 г. на 23, 6 % - до 2678 т. Его покупателями выступили Южная Корея, закупившая более 63 % продукции, а также Вьетнам, Гонконг, Нидерланды и Сингапур. При этом на внутреннем рынке сохраняется дефицит вольфрамового сырья, который частично компенсируется за счет импорта, объемы которого в 2015 г. выросли по сравнению с предыдущим годом на 25 % - до 1714 т. Главными поставщиками являлись Канада (около 51 %) и Вьетнам (около 30 %). Перепроизводство вольфрамового сырья в Китае обусловило снижение цен на него в период после 2011 г., которое в 2015 г. приобрело обвальный характер и продолжилось в 2016 г. В результате мировые цены на вольфрамовую продукцию в 2015 г. оказались более чем вдвое ниже пиковых значений.
Основными потребителями вольфрамовых концентратов в России являются завод компании ОАО "Гидрометаллург" в г. Нальчик и предприятие ОАО "Кировградский завод твердых сплавов" в Свердловской области. С 2013 г. их видимое потребление растет и в 2015 г. составило 4, 5 тыс. т против 1, 2 тыс. т в 2012 г.
При обеспеченности запасами вольфрама, оцениваемой более, чем в 300 лет, сохранение добычи на уровне 2015 г. уже через три года приведет к истощению запасов Лермонтовского, а еще через шесть лет - месторождения Восток-2 в Приморском крае, содержащих наиболее качественные руды. Это может означать более чем двукратное падение производства вольфрамового сырья в России. В связи с этим остро встает вопрос компенсации выбывающих мощностей. Однако существующие инфраструктурные проблемы и низкие текущие цены на триоксид вольфрама снижают привлекательность инвестиций в разработку новых объектов, в частности - наиболее подготовленного к разработке месторождения Скрытое. Существенную роль в развитии добычи вольфрама может сыграть возобновление эксплуатации Тырныаузского месторождения, однако сроки ее начала пока неизвестны.
Важной задачей является создание и внедрение современных и эффективных технологических решений обогащения руд и разработки имеющихся месторождений, а также поиски пригодных для эффективной отработки объектов в уже освоенных районах.
1.3.4.7 Молибден.
Содержание в земной коре 1, 1•10-4 %. Российская Федерация располагает значительной сырьевой базой молибдена - запасы металла, учитываемые Государственным балансом запасов, превышают 2, 1 млн т.
В число крупных продуцентов металла Россия не входит, обеспечивая лишь около 1 % мирового производства. Наиболее развита его добыча в КНР, Чили, США и Перу, на долю которых приходится 88 % производства металла в мире.
Российская сырьевая база молибдена отличается высокой степенью концентрации - более 70 % запасов металла заключено в месторождениях, локализованных на юге Сибири, прежде всего, в Забайкальском крае, а также в республиках Хакасия и Бурятия.
На юге Забайкальского края, в пределах Монголо-Охотской металлогенической провинции расположено уникальное по масштабу запасов Бугдаинское месторождение штокверкового (молибден-порфирового) типа, заключающее почти 600 тыс. т молибдена или 28 % запасов страны. Руды его характеризуются рядовым качеством (0, 08 % Мо) и, помимо молибдена, содержат золото, серебро и свинец. Месторождение имеет некоторые перспективы прироста запасов - прогнозные ресурсы категории Р1 на одном из его участков оценены в 10 тыс. т.
На севере края находится среднее по масштабу Жирекенское месторождение того же типа, но с богатыми рудами (0, 105 % Мо). Месторождение приурочено к Байкало-Витимской металлогенической провинции, на продолжении которой, в недрах Республики Бурятия разведаны еще три объекта штокверкового собственно молибденового типа: крупные Орекитканское и Мало-Ойногорское, а также среднее Жарчихинское. Качество руд Орекитканского и Жарчихинского месторождений сравнительно высокое, в среднем 0, 099 % и 0, 086 % Мо соответственно. Руды Мало-Ойногорского месторождения значительно беднее (0, 051 % Mo), но в качестве попутного компонента содержат вольфрам. Прогнозные ресурсы, локализованные в пределах республики, относятся к наименее достоверной категории Р3.
В Республике Хакасия, в пределах Алтае-Саянской металлогенической провинции, расположены штокверковые месторождения Сорское и Агаскырское, суммарно заключающие 12 % запасов молибдена страны, с рудами среднего качества (0, 06 % и 0, 05 % Мо соответственно). В республике также разведано Ипчульское место рождение штокверковых собственно молибденовых руд сопоставимого качества (0, 061 % Мо), запасы которого в количестве 144, 5 тыс. т отнесены к забалансовым.
Алтае-Саянская провинция обладает значительными перспективами наращивания сырьевой базы молибдена - на территории Красноярского края в ее пределах расположено Джетское рудопроявление с прогнозными ресурсами Р1, оцененными в 150, 9 тыс. т молибдена.
В Курганской области разведано новое Коклановское штокверковое собственно молибденовое месторождение, запасы которого превышают 155 тыс. т при среднем содержании молибдена в рудах 0, 082 %; подсчитаны также запасы попутного вольфрама. Возможности прироста запасов металла в регионе не определены.
В Свердловской области, в пределах Уральской металлогенической провинции расположено среднемасштабное Южно-Шамейское месторождение штокверковых руд среднего качества (0, 07 % Мо). Запасы объекта составляют немногим более 60 тыс. т молибдена, однако на его флангах локализованы прогнозные ресурсы Р1 в количестве 40 тыс. т, а в расположенном неподалеку рудопроявлении Партизанское - еще 20 тыс. т.
В Республике Карелия (Карело-Кольская металлогеническая провинция) разведано штокверковое месторождение Лобаш, заключающее около 6 % запасов молибдена страны (128, 6 тыс. т). Месторождение характеризуется средним качеством руд (0, 069 % Mo). В республике локализованы прогнозные ресурсы только категории Р3.
На территории Кабардино-Балкарской Республики (Северо-Кавказская металлогеническая провинция) находятся скарновые месторождения вольфрама с попутным молибденом - Тырныаузское (0, 077 % Мо) и Гитче-Тырныауз (0, 065 % Мо). Суммарные запасы молибдена в рудах двух объектов республики составляют всего 62, 5 тыс. т. Прогнозные ресурсы молибдена в республике не оценены.
Прирост запасов молибдена категорий А + В + С1 за счет геологоразведочных работ (ГРР) в 2015 г. составил 25, 5 тыс. т. Практически полностью он получен благодаря постановке на государственный учет запасов для открытой отработки Коклановского штокверкового месторождения в Курганской области в количестве 24, 5 тыс. т категории С1 и 131, 2 тыс. т - категории С2. Также на учет впервые поставлено Иканское медно-порфировое месторождение в Амурской области с запасами попутного молибдена категории С2 - 9, 8 тыс. т и забалансовыми запасами - 3, 67 тыс. т; содержание молибдена в рудах месторождения низкое - 0, 006 %. На объекте утверждены временные разведочные кондиции для открытой отработки.
Незначительный прирост запасов А + В + С1 получен также на разрабатываемых месторождениях Михеевское в Челябинской области (584 т) и Сорское в Республике Хакасия (388 т).
В результате переоценки значительно сократились оставшиеся в недрах после отработки запасы Тырныаузского месторождения в Кабардино-Балкарской Республике: запасы категорий А + В + С1 уменьшились на 94, 3 тыс. т (72, 5 %), составив 35, 8 тыс. т, категории С2 - на 12, 8 тыс. т (94 %), до 0, 8 тыс. т; при этом его забалансовые запасы увеличились в 200 раз, до 101, 6 тыс. т.
В итоге с учетом добычи, потерь при добыче, разведки, переоценки и по другим причинам в 2015 г. отечественные запасы молибдена категорий А + В + С1 сократились на 73, 2 тыс. т, или на 5 % относительно 2014 г., а запасы категории С2 выросли на 127, 6 тыс. т (21 %).
В 2015 г. добыча молибдена в России составила 4756 т, что на 2 % больше, чем в предыдущем году. После приостановки в 2013 г. работы ГОКа на Жирекенском месторождении в Забайкальском крае, основным продуцентом молибдена страны стало ООО "Сорский ГОК", разрабатывающее одноименное месторождение в Республике Хакасия. В 2015 г. на объекте извлечено из недр 4082 т молибдена, что обеспечило 86 % добычи металла страны. В качестве попутного компонента молибден также добывался на медно-порфировом Михеевском месторождении в Челябинской области (576 т) и молибден-урановых месторождениях Стрельцовское (63 т) и Мало-Тулукуевское (35 т) в Забайкальском крае; из руд этих объектов молибден не извлекался.
Производство молибденовых концентратов и ферромолибдена, содержащего более 65 % Мо, в России ведется на обогатительных фабриках и металлургических предприятиях, входящих в структуру компаний ООО "Сорский ферромолибденовый завод" и ООО "Жирекенский ферромолибденовый завод". В 2015 г., как и в 2014 г., производство на мощностях ООО "Жирекенский ферромолибденовый завод" не осуществлялось. На обогатительной фабрике ООО "Сорский ферромолибденовый завод" выпущено 7590, 1 т молибденового концентрата, содержащего 3253, 6 т молибдена - на 4, 5 % больше, чем в 2014 г. На ферромолибденовом заводе компании произведено 4659, 7 т ферромолибдена, что на 3, 5 % больше результата предыдущего года.
Еще одним крупным производителем ферромолибдена в стране является ЗАО "Камышинский литейно-ферросплавный завод" в Волгоградской области, годовой мощностью 1500 т продукта. Собственной сырьевой базы предприятие не имеет и работает на импортных концентратах. Предприятие выпускает ферромолибден с содержанием молибдена 62 %.
Всего в России в 2015 г. произведено 6548 т ферромолибдена.
В результате создания в середине 2000-х гг. предприятий по производству ферромолибдена на базе Сорского и Жирекенского месторождений, существенно снизились объемы поставок молибденовых концентратов на экспорт и прекратилось их поступление на российский рынок. В 2015 г. экспорт молибденовых концентратов составил 483 т и был осуществлен в Нидерланды.
В связи с отсутствием молибденового сырья на внутреннем рынке, отечественные предприятия (в частности, ЗАО "Камышинский литейно-ферросплавный завод") вынуждены закупать его за рубежом. В 2015 г. импорт молибденовых концентратов составил 4538 т; более половины (57 %) было закуплено в Чили, значительное количество концентрата также приобретено в США (17 %) и Нидерландах (12 %).
Видимое внутреннее потребление молибденовых концентратов в России в 2015 г. оценивается в 11645 т.
Основная часть произведенного в России ферромолибдена поставляется зарубежным потребителям; в 2015 г. его экспорт составил более трех четвертей выпущенного объема - 5092 т. Свыше 85 % этого количества продано в Нидерланды, еще почти 10 % в Канаду. Российский импорт ферромолибдена незначителен (314 т в 2015 г.) и осуществляется в основном из Украины. Видимое потребление ферромолибдена в России оценивается в 1770 т.
Отечественная сырьевая база молибдена сформирована месторождениями, сопоставимыми с зарубежными по качеству руд и масштабам оруденения, которые, в большинстве своем, находятся в районах с развитой инфраструктурой и в целом являются инвестиционно привлекательными. Однако перспективы их освоения напрямую зависят от ситуации на мировом рынке молибдена. Падение цен спровоцировало сворачивание работ по освоению собственно молибденовых месторождений и, частично, по производству металла. Осенью 2013 г. остановлена работа Жирекенского ГОКа, в период с конца 2014 г. по 2016 г. приостановлены либо прекращены работы по подготовке к эксплуатации всех осваиваемых отечественных собственно молибденовых месторождений: Бугдаинского, Орекитканского, Жарчихинского и Агаскырского. При этом, страна осуществляет импорт молибденовых концентратов, необходимых производителям ферромолибдена, не имеющим собственной сырьевой базы. В этой связи в качестве потенциального источника молибдена можно рассматривать молибден-медно-порфировые месторождения; именно такие объекты являются важнейшим поставщиком металла за рубежом.
1.3.5 Основные проблемы производства редких и редкоземельных металлов
В период технической модернизации действующих, и, тем более, в период создания новых производств РЗМ, следует оценить возможности организации малых-средних горнотехнологических производств на базе доступных месторождений Кольского региона, представленных наиболее востребованными иттриевоземельными рудами.
К сожалению, в последние десятилетия месторождения с ведущей иттриевоземельной рудной специализацией не привлекают внимание геологоразведочных организаций и тем более каких-либо инвесторов, как государственных, так и частных. Однако, в свое время, научными специалистами КНЦ РАН были проведены исследования, которые в разное время обусловили проведение на них рекомендованных производственных работ, результаты которых по разным причинам остались нереализованными. Следует иметь в виду, что подобные небольшие, но богатые РЗМ объекты могут быть выделены в других районах Кольского и Карельского регионов, а также на Урале, на юге Сибири и в Приморском крае. За рубежом такие месторождения служат объектами добычи редкоземельных и сопутствующих редкометальных минералов ручной рудоразборкой. Среди техногенных ресурсов РЗМ следует выделить Куларское россыпное месторождение, отработанное на золото и представленное песками с нерадиоактивным монацитом (куларитом). Это месторождение в настоящее время служит объектом доизучения и оценки ОАО "Уранцветмет" на РЗМ иттриевоземельной группы с остаточным золотом.
Единственным источником минеральной циркониевой продукции с сопутствующим гафнием в нашей стране в настоящее время является ОАО "Ковдорский ГОК". Однако эта продукция представлена уникальным бадделеитовым концентратом, который нигде в мире, кроме Ковдора, не выпускается. В результате изучения коренных апатит-магнетитовых руд, содержащих бадделеит, и хвостов их обогащения, установлена и реализована возможность извлечения из этих "отходов" ковдорского производства апатита и бадделеита. Согласно исследованиям в бадделеитах Ковдора, кроме естественных радионуклидов, выявлено стабильно высокое и практически интересное содержание гафния (13-15 кг/т) как изоморфного спутника циркония, а также скандия (200 г/т), оксидов тантала (1-1, 5 кг/т) и ниобия (1, 8-4, 7 кг/т), суммы оксидов редких земель (130-150 г/т). Таким образом, содержание указанных редких металлов определяет повышенную извлекаемую ценность ковдорского бадделеита, что ориентирует на увеличение стоимости товарных бадделеитовых концентратов как комплексного, высоколиквидного редкометального продукта.
К сожалению, эксплуатация титаново-циркониевых россыпных месторождений с промышленными запасами циркона и содержащегося в нем гафния пока в нашей стране не организована, хотя это сырье крайне необходимо для удовлетворения потребностей в цирконии и гафнии атомной промышленности.
В настоящее время очевидна необходимость оперативного изменения сложившейся в России ситуации, прежде всего в отношении лития, бериллия и РЗМ, а также ниобия, циркония (с гафнием) и широкого круга рассеянных редких металлов, без которых развитие ОПК и высокотехнологичных гражданских отраслей промышленности практически невозможно.
Организация редкометального импортозамещения имеет свою специфику и поэтому должна проводиться системно, с учетом мировых тенденций, возможностей и перспектив создания, сбалансированных и эффективных производств редких и редкоземельных металлов полного технологического цикла (горная добыча - обогащение - химико-металлургические переделы - промышленное использование).
Хоть металлургия редких и редкоземельных металлов, в основном базируется на общих принципах, но в тоже время, отличается применением индивидуальных химико-металлургических технологий, обработкой и областями применения полученных металлов.
Раздел 2. Процессы производства редких металлов
Технологические методы получения всех редких металлов высокой чистоты включают три основные последовательные стадии: разложение рудных концентратов, получение чистых химических соединений (оксидов или солей), выделение металла из его соединения. Во всех случаях металлургической переработке рудного сырья предшествует его обогащение.
На первой стадии из коллективного концентрата отделяют извлекаемый металл от сопутствующих примесей, концентрируя его в растворе, осадке или пыли пирометаллургическим способом (обжигом, сплавлением, дистилляцией) или выщелачиванием растворами кислот, гидроксидов щелочных металлов или солей.
На второй стадии выделяют и очищают химическое соединение гидрометаллургическими (осаждением из растворов, кристаллизацией, сорбцией, экстракцией и др.) или пирометаллургическими (дистилляцией или ректификацией) способами.
Третья стадия - цементация или электролиз - завершается получением чистых редких металлов (из водных растворов), восстановлением оксидов водородом, оксидом углерода или углеродом при повышенных температурах, а также их восстановлением металлотермическим способом или электролизом расплавленных солей.
2.1 Бериллий
Технологии получения соединений бериллия
Из черновых бериллиевых концентратов получают оксид и гидроксид бериллия, из которых затем получают фторид или хлорид бериллия - исходные соли для производства металлического бериллия.
В промышленной практике преимущественно применяют сульфатный способ переработки концентратов для получения оксида и гидроксида бериллия.
Сульфатный способ основан на переводе бериллия вместе с алюминием и железом в сернокислый раствор с оставлением основной массы диоксида кремния в нерастворимом остатке. Поскольку берилл медленно реагирует с концентрированной серной кислотой даже при температуре 200 °С - 250 °С, проводят подготовительные операции сплавления концентрата с известью или термическое активирование берилла.
С известью концентрат плавят в электродуговых печах при температуре 1500 °С - 1600 °С. Ориентировочно протекающий процесс описывается реакциями:
Be3Al2(Si6O18) + 7СаО = 3CaBeSiO4 + СаОАl2O3 + 3CaSiO3
(2.1)
CaBeSiO4 → ВеО + CaSiO3
(2.2)
Расплав гранулируют в воде и гранулы измельчают. Образующиеся в результате плавки соединения хорошо разлагаются концентрированной серной кислотой.
При термическом активировании берилла концентрат плавят при температуре 1700 °С в дуговой печи с последующим быстрым охлаждением плава (закалкой) грануляцией в холодной проточной воде. Преимущество термического активирования перед плавкой с известью - меньший расход серной кислоты, которую в этом случае не приходится расходовать на взаимодействие с соединениями кальция.
Сульфатизация и выщелачивание
Для перевода бериллия и других компонентов в сульфаты измельченный гранулированный материал обрабатывают концентрированной серной кислотой при температуре 150 °С - 200 °С в стальных реакторах. Затем полусухую массу выщелачивают водой при нагревании. В раствор переходят сульфаты бериллия, алюминия, железа, магния.
Из очищенного раствора выделяют гидроксид бериллия Ве(ОН)2 двумя способами:
1 Прямое осаждение гидроксида бериллия добавлением гидроксида натрия или пропусканием аммиака. При pH 7, 5 и нагревании раствора до температуры 95 °С - 98 °С выделяются хорошо фильтруемые осадки гидроксида бериллия (β-форма).
2 Гидролитическое разложение бериллата натрия, полученного при добавлении в раствор сульфата избытка гидроксида натрия:
BeSO4+ 4NaOH = Na2BeO2 + Na2SO4 + 2Н2O
(2.3)
Na2BeO2+ 2Н2O = Ве(ОН)2 + 2NaOH
(2.4)
Полученный технический гидроксид бериллия служит исходным материалом для получения чистого оксида бериллия и его солей. Из него также получают прокаливанием при температуре 700 °С - 800 °С и технический оксид бериллия.
Для получения оксида бериллия высокой чистоты, применяемого в ядерной энергетике и производстве огнеупорных изделий, технический гидроксид очищают, используя различные способы.
Карбонатно-аммонийный способ очистки основан на растворении гидроксида бериллия в насыщенном растворе карбоната аммония, тогда как гидроксид алюминия и железа нерастворимы в них.
Дополнительная очистка от следов тяжелых металлов достигается осаждением сульфидов. При кипячении раствора комплексный карбонат (NH4)2[Be(CO3)2] разлагается с выделением основного карбоната бериллия. Прокаливанием последнего получают оксид бериллия.
Эффективен ацетатный способ очистки, который заключается в возгонке оксиацетата бериллия Ве4O(СH3СOO)6 при температуре 360 °С - 400 °С. Иногда чистый оксид бериллия получают через кристаллогидрат сульфата бериллия BeSO4•4H2O, который кристаллизуют выпариванием из сульфатного раствора.
Металлургия бериллия
Для металлотермического восстановления бериллия используют его фторид, который обладает высокими температурами плавления (800 °С) и кипения (1327 °С). Это позволяет проводить восстановление при атмосферном давлении с подъемом температуры выше плавления бериллия (1284 °С), в результате чего легко отделить металл от расплава солей. В качестве восстановителя используют магний, не образующий с бериллием соединений и твердых растворов:
BeF2 + Mg = Be + MgF2,
DG1000K = -118 кДж, Н298К = -150 кДж.
(2.5)
Восстановление ведут в графитовых тиглях, нагреваемых в индукционных печах.
При охлаждении тигля бериллий затвердевает раньше шлака, что позволяет извлечь слиток бериллия из расплава солей щипцами.
Промышленный способ электролитического получения бериллия основан на использовании хлоридного электролита, содержащего хлориды в соотношении BeCl2 : NaCl = 1 : 1 (по массе). Это соотношение близко к составу эвтектики (58, 7 % ВеСl2 + 41, 3 % NaCl), плавящейся при 215 °С, что позволяет проводить электролиз при низкой температуре (350 °С).
Напряжение разложения хлорида бериллия в расплаве эвтектического состава при температуре 420 °С равно 2, 08 В. Электролиз ведут в электролизерах из никеля. Анодом служит графитовый стержень, катодом - никелевые сменные перфорированные тигли (рисунок 2.1).
Катод с осадком бериллия извлекают из ванны в горячем состоянии. После охлаждения катодный продукт для отделения электролита от металла промывают водой, раствором гидроксида натрия, разбавленного азотной кислотой, снова водой, центрифугируют и сушат.
Чешуйчатый бериллий прессуют в брикеты на гидравлическом прессе, брикеты переплавляют в вакуумной печи в тиглях из оксида бериллия. Содержание примесей в электролитическом бериллии после вакуумной переплавки, %: Fe - 0, 007; Al - 0, 003; Si - 0, 02-0, 003; Ni - 0, 003; Cl - 0, 002; Ca - 0, 003.
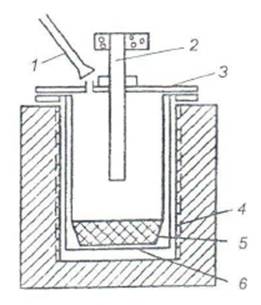
1 - труба для отсоса газов; 2 - графитовый анод; 3 - крышка; 4 - электропечь; 5 - сменный никелевый катод; 6 - ванная из никеля
Рисунок 2.1 - Электролизер со сменным катодом для получения бериллия
Литой бериллий обычно имеет крупнокристаллическую структуру, что в связи с большой анизотропией свойств кристаллов бериллия затрудняет его обработку давлением. Поэтому большую часть компактных бериллиевых заготовок и изделий получают методами порошковой металлургии.
Исходные порошки бериллия приготовляют измельчением бериллиевой стружки, полученной резанием на станке бериллиевых слитков вакуумной переплавки. Стружку измельчают в водоохлаждаемом дисковом истирателе, футерованном бериллием, в среде сухого инертного газа.
Прессование заготовок из порошка требует высокого давления - 1-1, 5 ГПа, так как частицы бериллия малопластичны. Спекание проводят в вакууме при температуре 1200 °С, после чего дополнительно прессуют на холоде под давлением 1-1, 5 ГПа. Цилиндрические заготовки прессуют при температуре 1120-1180 °С и давлении 3-7 МПа.
2.2 Литий
Технология получения лития
Термическое обогащение (декриптацию) применяют при обогащении сподуменовых руд. Способ основан на переходе а-сподумена в (3-сподумен при нагревании руды до температуры 1000 °С - 1100 °С. Превращение сопровождается изменением объема, что приводит к разрушению вмещающей сподумен породы с выделением 3-сподумена в виде измельченной фракции, отделяемой грохочением или воздушной сепарацией. Извлечение лития в концентрат составляет 60 % - 80 %.
Флотацию сподумена осуществляют с применением анионных собирателей (жирных кислот и их мыл) с выделением в пенный продукт литиевых минералов (прямая флотация) или с использованием катионных собирателей при выделении в пенный продукт минералов пустой породы, тогда как литиевые минералы остаются в хвостах (обратная флотация).
Для флотации лепидолита используют преимущественно обратную флотацию с катионными собирателями.
Продуктами переработки литиевых концентратов являются соли лития (карбонат, сульфат, хлорид) и гидроксид. Наиболее распространенный конечный продукт - карбонат лития. Он служит исходным материалом для получения других соединений, в частности хлорида лития, из которого получают металлический литий.
В промышленной практике применяют преимущественно три способа разложения литиевых концентратов: сернокислотный, сульфатный (спекание с и известковый. Кроме того, иногда используют известково-хлоридный способ.
Сернокислотный способ применяют для литиевых концентратов всех типов: сподуменовых, лепидолитовых и амблигонитовых. В результате разложения концентрированной серной кислотой при температуре 200 °С - 250 °С и последующего выщелачивания продукта водой получают растворы, содержащие сульфат лития, из которых осаждают карбонат лития.
Переработка сподумена. Для эффективного разложения сподумена серной кислотой необходима первоначальная термическая обработка. Серная кислота практически не разлагает α-сподумен. Обжиг проводят в барабанной печи. Особенность взаимодействия серной кислоты с р-сподуменом состоит в замещении катионов лития протонами кислоты при сохранении структуры β-сподумена.
Сульфатизированный материал выщелачивают водой, подавая в реактор мел для нейтрализации избытка серной кислоты (до pH 6-6, 5). Отфильтрованный раствор очищают от магния нейтрализацией известью (pH 12-14), а затем от кальция осаждением карбоната кальция СаСO3 содой.
После отделения осадка фильтрацией из раствора осаждают карбонат лития насыщенным раствором соды. Промытые осадки содержат 96-97 % Li2CO3. Извлечение в карбонат лития из сподуменового концентрата 85-90 %.
Переработку лепидолита осуществляют непосредственно серной кислотой при температуре 320 °С - 330 °С. Для ускорения процесса иногда применяют предварительное плавление лепидолита при температуре 1090 °С, превращая его в стеклообразную массу, которую после измельчения сульфатизируют.
Получаемые при переработке лепидолита сернокислые растворы содержат сульфаты: Li2SO4, K2SO4, Na2SO4, Al2(SO4)3. Из отфильтрованного раствора осаждают карбонат лития.
Сульфатный способ основан на спекании литиевых концентратов с сульфатом калия с последующим выщелачиванием спека водой.
2(U, Na)[Al(SiO3)J + K2SO4 = 2(K, Na)[Al(SiO3)2J + Li2SO4
(2.6)
Так как реакция (2.6) обратима, требуется большой избыток сульфата калия (до 150 %) для обеспечения высокой степени превращения.
Спекание проводят в барабанных печах при температуре 1100 °С - 1150 °С в течение 1-2 ч. Выщелачивание ведут на холоде в барабанных мельницах (растворимость сульфата лития Li2SO4 понижается с повышением температуры).
Сульфатный способ применяют также для переработки лепидолита и циннвальдита. Различие состоит лишь в дозировке сульфата калия в шихте и более низкой температуре спекания (850 °С - 950 °С).
Преимущество сульфатного способа переработки литиевого сырья - его универсальность и высокая степень вскрытия концентратов, недостаток - высокий расход сульфата калия. При известковом способе литиевые концентраты (сподумен или лепидолит) спекают с известью или мелом. При последующем выщелачивании спека водой получают раствор, содержащий гидроксид лития, который кристаллизуется в результате выпаривания раствора в составе моногидрата LiOH•H2O.
Известковый способ применяют также при переработке лепидолитовых концентратов. В отличие от сподумена спекание лепидолита с известью (или мелом) проводят при более низкой температуре (900 °С - 950 °С).
Преимущества известкового способа - применимость к любым типам литиевых концентратов, возможность прямого получения гидроксида лития.
В последние годы интенсивно разрабатываются способы получения литиевых солей из нетрадиционных видов сырья. Литий производится из природных рассолов в США и Чили. В Чили на базе подземных рассолов месторождения в пустыне Атакама построен комбинат. Состав различных рассолов литийгидроминерального сырья (ЛГМС) приведен в табл. 2.1.
Таблица 2.1 - Характеристика ЛГМС наиболее известных месторождений мира
|
N п/п |
Страна (месторождение) |
Концентрация, г/л | ||||||
|
Li+ |
Na+ |
K+ |
Mg2+ |
Ca2+ |
Cl-1 |
SO42- | ||
|
1 |
США, Невада (оз. Силвер-Пик) |
0, 44 |
88, 0 |
11, 0 |
0, 7 |
0, 6 |
128, 5 |
Нет данных |
|
2 |
Чили (Атакама) |
0, 5-0, 2 |
113, 4 |
32, 1 |
11, 4 |
0, 5 |
210, 6 |
17, 2 |
|
3 |
Боливия (Де-Уюни) |
0, 8-2, 0 |
105, 2 |
24, 2 |
16, 6 |
0, 5 |
190, 5 |
9, 1 |
|
4 |
Россия (Тарумовское) |
0, 2 |
67, 0 |
3, 8 |
0, 8 |
10, 1 |
127, 3 |
Нет данных |
|
5 |
Китай, Цинхай (Дунтай) |
0, 49 |
68, 6 |
17, 7 |
29, 3 |
- |
190, 4 |
23, 1 |
|
6 |
Китай, Цинхай (Илипин) |
0, 96 |
1, 4 |
1, 1 |
107, 8 |
4, 3 |
326, 0 |
0, 1 |
|
7 |
Россия, Республика Саха (Удачнинский комплекс) |
0, 41 n |
35, 6 |
20, 3 |
11, 2 |
65, 5 |
220 |
- |
|
8 |
Россия, Красноярский край (Сухотунгусское) |
0, 22 |
46, 8 |
23, 1 |
9, 5 |
58, 8 |
233, 9 |
- |
|
9 |
Россия, Эвенкия (Верхнекостинское) |
0, 45 |
50, 2 |
19, 7 |
11, 2 |
81, 7 |
271, 8 |
- |
|
10 |
Россия, Иркутская область (Знаменское) |
0, 48 |
2, 4 |
4, 3 |
28, 5 |
134, 3 |
322, 5 |
- |
|
11 |
Россия, Иркутская область (Ковыктинское) |
0, 39 |
1, 9 |
11, 7 |
29, 0 |
154, 0 |
338, 9 |
- |
При стадийном солнечном упаривании происходит последовательное осаждение галита, сильвинита, а также двойной соли Li2SO4•K2SO4. Полученный таким образом литиевый концентрат транспортируется по железной дороге на завод, где рассол очищают от магния известковым молоком, от кальция содой и далее также содой осаждают из него в стандартных условиях карбонат лития. Осадок промывают, сушат и гранулируют. Для выделения лития меньшую часть рассола, полученного после первой стадии испарения и отделения сильвинита (15 % от потока лития), направляют на вторую стадию испарения, а большую часть этого рассола (85 % от потока лития) закачивают обратно в пласт.
На второй стадии испарения при температуре рассола выше 18 °С в процессе его концентрирования литий испаряется в испарительных картах вместе с оставшимся калием в виде двойной соли Li2SO4•K2SO4, которую отделяют от рассола и перевозят на литиевые заводы. Из рассола на второй стадии испарения может быть выделено в виде двойной соли только 50 % лития от его общего содержания. Степень извлечения лития повышают до 70 %, используя рассол, прошедший вторую стадию концентрирования и выпадения двойной соли.
Двойную литиевую соль, осажденную при температуре 25 °С и концентрации лития в рассоле не менее 10 %, затем растворяют в насыщенном растворе хлорида калия, высаливая K2SO4, который являются ликвидным товарным продуктом
LiKSO4+KCl=LiCl+K2SO4↓
(2.6)
Маточный раствор после осаждения K2SO4, представляющий собой практически насыщенный раствор хлорида лития, направляют на осаждение карбоната лития содой по реакции:
2LiCl + Na2CO3 = Li2CO3
(2.7)
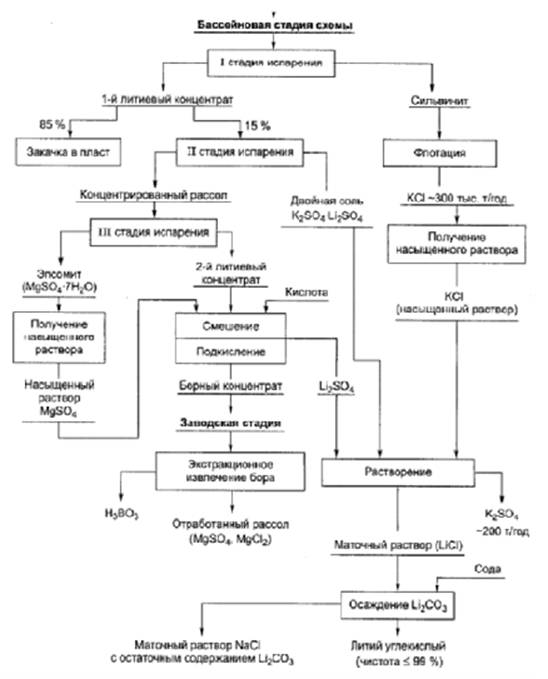
Рисунок 2.2 - Схема переработки литиевых рассолов
Безводный хлорид лития, служащий исходным материалом для производства металлического лития, обычно получают из карбоната лития. По техническим условиям в хлориде лития допускается следующее содержание примесей, %, не более: Na - 0, 12; Са - 0, 03; Al - 0, 05; Fe - 0, 005; SO2- - 0, 1; SiO- - 0, 05; PO- - 0, 005.
Для получения хлорида лития указанной чистоты обычно требуется предварительная очистка карбоната лития от примесей. Очистку осуществляют методом перекристаллизации через хорошо растворимый бикарбонат лития (способ Труста).
Электролиз хлорида лития - наиболее экономичный способ производства металла технической чистоты. Его проводят в диафрагменных или бездиафрагменных электролизерах особой конструкции (рисунке 2.2).
В диафрагменном электролизере (рис. 2.3а) стальной катод введен в днище в центре ванны. На уровне верхнего торца катода расположен кольцевой угольный анод с боковым токоподводом через стенки электролизера. В межэлектродном пространстве установлена сетчатая стальная диафрагма. Исходный хлорид лития погружается заливкой расплава через люк в крышке. Литий при электролизе всплывает на поверхность электролита и удаляется из ванны вручную дырчатой ложкой. Большое поверхностное натяжение лития и плохая смачиваемость сетки удерживают металл в съемной ложке, а электролит легко стекает обратно в ванну через отверстия в сетке.
Рабочей ванной в бездиафрагменном электролизере является катодно-поляризованный стальной тигель, в котором электролит расплавляется за счет теплоты топочных газов (газовая горелка). Графитовый анод вводится сверху. Получаемый при электролизе технический литий содержит 97 % - 98 % Li.
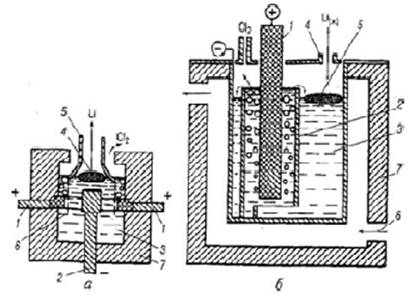
а - диафрагменный электролизер: 1 - кольцевой графитовый анод; 2 - стальной катод; 3 - расплав С-КС; 4 - жидкий литий; 5 - сборник; 6 - стальная сетчатая диафрагма; 7 - теплоизоляция; б - бездиафрагменный электролизер: 1 - графитовый анод; 2 - стальной трубчатый катод; 3 - расплав С-КС; 4 - люк для выборки лития; 5 - литий; 6 - топочные газы; 7 - теплоизоляция
Рисунок 2.3 - Электролизеры для получения лития из расплава LiCl
Для получения металла, пригодного для ядерной технологии, чистота лития повышается его рафинированием.
Эффективен метод рафинирования лития дистилляцией в вакууме. Сначала при температуре 450 °С отгоняют основное количество примесей щелочных металлов (калия, натрия). Затем для более полной очистки литий испаряют при температуре 600 °С - 800 °С под давлением 1, 3•10-3 Па, поддерживая температуру в конденсаторе 340 °С - 420 °С. При извлечении лития в конденсат, равном 85 % - 90 %, содержание примесей в нем снижается до тысячных долей процента.
Литий выпускают в виде слитков, гранул, прутков, проволоки. Хранят его в герметичной железной таре под слоем пастообразной массы из парафина и минерального масла либо под газолином или петролейным эфиром, заполняющим тару доверху. Перед применением лития минеральное масло смывают петролейным эфиром или бензолом, который затем испаряют в вакууме.
2.3 Рубидий
Технология получения рубидия
Большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита. После выделения лития в виде карбоната или гидроксида рубидий осаждают из маточных растворов в виде смеси алюморубидиевых, алюмокалиевых и алюмоцезиевых квасцов RbAl(SO4)2•12H2O, KAl(SO4)2•12H2O, CsAl(SO4)2•12H2O. Смесь разделяют многократной перекристаллизацией.
Рубидий также выделяют и из отработанного электролита, получающегося при получении магния из карналлита. Из него рубидий выделяют сорбцией на осадках ферроцианидов железа или никеля. Затем ферроцианиды прокаливают и получают карбонат рубидия с примесями калия и цезия. При получении цезия из поллуцита рубидий извлекают из маточных растворов после осаждения Cs3[Sb2Cl9]. Можно извлекать рубидий и из технологических растворов, образующихся при получении глинозема из нефелина.
Для извлечения рубидия используют методы экстракции и ионообменной хроматографии. Соединения рубидия высокой чистоты получают с использованием полигалогенидов.
Значительную часть производимого рубидия выделяют в ходе получения лития, поэтому появление большого интереса к литию для использования его в термоядерных процессах в 1950-х привело к увеличению добычи лития, а, следовательно, и рубидия. Именно поэтому соединения рубидия стали более доступными.
2.4 Цезий
Технология получения цезия
При промышленном получении цезий в виде соединений извлекается из минерала поллуцита. Это делается хлоридным или сульфатным вскрытием. Хлоридное вскрытие включает обработку исходного минерала подогретой соляной кислотой, добавление хлорида сурьмы SbCl3 для осаждения соединения Cs3[Sb2Cl9] и промывку горячей водой или раствором аммиака с образованием хлорида цезия CsCl. При сульфатном вскрытии минерал обрабатывается подогретой серной кислотой с образованием алюмоцезиевых квасцов CsAl(SO4)2•12H2O.
Для получения цезия достаточной степени чистоты требуется многократная ректификация в вакууме, очистка от механических примесей на металлокерамических фильтрах, нагревание с геттерами для удаления следов водорода, азота, кислорода и многократная ступенчатая кристаллизация.
Сложности получения цезия обусловливают постоянный поиск его минералов: извлечение этого металла из руд неполное, в процессе эксплуатации материала он рассеивается и потому безвозвратно теряется, Промышленность нуждается именно в очень чистом материале (на уровне 99, 9 % - 99, 999 %), и это является одной из труднейших задач в металлургии редких элементов.
В России переработка и извлечение солей цезия из поллуцита ведется в Новосибирске на ЗАО "Завод редких металлов".
Существует несколько лабораторных методов получения цезия [12]. Он может быть получен:
- нагревом в вакууме смеси хромата или дихромата цезия с цирконием;
- разложением азида цезия в вакууме;
- нагревом смеси хлорида цезия и специально подготовленного кальция.
Все методы являются трудоемкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
2.5 Рений
Технология получения рения
При переработке молибденитовых концентратов, кроме сернокислых растворов мокрых систем пылеулавливания, источниками получения рения могут служить растворы после гидрометаллургической переработки огарков и азотно-сернокислые растворы от разложения молибденита азотной кислотой.
Переработка медно-молибденовых ренийсодержащих промпродуктов в настоящее время осуществляется по схеме окислительного обжига с возгонкой рения, содового выщелачивания обожженного продукта с последующим выделением из растворов молибдата кальция. Возогнанный рений улавливается в мокрой системе очистки газов и затем извлекается по сорбционной схеме в товарный перренат аммония. Окислительно-автоклавное выщелачивание растворами соды и едкого натра обеспечивает извлечение в раствор молибдена и рения до 98 %. Экстракционные методы извлечения молибдена и рения с последующим получением парамолибдата и перрената аммония обеспечивают извлечение из исходного сырья 96 % молибдена и около 90 % рения.
Для выбора способа переработки вовлекаемого в производство сырья необходимо учитывать качество исходного материала, наличие примесей, лимитирующих выбор конечной продукции, а также имеющиеся производственные мощности.
Основными способами переработки ренийсодержащих производственных растворов в настоящее время являются сорбция на высокоосновных анионитах (ионообменных смолах) и жидкостная экстракция.
Газообразные продукты, получающиеся при обжиге молибденитовых концентратов или при плавках медных концентратов, охлаждают, фильтруют и растворяют в серной кислоте с последующим выделением перренатов калия или аммония KReO4 или H4ReО4 ионообменной сорбцией на активированном угле или ионообменных углях, а также жидкостной экстракцией трибутилфосфатом или аминами.
Металлургия рения
Дальнейшая переработка перренатов калия и аммония направлена на получение порошкообразного и компактного рения.
Для получения рениевого порошка перренат аммония (или калия) восстанавливают водородом в трубчатых печах с непрерывной продвижкой лодочек из молибдена.
Полученный водородным восстановлением перрената калия порошкообразный рений содержит ряд легколетучих примесей, которые не позволяют применять его в жаропрочных сплавах и в электронных приборах, работающих в глубоком вакууме. Особенно вредны примеси свинца, олова, кадмия, висмута и сурьмы. Содержание их в металлическом рении не должно превышать 1*10-4 % каждой.
Достаточно полно указанные примеси могут быть удалены вакуумной дистилляцией при нагревании рения до высоких температур при остаточном давлении 1*10-4 мм рт. ст. В этих условиях при 2000 °С наблюдается заметное спекание порошкообразного материала, а при 2300 °С - 2500 °С происходит интенсивная очистка рения от большинства присутствующих в нем примесей. Чистота металла, за вычетом тринадцати примесей (Fe, Al, Mo, К, Na, Ca, Ni, Cu, Pb, Sn, Bi, Cd, Sb), составляет 99, 988 %. Больше всего в рении калия (0, 0035 % - 0, 0030 %) и кальция (0, 0023 % - 0, 050 %). Интенсивное удаление железа и никеля начинается при 2200 °С, а калия и кальция - выше 2300 °С. Содержание алюминия остается практически неизменным.
При исходном содержании в рении 0, 003 % Pb, 0, 0006 % Sn, 0, 0007 % Cd, 0, 0003 % Bi и 0, 0004 % Sb и после выдерживания металла в течение 2 ч и остаточном давлении 1*10-4 мм рт. ст. содержание этих примесей в металле снижается менее чем до 0, 0001 % каждой. Этого же эффекта можно достигнуть, если увеличить продолжительность нагрева до 4-6 ч при 2050 °С.
Снизить содержание кислорода в рении можно также с помощью небольших добавок редкоземельных металлов, особенно лантана, раскисляющих рений. Так, при введении в рений 0, 01 % (по массе) лантана содержание кислорода в раскисленном таким путем рении составит 0, 008 % (по массе) против 0, 015 % (по массе) в исходном литом рении, что позволит снизить твердость и повысить пластические свойства рения.
Глубокую очистку рения от примесей возможно также осуществить через его оксихлориды. Наиболее удобно для этой цели применить монооксихлорид ReOCl4, который плавится при 30 °С и кипит при 228 °С. Это соединение легко очищается ректификацией. Вначале технический рений подвергают хлорированию газообразным хлором, получая пентахлорид рения ReCl5; далее пентахлорид окислением кислородом при 160 °С - 180 °С превращают в монооксихлорид, который и очищают ректификацией. Наконец, чистый ReOCl4 переводят в перренат аммония, который затем восстанавливают до металла.
Полученный металл характеризуется высокой чистотой.
2.6 Галлий
Технология получения галлия
Однако основным источником получения галлия служат растворы глиноземного производства при переработке боксита (обычно содержащие незначительные его примеси (до 0, 1 %)) и нефелина. Галлий также можно получить с помощью переработки полиметаллических руд, угля. Значительно большие его количества (до 1, 5 %) были обнаружены в золе некоторых каменных углей. Извлекается он электролизом щелочных жидкостей, являющихся промежуточным продуктом переработки природных бокситов на технический глинозем. Концентрация галлия в щелочном алюминатном растворе после разложения в процессе Байера: 100-150 мг/л, по способу спекания: 50-65 мг/л. По этим способам галлий отделяют от большей части алюминия карбонизацией, концентрируя в последней фракции осадка. Затем обогащенный осадок обрабатывают известью, галлий переходит в раствор, откуда черновой металл выделяется электролизом. Загрязненный галлий промывают водой, после этого фильтруют через пористые пластины и нагревают в вакууме для того, чтобы удалить летучие примеси. Для получения галлия высокой чистоты используют химический (реакции между солями), электрохимический (электролиз растворов) и физический (разложение) методы. В очень чистом виде (99, 999 %) он был получен путем электролитического рафинирования, а также восстановлением водородом тщательно очищенного GaCl3.
Металлургия галлия
Около 97 % мирового производства галлия идет на различные полупроводниковые соединения. Галлий имеет ряд сплавов жидких при комнатной температуре (так называемых галлам) и один из его сплавов имеет tпл = - 19 °С. По отношению к алюминию и его сплавам галлий понизитель прочности. Галлий и его эвтектический сплав с индием используется как теплоноситель в контурах реакторов.
Металлическим галлием заполняют кварцевые термометры (вместо ртути) для измерения высоких температур.
2.7 Индий
Технология получения индия
Индий не имеет собственных месторождений и способ отработки месторождений различных технологических типов руд, содержащих индий, определяется по основному металлу (меди, цинку, свинцу, олову и т.д.) и не зависит от содержания в них индия (как и прочих попутных металлов).
В промышленном производстве индия можно выделить три основные стадии:
- получение индиевого концентрата с содержанием индия не менее 1 % - 2 %;
- получение чернового индия;
- рафинирование чернового индия.
Цинковые концентраты - основной источник индия в мировой практике и единственный в настоящее время для России...
В мировой практике распространены 3 основных метода переработки цинковых кеков с целью извлечения находящихся в них ценных компонентов. Это вельц-процесс или вельцевание - разрушение ферритов цинка углеродистыми восстановителями С и СО; разложение ферритов сернистым ангидритом или концентрированной серной кислотой (сульфатизация) и непосредственное растворение кеков в серной кислоте при повышенной температуре и кислотности (методы автоклавный: ярозит-процесс и гетит-процесс).
В России наиболее распространено вельцевание (возгонка из твердой шихты). Для выделения индия из предварительно очищенных растворов и получения чернового индия используется метод цементации из сульфатных растворов на цинковых или алюминиевых листах, их хлоридных растворов - цинковой пылью.
Конечной товарной продукцией является металлический индий. Индий поставляется в соответствии с марками ИН-00, ИН-0, ИН-1, ИН-2. Содержание индия в двух первых марках не менее 99, 999 % и 99, 998 %, а десяти контролируемых примесей по 0, 0001 % - 0, 00001 % каждой. Особо чистый индий (более 99, 99999 %) содержит примесей на порядок меньше, чем в обычных марках этого металла.
Для отделения индия от сопутствующих металлов и концентрирования растворов используют экстракцию, например, раствором ди-2-этилгексилфосфорной кислоты в керосине, или ионный обмен, например, на фосфорнокислых катионитах. Выделяют индий из растворов электролизом либо цементацией на металлический Al (т.е. вытеснением индия из раствора по реакции: In3+ + Аl0 = In0 + Аl3+) с последующей переплавкой под слоем щелочи. Для очистки индия используют чаще всего электролитическое рафинирование, вакуумную обработку для удаления летучих примесей, зонную плавку или вытягивание кристаллов из расплава. Предложен также ряд методов очистки индия с промежуточным образованием его соединений, в частности хлоридов.
Вельцевание является наиболее эффективным методом переработки индийсодержащих продуктов, в том числе цинковых кеков.
В ПАО "ЧЦЗ" на основании изучения влияния на извлечение индия, оксида и хлорида кальция разработан способ подачи хлорсодержащих материалов и флюсующих добавок через разгрузочное отверстие вельц-печей. Технология внедрена на крупногабаритной вельц-печи (L = 60 м, D = 4, 0 м). Внедрение позволило увеличить извлечение индия в вельц-окись на 10 %.
Другим направлением совершенствования производства индия явилась модернизация экстракционной установки, которая позволила:
- стабилизировать процесс экстракции индия с высоким содержанием кремнезема из сернокислых растворов, получающихся при выщелачивании вельц-окиси;
- снизить расходы на приготовление аппаратов в 10 раз;
- упростить обслуживание и ремонт экстракционной установки.
2.8 Таллий
Технология получения таллия
В настоящее время источником получения таллия являются сульфидные руды. При обогащении таких руд таллий переходит в медные, цинковые и особенно свинцовые концентраты. Таллий изоморфно входит в состав, как сульфидных руд, так и силикатных минералов, поэтому степень извлечения таллия в концентраты колеблется от 10 % до 80 %. Содержание таллия в обогащенных продуктах составляет около 10-3 %, поэтому такие концентраты не могут служить непосредственным сырьем для промышленного получения таллия. Источником таллия являются отходы медного, цинкового, свинцового и сернокислотного производства - колошниковая пыль, образующаяся при обжиге сульфидных руд, и шлаки, собираемые при выплавке металлов.
В связи с тем, что таллий из перерабатываемых продуктов извлекается обычно в комплексе с рядом других элементов, действующие схемы комплексной переработки металлических руд включают в себя большое количество пиро- и гидрометаллургических операций, являются достаточно сложными и постоянно видоизменяются на предприятиях в зависимости от изменения состава перерабатываемого сырья.
Для получения богатых таллием концентратов пользуются методом возгонки. Таллий может улетучиваться при обжиге как в окислительной, так и в восстановительной атмосфере. Это дает возможность сочетать получение обогащенных таллием возгонов с процессами извлечения других ценных элементов. Особенно высокое обогащение таллием получается при применении хлорирующего обжига - с добавкой хлористого натрия или сильвинита. Равновесие обменной реакции 2NaCl + Tl2SO4 = 2TlCl + Na2SO4 сдвинуто в сторону образования хлорида таллия, который при температуре свыше 600 C обладает хорошей летучестью и почти полностью возгоняется. При окислительном обжиге концентратов, кроме хлорида, возгоняется оксид таллия Tl2O и механически захватывается потоком газа пылевидные частицы сульфата, сульфида и силиката таллия. В пыли и возгонах, получаемых при восстановительных процессах, часть таллия может находиться в виде металла.
Следующей стадией выделения таллия является цикличное выщелачивание возгонов водой, которое нужно проводить при нагревании, так как растворимость таллия сильно зависит от температуры. Иногда вместо водного выщелачивания применяют выщелачивание слабыми содовыми растворами. Это предотвращает переход в раствор хлоридов других металлов, например кадмия. Если основная часть таллия присутствует в виде труднорастворимых соединений, то применяется выщелачивание разбавленной серной кислотой.
Из водных растворов от выщелачивания таллий по разным технологическим схемам выделяют в виде хлорида, сульфида, иодида, хромата, гидроксида трехвалентного таллия или в виде металлического таллия цементацией - осаждением цинковой пылью или амальгамой.
При осаждении таллия в виде сульфида (горячим раствором сульфида натрия) достигается полное извлечение металла из раствора, но этот способ осаждения не является селективным, так как все металлы-спутники таллия также образуют нерастворимые сульфиды, поэтому этот способ применяют только к растворам с низким содержанием примесей. Сульфидный таллиевый концентрат выщелачивают раствором сульфата цинка, при этом в раствор переходит сульфат таллия: Tl2S + ZnSO4 = Tl2SO4 + ZnS. Из полученного раствора металлический таллий выделяют цементацией.
Сейчас время для очистки таллия используют экстракцию из сульфатсодержащих растворов раствором иода в смеси 50 % трибутилфосфата и 50 % керосина. После этого таллий экстрагируют из органической фазы серной кислотой (300 г/л) с добавкой перекиси водорода.
Технически чистый таллий очищают от других элементов, содержащихся в колошниковой пыли (Ni, Zn, Cd, In, Ge, Pb, As, Se, Te), растворением в теплой разбавленной кислоте с последующим осаждением нерастворимого сульфата свинца и добавлением HCl для осаждения хлорида таллия (TlCl). Дальнейшая очистка достигается электролизом сульфата таллия в разбавленной серной кислоте с использованием проволоки из платины с последующим плавлением выделившегося таллия в атмосфере водорода при 350 °С - 400 °C.
2.9 Германий
Технология получения германия
Германий извлекается из продуктов металлургической переработки сульфидного сырья, в котором он находится в виде изоморфной примеси в минералах меди, цинка, свинца. Помимо перечисленных, источниками германия могут быть некоторые железные руды и каменные и бурые угли, преимущественно малометаморфизированные.
В зависимости от состава исходного сырья применяют различные способы их первичной обработки для получения более богатых германием продуктов - германиевых концентратов.
Выщелачивание серной кислотой. При большом содержании в исходном материале сульфидов, выщелачиванию предшествует окислительный обжиг. При выщелачивании материала 10-15 %-ной серной кислотой германий (вместе с кадмием, цинком, мышьяком, частью железа) извлекается в раствор.
Сульфатизирующий обжиг. Для перевода германия и других составляющих исходного сырья в сульфаты нагревают исходный материал с серной кислотой при температуре 450 °С - 500 °С и затем выщелачивают продукт сульфатизации разбавленной серной кислотой.
Возгонка GeS в восстановительной среде, основанная на летучести, применяется для извлечения германия из рудных концентратов, пылей и других видов сырья. Материал нагревают в присутствии сульфитизирующего агента (пирита или серы) при температуре 800 °С - 900 °С в среде генераторного газа.
Восстановительная плавка в присутствии меди применяется для относительно богатого исходного материала. При этом получают сплав меди с германием. Полученный сплав меди с германием содержащий 3 % - 4 % Ge растворяют в соляной кислоте. Из раствора дистиллируют тетрахлорид германия GeCl4.
Методы экстракции и сорбции применяют для получения германия из бедных растворов (0, 01-0, 1 г/дм3 Ge).
Экстракция. Из солянокислых растворов высокой концентрации (9-11 н. HCl), в которых содержатся недиссоциированные молекулы тетрахлорида германия GeCl4, германий избирательно экстрагируют смесями углеводородов, в частности керосином. Из органической фазы германий реэкстрагируют водой, получая реэкстракты со степенью концентрирования 100 и более раз.
Сорбционные методы. Германий сорбирует из слабощелочных растворов; на анионитах, а из слабокислых растворов - на катионитах. Ионообменная сорбция германия менее избирательна, чем экстракция, и мало используется в промышленной практике.
Из полученных в результате экстракций или ионного обмена растворов с повышенной концентрацией германия осаждают германиевый концентрат. Германиевые концентраты выделяют из сернокислых растворов, осаждая, малорастворимые соединения или используя метод цементации.
Осаждение танниносодержащими веществами. Из бедных растворов (например, надсмольных вод) германий полно осаждается таннином (или содержащим таннин дубовым экстрактом).
Осаждение германата магния. При содержании в растворах 1-2 г/дм3 Ge можно из раствора добавлением оксида магния выделить германат магния Mg2GeO4.
Соосаждение с гидроксидом железа применяют для бедных растворов с концентрацией германия 0, 01-0, 02 г/дм3.
Цементация. Нормальный потенциал германия - 0, 15 В. Это позволяет выделить германий из растворов цементацией на цинковой пыли.
Общепринятая технология получения диоксида германия высокой чистоты включает три стадии: получение технического тетрахлорида германия из германиевых концентратов (а также отходов германия); очистку тетрахлорида германия и получение диоксида германия из очищенного тетрахлорида.
В современных производствах сочетают очистку технического тетрахлорида германия экстракцией соляной кислотой с очисткой ректификацией.
Очистка экстракцией соляной кислотой. Очистка германия экстракцией соляной кислотой основана на ограниченной смешиваемости его тетрахлорида и концентрированной соляной кислоты и различной растворимости в них хлоридов примесных элементов, в частности мышьяка.
Очистка ректификацией. Дополнительную глубокую очистку тетрахлорида германия осуществляют ректификацией.
Более совершенный процесс очистки, используемый на отечественных предприятиях, - непрерывная экстрактивная ректификация тетрахлорида германия, в которой ректификация сочетается с экстракцией примесей соляной кислотой из хлорида, находящегося в паровой фазе.
Восстановление диоксида германия водородом - наиболее распространенный в промышленной практике способ получения германия.
Металлургия германия
Германий, полученный восстановлением высокочистого диоксида водородом, непригоден для применения в полупроводниковой электронике.
Необходимая степень очистки достигается применением кристаллизационных методов. Из очищенного этими методами германия затем получают монокристаллы. Применение монокристаллов позволяет обеспечить стандартность электрических свойств германия.
Для получения монокристалла германия применяют способ вытягивания из расплава (способ Чохральского) и горизонтальную зонную плавку.
Для оценки качества получаемых монокристаллов германия обычно определяют без разрушения слитка тип проводимости, удельное сопротивление, время жизни неравновесных носителей заряда.
2.10 Гафний
Технология получения гафния
Ввиду отсутствия у гафния собственных минералов и постоянного сопутствия его цирконию, его получают путем переработки циркониевых руд, где он содержится в количестве 2, 5 % от веса циркония (циркон содержит 4 % HfO2, бадделеит - 4 % - 6 % HfO2). В мире в год в среднем добывается около 70 т гафния, и объемы его добычи пропорциональны объемам добычи циркония.
Металлический гафний в настоящее время получают восстановлением. Полной аналогии в свойствах продуктов плазменно-фторидной и экстракционно-фторидной технологий производства циркония нет, поскольку в экстракционно-фторидной технологии цирконий и гафний разделяют на гидрохимической стадии с помощью экстракции. В случае использования плазменно-фторидной технологии переработки циркона при сублимационной очистке циркония от примесей гафний в основном следует за цирконием. Гафниевую фракцию для очистки от обычных примесей (Fe, Al и др.) фильтруют через слой фосфатной катионообменной смолы РФ, причем гафний целиком поглощается сорбентом. Вымывание гафния со смолы осуществляют раствором оксалата аммония. Таким образом, был получен концентрат гафния 99 %. В технологии чистых соединений циркония применяют, в основном, перекристаллизационные, осадительные и экстракционные методы очистки. Метод ионного обмена применим к гафнию, поскольку масштабы производства существенно меньше.
Интересна особенность скандиевого минерала - тортвейтита: в нем содержится гафния в процентном отношении гораздо больше, чем циркония, и это обстоятельство очень важно при переработке тортвейтита на скандий и концентрировании гафния из него.
2.11 Селен и теллур
Технология получения селена и теллура
Селен и теллур - неметаллы, входят в состав около 80 собственных минералов. В этих минералах они представлены селенидами, теллуридами, рядом окисленных и сульфидных соединений. Месторождения собственно селена и теллура неизвестны. Обычно они присутствуют в медных, медно-цинковых, медно-никелевых и полиметаллических свинцово-цинковых рудах. При обогащении таких руд большая часть селена и теллура остается в хвостах обогащения и в пиритных концентратах.
При переработке сульфидных руд селен и теллур накапливаются в отходах металлургического производства - в пылях обжиговых и плавильных печей, анодных шламах электролитического рафинирования меди, илах сернокислотного производства. Эти продукты могут являться источниками получения селена и теллура. Их собственные минералы не имеют практического значения. Возможными источниками производства селена и теллура являются селенсодержащие и особенно теллурсодержащие золотые руды.
Главнейшим источником селена и теллура в современной металлургической практике являются анодные шламы электролитического рафинирования меди.
Технологические схемы извлечения селена и теллура из шламов медеэлектролитных заводов весьма сложны и многообразны. Выбор такой схемы зависит, в основном, от соотношения содержания этих двух элементов и благородных металлов, а также от масштабов производства.
Состав анодных шламов медного производства колеблется в пределах, %: 10-45 Сu; 0, 05-5 Au; 5-45 Ag; 2-18 Se; 0, 3-10 Те; 2-40 Pb; 0, 5-16 Sb; 0, 5-9 As.
Комплексную переработку анодных шламов обычно начинают с обезмеживания (перевода меди из шлама в раствор). Процесс осуществляют в реакторах при аэрации суспензии шлама в растворах серной кислоты воздухом:
Сu + H2SO4 + 0, 5О2 = CuSO4 + Н2O.
(2.8)
Для обезмеживания шламов на ряде производств используются автоклавы, где процесс ведут при повышенном давлении кислорода.
По окончании процесса обезмеживания пульпу фильтруют и кек направляют на извлечение селена и теллура. Извлечение селена в раствор при переработке шлама осуществляют посредством обжига: окислительного или сульфатизирующего с переводом селена в газообразный диоксид и его улавливанием в кислые или щелочные растворы. Вариантом извлечения селена из шламов может служить способ спекания с содой.
Применяемый ранее на предприятиях сульфатизирующий обжиг шлама, также как и технология спекания с содой, отличаются низкой эффективностью и высокой экологической опасностью, в настоящее время практически не используются.
Сегодня на большинстве медерафинировочных производств мира применяют окислительный обжиг. Основной процесс - окисление с использованием воздуха, КВС (кислородо-воздушной смеси) или технического кислорода. В течение процесса проходит взаимодействие с кислородом присутствующих в шламе селенидов и теллуридов металлов - меди, серебра, свинца, палладия и ряда других. Например:
Ag2Se+3/2O2=Ag2O+SeO2↑
(2.9)
Cu2Te + 2O2 = CuTeO3 + CuO
(2.10)
Процессы окисления проходят в диапазоне температур 300-700 °С. В отличие от теллура, образующего нелетучие теллуриты меди, свинца, серебра и золота, селен переходит в газообразный диоксид. В газовую фазу также переходят образующиеся в процессе окисления сульфидов диоксид серы SO2, а также оксид мышьяка (III) As2O3.
Операцию обжига селена проводят в печах с обеспечением периодического или непрерывного процесса. На рисунке 2.4 представлена схема установки "Outokumpu" по обжигу шлама, находящемся в печи на противнях, в стационарном режиме с дальнейшим переводом селена в газовую фазу, восстановлением и итоговом получении продукта на фильтр-прессе. В печь загружается обычно от 1, 5 до 3 тонн шлама с влажностью 15-20 %. Обжиг такой партии шлама производится при температуре 600-650 °С в течение 20-24 часов.
На большинстве производств при обжиге шламов диоксид селена улавливают кислыми растворами с получением селенистой кислоты. Восстановление селена из растворов в этом случае производят газообразным диоксидом серы (в том числе присутствующим в газах обжига) или сульфитом (бисульфитом) натрия с получением технического селена:
H2SeO3+SO2=Se↓+H2SO4
(2.11)
Этот способ выделения селена основан на различии в величинах окислительно-восстановительных потенциалов системы, а именно:
φ° SeO32-/Sе0 = + 0, 741В
φ° SO32-/SO42- = + 0, 17В
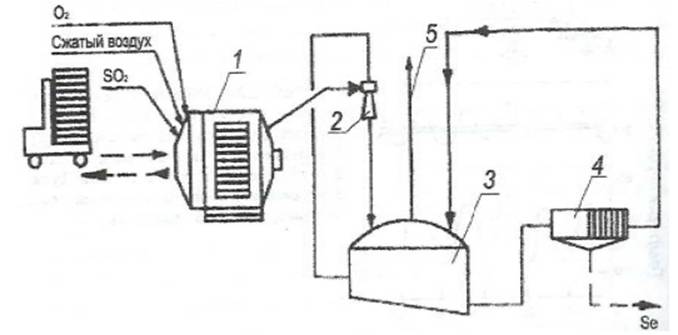
1 - печь обжига селена; 2 - эжектор; 3 - циркуляционная емкость; 4 - фильтр-пресс; 5 - очищенный от диоксида селена газ
Рисунок 2.4 Установка "Outokumpu" по извлечению селена из шламов
Горным институтом (Санкт-Петербург) и институтом "Гинцветмет" была разработана и на ряде производств применяется технология извлечения селена из шламов, согласно которой обезмеженный шлам смешивают с добавками, гранулируют и обжигают при температуре 700 °С - 800 °С в печах шахтного типа с пропусканием через слой гранул горячего воздуха (рисунок 2.5). Производительность печи - 3 тонны шлама в сутки.
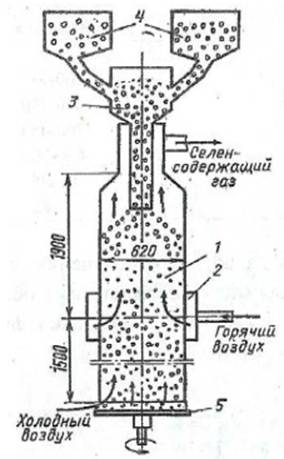
1 - шахта печи; 2 - фурменный пояс; 3 - загрузочная воронка; 4 - емкость (кюбель) с гранулированным шламом; 5 - тарельчатый питатель для разгрузки огарка
Рисунок 2.5 Шахтная печь окислительного обжига шлама непрерывного действия
Во время обжига селен из селенидов металлов окисляется и возгоняется в виде диоксида SeO2, который поглощается оборотным щелочным раствором с образованием селенита натрия Na2SeO3. Полученный селенитный раствор восстанавливают алюминиевым порошком до полиселенида натрия Na2Sen. По окончании восстановления и фильтрации селенидный раствор поступает на очистку от примесей и последующую аэрацию для осаждения селена. При этом регенерируется гидроксид натрия:
Na2Se+½O2+H2O=Se↓+2NaOH
(2.12)
Данный процесс отличается замкнутым циклом по растворам. Его технологическая схема приведена на рисунке 2.6.
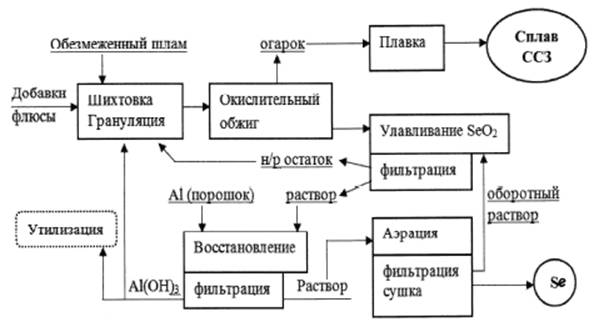
Рисунок 2.6
Технический селен, выпускаемый по отмеченным методам содержит от 93 до 96 % основного вещества. Его подсушивают, производят рассев и поставляют потребителям по ГОСТ 10298-79 в виде порошка или слитков после переплавки.
Огарок после обжига шламов плавят на получение сплава серебряно-золотого (ССЗ - сплава Доре). Теллур при этом извлекается в специально наводимые содистые шлаки в виде теллурита натрия Na2TeO3. Содержание теллура в шлаках доходит до 40-45 %. Содистый шлак подвергается водному выщелачиванию; полученный раствор очищается от сопутствующих компонентов введением реагентов: сульфида натрия и оксида кальция. Очищенный раствор подвергается электроэкстракции с получением чернового теллура чистотой 95-97 %. Катодный черновой теллур содержит 2-5 % примесей. Последующая теллуридная перечистка заключается в следующем: порошкообразный металл растворяют в щелочи в присутствии восстановителя - алюминиевого порошка, получая раствор теллурида:
3Te+6NaOH+2Al=3Na2Te+2Al(OH)3↓
(2.13)
Из полученного раствора при аэрации осаждают теллур технических марок:
Na2Te+½O2+H2O=Te↓+2NaOH
(2.14)
Схема этого процесса приведена на рисунке 2.5.
Получаемые по приведенным схемам технические селен и теллур не отличаются высокой чистотой. Они содержат от 2-3 до 6-7 % примесей, сопутствующих этим элементам как в рудном сырье, так и приобретенные при его переработке (мышьяк, медь, свинец, сурьма, алюминий, теллур в селене, селен в теллуре и др.).
По ГОСТ 10298-79 в странах СНГ выпускают селен двух марок: СТ-0 (99, 8 %), СТ1 (99, 0 %). Для очистки от примесей селена в настоящее время применяют плавку с аммиачной селитрой и дистилляцию. Плавка с селитрой предусматривает окисление примесей и перевод их в шлак. Так, теллур удаляют в шлак по реакции:
Те + 2NH4NO3 = ТеO2 + 2N2 + 4Н2O
(2.15)
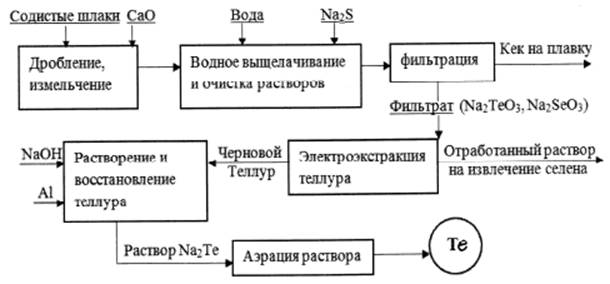
Рисунок 2.7
Процесс проводят в котлах - аппаратах из нержавеющей стали с наружным обогревом при температуре 250-280 °С (селен плавится при температуре 217 °С). Разложение селитры и окисление примесей начинается при температуре 190 °С. Рафинированный селен разливают в изложницы из нержавеющей стали. По этому способу получают селен чистотой до 99, 4 %.
Вакуумная дистилляция основана на разной летучести селена и металлов примесей, основная масса которых остается в нелетучем остатке.
Дистилляцию селена проводят при температуре 650 - 680 °С и атмосферном давлении или при температуре 310 °С - 420 °С и разряжении 27-800 Па. Пары селена конденсируют при температуре 250 °С - 100 °С. Дистилляцию осуществляют в ретортах или емкостях, изготовленных из коррозионной стали. Жидкий селен после дистилляции разливают на слитки или гранулы. Слитки селена медленно охлаждают для получения селена "серой" полиморфной модификации. После двукратной дистилляции селен достигает чистоты 99, 99 %.
По ГОСТ 17614-80 в странах СНГ выпускают теллур трех марок: Т0 (99, 93 %), Т1 (99, 3 %), Т2 (96, 5 %).
Для получения теллура чистотой до 99, 999 % также применяют вакуумную дистилляцию. Эту операцию проводят при остаточном давлении ~ 1 Па в аппаратах с электронагревом и использованием диффузионных насосов для создания глубокого вакуума. При дистилляции примеси с меньшей, чем у теллура упругостью паров, остаются в кубовом остатке, а примеси селена, натрия, калия, магния, упругость паров которых выше или равна упругости паров теллура, переходят в дистиллят и конденсируются в разных температурных зонах. В качестве варианта для предварительной переплавки и очистки теллур подвергают фильтрации расплава. При этой операции оксиды части металлов, образующих определенные конгломераты в расплаве теллура, отфильтровываются на огнеупорной фильтрующей перегородке с размером отверстий 0, 1-0, 15 мм.
Способ дистилляции с предварительными операциями дополнительной очистки обеспечивает получение теллура чистотой 99, 99 - 99, 999 % и выше.
Селен и его соединения применяется в электронике (фотоэлементы, полупроводниковые материалы, термосплавы), в химической, стекольной промышленности (включая пигменты), при изготовлении керамики, лекарственных средств, в качестве кормовых добавок.
Теллур технический используется в производстве прецизионных сплавов, в стекольной и химической промышленности, особочистый теллур применяется в электронной промышленности для изготовления полупроводников, термосплавов, лазеров, солнечных батарей.
2.12 Ванадий
Технология получения ванадия
Несмотря на относительно высокое содержание ванадия в земной коре, превышающее содержание в ней цинка, меди и свинца, он практически не образует самостоятельных месторождений и рассеян в разных минералах и горных породах.
Основной источник получения ванадия - ванадийсодержащие железные руды. При доменной плавке железных руд 80 % - 90 % ванадия переходит в чугун. При последующем переделе ванадийсодержащего чугуна на сталь получаются шлаки, обогащенные ванадием. Из шлаков ванадий извлекают химическими методами в виде соединений, которые являются исходным продуктом для выплавки феррованадия.
Ванадий также получают из различных ванадийсодержащих руд и концентратов.
При извлечении ванадия из патронитовых руд их подвергают окислительному обжигу с получением богатого огарка, направляемого на алюмотермическое восстановление в электропечах с получением феррованадия, или концентрата. Последний обжигают и ванадий выщелачивают гидроксидом натрия или калия, а также кислотами с последующим осаждением из раствора пентаоксида ванадия.
Из богатых роскоэлитовых руд ванадий выщелачивают также гидроксидом натрия или калия, кислотами. Затем из растворов осаждают пентаоксид ванадия.
По обеим технологиям извлечение ванадия в феррованадат составляет 95 %.
Перспективный способ получения ванадия - восстановление его оксидов углеродом в вакууме при температуре 1250 °С - 1700 °С.
Эффективный способ рафинирования ванадия - вакуумная электронно-лучевая зонная плавка. Очистка металла в этом случае происходит за счет зонного рафинирования и испарения примесей.
2.13 Ниобий и тантал
Технология получения ниобия и тантала
Ниобий и тантал входят в состав около 100 минералов, представляющих сложные комплексные соли Nb-Ti-Nb-Ta-кислоты. В состав этих минералов входят также катионы железа, марганца, щелочных и щелочно-земельных металлов, редкоземельных элементов, торий, уран и др. Среди известных минералов ниобия и тантала только три имеют промышленное значение. К ним относятся танталит-колумбит, пирохлор и лопарит.
Переработка ниобий- и танталсодержащих концентратов и промпродуктов обогащения включает растворение (вскрытие) их с получением продукта, концентрирующего оба элемента.
Технологии переработки танталсодержащего сырья до получения компактного металла и ниобийсодержащего сырья аналогичны, кроме способов получения порошкообразного металлического тантала из его соединений, которые имеют некоторые особенности.
Основной минерал ниобий-колумбий - химически прочный, неразлагаемый минеральными кислотами за исключением фтористоводородной кислоты. Поэтому для вскрытия колумбитовых концентратов применяют сплавление с гидроксидом натрия (калия) или разложение фтористоводородной кислотой.
Гидратированные пентаоксиды ниобия и тантала являются источником получения металлических тантала и ниобия, а также их солей.
Для переработки лопаритовых концентратов применяют два способа: хлорирование и сернокислотное выщелачивание.
При хлорировании компоненты лопаритового концентрата взаимодействуют с газообразным хлором при температуре 750 °С - 800 °С в присутствии угля. Разделение ценных компонентов в этом процессе обусловлено разной летучестью образующихся хлоридов.
Сернокислотный способ разложения лопаритового концентрата основан на различии в растворимости получаемых двойных сульфатов титана, ниобия, тантала и РЗЭ.
Переработка пирохлоровых концентратов осуществляется выщелачиванием (фтористоводородной, соляной или серной кислотами) или хлорированием.
Порошкообразный ниобий получали при переработке пирохлоровых концентратов и методом хлорирования из лопаритового концентрата; техническую пятиокись ниобия - гидролизом технических хлоридов.
Для выделения ниобия и тантала технический гидроксид ниобия подвергали дробной кристаллизации фтористых солей, что позволяло получить чистые соединения ниобия и тантала.
Гидратированные пентаоксиды ниобия и тантала являются источником получения металлических тантала и ниобия, а также их солей.
Для выделения ниобия и тантала технический гидроксид ниобия подвергали дробной кристаллизации фтористых солей, что позволяло получить чистые соединения ниобия и тантала.
В настоящее время для разделения тантала и ниобия применяют жидкостную экстракцию органическими растворителями, а также ректификацию хлоридов.
Разделение тантала и ниобия ректификацией хлоридов используют при переработке рудных концентратов (например, лопаритовых) методом хлорирования с получением смеси пентахлоридов металлов.
Технологическая схема разделения смеси пентахлоридов включает предварительную ректификацию для отделения хлоридов тантала и ниобия от сопутствующих примесей титана, кремния, алюминия и др.; основную ректификацию для получения чистого пентахлорида ниобия и концентрата пентахлорида тантала; ректификацию танталовой фракции (получение чистого пентахлорида тантала).
Метод ректификации отличается высокой производительностью и эффективностью разделения металлов. Полученные чистые пентахлориды ниобия и тантала используют для получения тантала и ниобия.
Металлические тантал и ниобий получают восстановлением из ряда их соединений высокой чистоты - оксидов, комплексных фторидов и хлоридов.
В промышленной практике для восстановления этих двух металлов используют различные методы.
В связи с высокими температурами плавления ниобий и тантал получают, в основном, в порошкообразном состоянии или в виде спекшейся губки.
Натрийтермическое восстановление из комплексных фторидов K2TaF7 и K2NbF7 - старейший способ получения порошков тантала и ниобия. Его применяют до настоящего времени.
Карботермический способ получения ниобия и тантала из их пентаоксидов был вначале разработан для производства ниобия. В настоящее время его используют также при получении тантала и его сплавов с ниобием.
Алюмотермическое получение ниобия и тантала из высших оксидов отличается высокими технико-экономическими показателями, простотой технологии и аппаратурного оформления.
Восстановление тантала и ниобия из хлоридов водородом наиболее перспективно по сравнению с восстановлением магнием или натрием. Водородное восстановление предусматривает получение прутков компактных металлов на нагретых подложках.
Этим способом можно получать также прутки ниобия.
Электролитическое получение тантала возможно только из расплавленных сред. Электролитом служит расплав K2TaF7 и KF - KCl, в котором растворен пентаоксид тантала (Ta2O5).
Длительное время единственным способом получения компактных заготовок ниобия и тантала была порошковая металлургия, сохранившая практическое значение до наших дней. Мелкозернистые порошки тантала прессуют под давлением 300-500 МПа, а ниобия - 100-150 МПа.
Танталовые и ниобиевые заготовки (штабики) спекают в сварочных аппаратах, применяемых при производстве вольфрама и молибдена, отличающихся наличием вакуумного герметичного колпака. Крупные заготовки и изделия сложной формы из ниобия и тантала спекают при их косвенном нагреве в вакуумных индукционных печах.
Для производства тантала и ниобия особой чистоты представляет интерес бестигельная зонная плавка с электронно-лучевым обогревом.
Для выбора способа переработки вовлекаемого в производство сырья необходимо учитывать качество исходного материала, наличие примесей, лимитирующих выбор конечной продукции, а также имеющиеся производственные мощности.
2.14 Цирконий
Технология получения циркония
Обогащение циркониевых руд
Промышленное получение циркония осуществляется из руд, содержащих два основных минерала: циркон ZrSiO4 и бадделеит ZrO2.
Измельченная руда подвергается магнитной сепарации в слабом поле для получения магнетитового концентрата. Хвосты магнитного обогащения обесшламливаются в гидроциклонах, зернистая фракция + 44 мкм подвергается апатитовой флотации с получением апатитового концентрата. Хвосты флотации разделяются на концентрационных столах. Тяжелая фракция, содержащая бадделеит, подвергается обжигу при температуре 400 °C и затем электромагнитной сепарации. Немагнитная фракция подвергается обжигу при температуре 900 °C последующей магнитной сепарацией в слабом поле. Немагнитная фракция представляет собой бадделеитовый концентрат - более 96 % ZrO2. Аналогичная схема используется при переработке руд Ковдорского месторождения (Россия).
Разработанные гравитационно-магнитоэлектростатические схемы обогащения могут использоваться для переработки погребенных прибрежно-морских россыпей России (отдельные участки Туганского, Лукояновского и других месторождений). Обогащение комплексных редкометальных месторождений (Улуч-Танзел) затруднено сложностью минерального состава сырья, наличием радиоактивных примесей.
В производстве циркония принято несколько технологий переработки цирконовых концентратов. Гидрометаллургические способы предусматривают вскрытие цирконовых концентратов предварительным спеканием. По одной технологической схеме спекание осуществляется со щелочами и карбонатами щелочных и щелочно-земельных металлов. После выщелачивания, перевода циркония в раствор и выделения из раствора получаются гидратированные соли циркония и после прокалки - технический диоксид циркония. Технический диоксид циркония может являться товарным продуктом для лакокрасочной и керамической промышленности.
По другой технологии спекание происходит с комплексными фторидами щелочных металлов. После выщелачивания и перевода циркония в раствор при охлаждении кристаллизуют фторцирконат калия. Способ получения фторцирконата калия наиболее целесообразен для последующей технологии очистки от гафния.
Бадделеитовые концентраты перерабатывают по гидрометаллургической схеме вскрытием концентрированной серной кислотой с получением фторцирконатов.
Из растворов K2(Zr, Hf)F6 получают цирконий экстракционным разделением при помощи трибутилфосфата. Циркониевые продукты получаются с содержанием гафния до 0, 01 %. Экстракционный метод пригоден для непрерывных процессов, которые легко контролировать и автоматизировать; позволяет получить довольно чистые продукты; имеет высокую производительность. Этот метод наиболее широко распространен в промышленности.
Кроме того, технология получения фторцирконатов удобна, так как из фторцирконата калия путем его восстановления натрием получают порошки технического циркония.
Порошок немного большей крупности может быть получен кальцийтермическим методом восстановления диоксида циркония.
Переработка циркона с получением фторцирконата калия удобна при использовании ряда технологий получения металлического циркония и соединений циркония и, самое главное, для очистки циркония и его соединений, от гафния.
Основным способом, принятым в промышленности для переработки циркониевых концентратов в настоящее время является хлорирование для получения цирконовой губки. Хлорирование осуществляют в шахтных электропечах, Процесс хлорирования непрерывный.
Более перспективен процесс хлорирования карбида и карбонитрида циркония. Полученный в результате хлорирования тетрахлорид циркония является товарным продуктом и исходным компонентом для получения товарного - диоксида циркония и металлического циркония.
Очищенный возгонкой тетрахлорид циркония является исходным материалом для получения губчатого циркония. Измельченная губка является материалом для получения компактного металла методом вакуумной дуговой или аргонно-дуговой плавки. Наиболее распространен метод вакуумной дуговой плавки, позволяющей получать компактные слитки до 2 т.
За рубежом практикуется технология восстановления тетрафторида циркония щелочными металлами с получением металлического циркония.
В небольших количествах образцы особо чистого циркония получаются иодидным методом.
Практикуемый в настоящее время в промышленности процесс металлотермического восстановления тетрахлорида циркония периодический. Разработан новый непрерывный процесс получения металлического циркония из его тетрахлорида - процесс аэрозольного восстановления. В качестве восстановителя используется магний или натрий.
2.15 Титан
2.15.1 Свойства титана и его применение
Наибольшую опасность при получении титана представляет пыль диоксида титана и его концентратов, брикетированного пека, образующегося при измельчении, смешивании и погрузке сыпучего сырья, при использовании негерметичного оборудования, а также тепловое излучение от коксовых печей.
Предельно допустимые концентрации диоксида титана по стандартам США в зависимости от регламентируемого показателя составляют 5-20 мг/м3.
В воздухе рабочих помещений цехов, где проводят хлорирование диоксида титана и очистку тетрахлорида титана, могут находиться хлор, пары тетрахлорида титана и продукты пиролиза. В процессе восстановления тетрахлорида титана вероятно загрязнение окружающего воздуха оксидом магния. Пыль металлического титана появляется в воздухе при выбивке, измельчении, отделении и упаковке губчатого титана. Вблизи дуговых печей нередко имеет место воздействие теплового и ИК-излучения с объемной плотностью теплового потока, равной 2.1-3, 5 кВт/(мс).
Исходным сырьем для производства металлического титана являются рутиловые концентраты, содержащие не менее 92 % - 94 % ТiO2; ильменитовые концентраты с содержанием 52 % - 65 % ТiO2, получаемые из россыпей, и 42 % - 47 % ТiO2 - из руд коренных месторождений, а также титановые шлаки.
В настоящее время подавляющую часть металлического титана получают восстановлением его тетрахлорида магнием или натрием. В небольших количествах титан получают прямым восстановлением из диоксида кальцием или гидридом кальция.
Наиболее распространенная принципиальная схема получения титана из ильменитовых концентратов состоит в следующем. Вначале проводят пирометаллургическую подготовку исходного сырья восстановительной плавкой на титановый шлак с целью избирательного восстановления оксидов железа до чугуна и максимального перевода титана в шлак. Восстановительную плавку ильменитовых концентратов проводят в высокотемпературных электрических печах закрытого типа, используемых обычно при производстве ферросплавов (рисунок 2.8).
Основной процесс плавки описывается в общем виде уравнением:
FeTiO3 + С = Fe + ТiO2 + СО
(2.16)
Плавку ильменитовых концентратов ведут с минимальным расходом флюсов или совсем без них, чтобы не уменьшить содержание диоксида титана в шлаках ниже 82 % - 87 %. Это ведет к образованию очень тугоплавких и вязких шлаков с температурой плавления выше 1500 °С, что требует применения высокотемпературных печей. В качестве восстановителя при плавке используют кокс или антрацит. Шлак и чугун периодически сливают через летку в общую изложницу. После расслаивания и затвердения чугун и шлак механически разделяют и направляют на самостоятельную переработку. Извлечение титана в шлак составляет 96 % - 96, 5 %.
В небольших количествах для нужд черной металлургии из ильменитовых концентратов алюмотермическим способом получают ферротитан состава, %: 25-30 Ti, 5-8 Al, 3-4 Si, остальное - Fe.
Дальнейшая технология получения металлического титана слагается из трех стадий. Вначале хлорированием исходных материалов газообразным хлором получают технический тетрахлорид титана по реакции:
ТiO2 + 2Сl2 + 2С = TiCl4 + 2СО
(2.17)
Затем после очистки тетрахлорида от примесей его подвергают магнийтермическому восстановлению до металлического титана:
TiCl4(г) + 2Mg(ж) = Ti(тв) + 2MgCl2(ж) + 519 кДж
(2.18)
Поскольку титан восстанавливают магнием при температуре 750 °С - 850 °С, что значительно ниже температуры его плавления, металл получается в виде спеченных кристаллов - губки (готовой продукции титаномагниевых комбинатов). Перерабатывают титановую губку в компактные слитки на металлообрабатывающих предприятиях.
Весьма перспективен для переработки титановых отходов - брака губки и вторичного титанового сырья - электролитический способ, в котором анодом служат мелкие материалы из металлического титана, помещенные в стальную корзину. Катодный осадок в виде удлиненных (~ 20 мм) кристаллов осаждается на стальных катодных основах, после чего его срезают, дробят в щековых дробилках и измельчают в стержневых мельницах с титановыми стержнями. Катодный осадок имеет чистоту стандартной титановой губки. Процесс электролиза ведут в электролите расплава хлоридов калия и натрия с растворенными в нем низшими хлоридами титана в герметичных электролизерах в среде аргона. Идея метода уже используется в промышленной практике электролитического рафинирования титана.
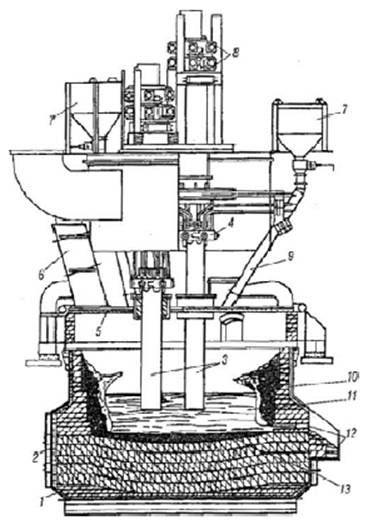
1 - кожух; 2 - магнезитовая футеровка; 3 - электроды; 4 - токоподвод к электродам; 5 - водоохлаждаемый свод; 6 - газоход; 7 - шихтовые бункера; 8 - система перепуска электродов; 9 - шихтовые течки; 10 - гарнисаж; 11 - шлак; 12 - летка; 13 - чугун
Рисунок 2.8 - Электродуговая печь закрытого типа
Получение чистого тетрахлорида титана (TiCl4) включает производство технического тетрахлорида и его очистку от примесей.
Тетрахлорид титана
Бесцветную жидкость с tкип 136 °С получают воздействием газообразного хлора на диоксид титана при температуре 700 °С - 900 °С в присутствии углерода (см. реакцию (2.13)). Кроме оксида титана хлор частично воздействует на кислородные соединения других элементов, что приводит к образованию летучих хлоридов железа, кремния, ванадия и др.
Хлорирование титансодержащих материалов проводят с использованием брикетированных шихт в солевом расплаве и в кипящем слое. Хлорирование брикетированных шихт требует проведения громоздких подготовительных операций: измельчения компонентов шихты, их смешения, брикетирования и прокаливания брикетов. Для хлорирования брикетируемых шихт можно использовать шахтные электрические печи, шахтные хлораторы непрерывного действия с движущимся сверху вниз слоем брикетов. Хлорирование брикетированных шихт проводят анодными газами магниевых электролизеров, содержащих 65 % - 70 % Сl. Основные недостатки этого способа - большие затраты на брикетирование и длительность этой операции.
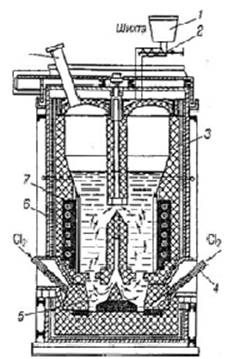
1 - шихтоприемник; 2 - транспортер-дозатор; 3 - шамотная футеровка; 4 - фурма 5 - летка; 6 - корпус; 7 - графитовые нагреватели; 8 - газоход
Рисунок 2.9 - Хлоратор для хлорирования в солевом расплаве
Способ хлорирования в солевом расплаве, разработанный в бывшем СССР, является наиболее совершенным. Процесс проводят в хлоридном расплаве, представляющем собой отработанный электролит магниевых электролизеров и содержащий в основном хлориды калия, натрия, кальция и магния. Шихту измельченного титанового шлака и кокса загружают на поверхность расплава из бункера со шнековым питателем. Хлор или анодный газ подают в расплав через фурмы снизу. Устройство хлоратора и принцип его действия приведены на рисунке 2.9. При оптимальном режиме хлораторы с площадью свободного сечения 5 м2 и высотой расплава 3, 5-4 м обеспечивают получение тетрахлорида титана 100 т/сут.
Основные преимущества хлорирования в солевом расплаве по сравнению с брикетированием шихт:
- исключаются сложные операции подготовки брикетов;
- обеспечивается лучший тепло- и массообмены;
- выше средняя производительность;
- меньший общий объем газов и выше концентрация в них тетрахлорида титана.
Основной недостаток этого способа хлорирования - необходимость периодического вывода отработанного расплава, что ведет к потерям с ним части диоксида титана. Хлорирование в солевом растворе проводят при температуре 800 °С - 850 °С. Необходимая температура поддерживается за счет теплоты экзотермических реакций хлорирования и отвода избыточной теплоты с помощью кессонов. Тетрахлорид титана и другие летучие хлориды из хлоратора поступают в конденсатор, а нелетучие накапливаются в расплаве.
Хлорирование в кипящем слое, несмотря на многие кажущиеся преимущества метода, до сих пор не нашло широкого применения, что связано с трудностями подбора и подготовки оптимальной крупности рудного материала и кокса, обеспечивающей совместную подачу всех компонентов загрузки и незначительный их пылевынос. Получающаяся в хлораторах любого типа парогазовая смесь имеет очень сложный состав. Она содержит хлориды разной летучести и механически увлеченные твердые частицы. Ее обязательно направляют на конденсацию паров тетрахлорида титана и очистку от примесей.
Полученный после конденсации технический тетрахлорид титана содержит, %: 97-99 TiCl4, 1, 5-2, 5 SiCl4, 0, 02-0, 003 FeCl и до 0, 12 VOCl3 и VCl4. Извлечение титана в этот продукт составляет 92 % - 93 %. Очистку тетрахлорида проводят, главным образом, методом ректификации, основанным на разной летучести присутствующих в тетрахлориде титана примесей, т.е. на различии температур их кипения, °С: TiCl - 136, FeCl3 - 319, VCl4 - 164, SiCl4 - 57. Некоторые примеси, например, VOCl3, ректификацией удалить трудно. Их предварительно восстанавливают до менее летучего хлорида VCl4 пропусканием паров через нагретый медный или алюминиевый порошок. Ректификацию титана проводят в ректификационных колоннах из нержавеющей стали с дырчатыми тарелками.
При ректификации тетрахлоридов титана и кремния, из которых последний более летуч, исходная жидкость подается на нижнюю тарелку верхней необогреваемой части колонны. При заполнении этой тарелки жидкость переливается на следующие, расположенные ниже. Тетрахлорид кремния при этом начинает испаряться. Чем ниже опускается расплав, тем выше его температура, так как по мере удаления тетрахлорида кремния температура кипения жидкости повышается. Одновременно с тетрахлоридом кремния в небольших количествах испаряется и тетрахлорид титана. Пары тетрахлоридов, перешедшие в паровую фазу, поднимаются навстречу стекающей жидкости и частично конденсируются на тарелках необогреваемой части колонны. Получаемый при этом конденсат (флегма), переполняя тарелки, вновь сливается вниз. Тарелки верхней части колонны разогреваются только за счет теплоты, выделяющейся при конденсации и поддерживающей жидкость в состоянии кипения. Так как по мере движения паров вверх содержание тетрахлорида кремния в них возрастает, расположенная на верхних тарелках жидкость также обогащается этим компонентом, и температура верхних тарелок понижается. Ректификацию технического тетрахлорида титана проводят в две стадии в двух последовательно расположенных колоннах. Сначала при температуре 60 °С - 130 °С возгоняют наиболее низкокипящие компоненты - тетрахлорид кремния и другие летучие примеси. Полученный в первой колонне кубовый остаток, содержащий тетрахлорид титана с примесью высококипящих хлоридов, направляют во вторую колонну с рабочей температурой 136 °С. На этой стадии преимущественно возгоняется чистый тетрахлорид титана, а все высококипящие примеси остаются в кубовом остатке второй стадии ректификации. Концентрации примесей в очищенном тетрахлориде титана составляют от 3 % до 10 %, т.е. в пределах чувствительности спектрального анализа.
Титан из тетрахлорида восстанавливают металлотермическим методом с помощью магния или натрия. Первоначально в титановом производстве применяли только магний. В настоящее время многие титановые заводы используют натрийтермический процесс, который имеет ряд преимуществ. В зависимости от способа восстановления титан получают в виде губки или порошка.
Магнийтермическое восстановление титана проводят в стальных аппаратах в аргоне или гелии. Аппарат состоит из стальной реторты с крышкой, снабженной патрубками для загрузки твердого или жидкого магния и подачи тетрахлорида титана (см. рисунок 2.9).
Титан магнийтермическим способом получают в периодическом режиме. Сначала в печь (обычно с электрическим обогревом) устанавливают реторту. После откачки из реторты воздуха и заполнения ее аргоном при температуре ~ 700 °С заливают расплавленный магний и начинают подачу жидкого тетрахлорида. Нагреватель затем отключают и поддерживают температуру в пределах 800 °С - 900 °С за счет теплоты экзотермической реакции (см. реакцию (2.14)) регулированием скорости поступления тетрахлорида титана и обдувом реторты снаружи воздухом.
Жидкий хлорид магния периодически выпускают через патрубок в днище реторты и направляют в магниевое производство для регенерации магния и хлора. Это обусловлено расслоением материалов в реторте на жидкий магний, хлорид магния и губчатый титан. Фактически же большая часть жидких фаз впитывается губчатым титаном, что замедляет реакцию его образования. Именно с целью обнажения поверхности губки и ускорения процесса и выпускают хлорид магния. В течение всего технологического процесса сливают до 85 % образующегося хлорида магния. На заводах для магнийтермического получения магния используют реторты диаметром до 2 м при высоте 3 м. За один цикл получают до 3 т титановой губки.
Титановая губка представляет пористую массу спекшегося титана, пропитанную остатками хлорида магния и избыточного металлического магния. Этот продукт, называемый реакционной массой, содержит, %: 55-65 Ti, 25-35 MgCl2 и 9-12 Mg. Для их разделения в настоящее время повсеместно применяют вакуумную дистилляцию, которая основана на относительно высокой летучести магния и его хлорида при температуре 850 °С - 950 °С по сравнению с титаном. Возможны два варианта этого процесса. По первому варианту реакционную массу извлекают из реторты с помощью пневматического зубила высверливанием или выфрезовыванием и подвергают дистилляции в отдельном аппарате. По второму варианту дистилляцию проводят без выгрузки массы.
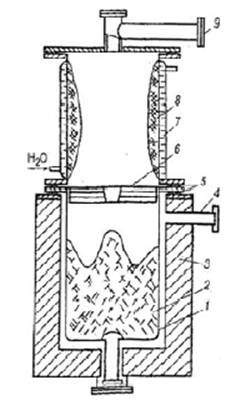
1 - реторта; 2 - Ti - губка; 3 - электропечь; 4 - патрубок вакуумирования; 5 - уплотнения; 6 - экран; 7 - конденсатор
Рисунок 2.10 - Аппарат для вакуумной дистилляции титановой губки
В этом случае к реторте вместо крышки присоединяют водоохлаждаемый конденсатор и всю сборку помещают в печь (см. рисунок 2.10).
Дистилляцию проводят при температуре 950 °С - 1000 °С и вакууме 0, 01 Па в реторте. Во избежание вдавливания разогретых стенок реторты печь тоже вакуумируется (контрвакуум).
При нагреве в вакууме из реакционной массы возгоняют магний и его хлорид, пары которых образуют на стенках конденсатора кристаллическую друзу, которую также отправляют в магниевое производство. Процесс вакуумной очистки губчатого титана в аппарате вместимостью 2 т губки продолжается 50-60 ч. По окончании процесса реторту извлекают из печи и транспортируют в отдельное помещение, где ее демонтируют, а губку извлекают пневматическими зубилами или выдавливают на прессе.
По техническим условиям титановая губка марки ТГ-100 должна содержать, %: ≤ 0, 08 Сl; 0, 07 Fe; 0, 02 Н; 0, 03 С; 0, 04 Si; 0, 04 О. При этом для переплавленного образца устанавливается также предельно допустимая твердость по Бринеллю.
Магнийтермический способ получения титана экономически и технологически целесообразен только при комбинированной технологии производства магния и титана, которая обеспечивает наиболее рациональную регенерацию основных реагентов (магния и хлора) и конденсат из магния и его хлорида; переработку отходов.
Натрийтермическое восстановление титана по сравнению с магнийтермическим имеет следующие преимущества:
- легкость транспортировки натрия по трубам и точность дозировки его при подаче в реактор вследствие низкой температуры плавления (97, 8 °С);
- простота отделения продукта реакции - хлорида натрия - от металлического титана выщелачиванием водой;
- высокие скорости восстановления тетрахлорида титана при 100 %-ном использовании восстановителя;
- титан получается в виде порошка, что упрощает его дозировку при дальнейшем использовании.
Натрийтермическое восстановление проводят в одну или две стадии. При одностадийном процессе в реактор одновременно из мерных бачков подают тетрахлорид титана и жидкий натрий. Регулируя процесс по температуре и времени, добиваются практически полного восстановления всех хлоридов титана с получением его порошков при крупности зерен от 2, 4 до 0, 07 мм (фракция 2, 4-0, 2 мм). При двухстадийном процессе в первом реакторе при одновременной подаче реагентов получают расплав, а на второй стадии при подаче натрия на его поверхность - крупнокристаллические дендриты титана высокой чистоты размером 50 мм и более. Низкая производительность двухстадийной технологии ограничивает ее применение в крупном масштабе.
В небольших количествах титан получают прямым восстановлением (его диоксида) кальцием или гидридом кальция.
Кальцийтермическое восстановление протекает по следующей экзотермической реакции:
ТiO2 + 2Са- > Ti + 2СаО + 392 кДж
(2.19)
Выделяющейся по этой реакции теплоты недостаточно для автогенного протекания процесса, необходим внешний подогрев. Восстановление в этом случае ведут в герметичных ретортах из жаростойкой стали в аргоне при температуре 1000-1100 °С, когда кальций находится в жидком и частично парообразном состояниях. Для восстановления диоксида титана применяют очищенный дистилляцией кальций, чтобы избежать загрязнения титана азотом и углеродом. В результате восстановления диоксида титана кальцием получают мелкодисперсный порошок титана крупностью 2-3 мкм. Добавки хлорида кальция способствуют укрупнению зерен титана. Шихту для кальцийтермического получения титана перед загрузкой в реторты брикетируют. Она состоит из смеси диоксида титана, кальция и его хлорида. Титан после кальцийтермического восстановления диоксида титана содержит 98, 5-99, 9 % Ti.
Восстановление диоксида титана гидридом кальция является разновидностью кальцийтермического процесса. Он протекает по реакции:
TiO2+2CaH2 -> TiH2+2CaO+H2,
(2.20)
т.е. в этом процессе получается не металлический титан, а гидрид титана.
Это является определенным преимуществом технологии, так как порошок гидрида титана в меньшей степени окисляется при отмывке оксида кальция, чем титановый порошок. Порошок гидрида титана используется, в основном, в порошковой металлургии.
Рафинирование титана. Титан высокой чистоты с суммарным содержанием примесей не более 0, 1 % - 0, 05 % обычно получают йодидным способом.
В промышленных условиях йодидную очистку титана ведут в специальных аппаратах из хромоникелевого сплава, стойкого к действию йода и йодида титана. Загрязненный титан в виде губки размещается в нем в кольцевом зазоре между реактором и молибденовой сеткой. Титановая нить диаметром 3-4 мм с помощью растяжек из молибденовых крючков в форме V-образных петель закреплена на изоляторах. Общая длина нити накала - 11 м. Йод помещают в стеклянной ампуле.
Вначале подготовленный к работе реактор вакуумируют и после создания вакуума в него впускают йод, разбивая вмещающую его ампулу. Образующиеся при этом пары йода и йодида титана занимают весь объем рабочей камеры. Когда через нить начинают пропускать электрический ток, нить раскаляется и на ней начинается термическое разложение йодида. Практически в реактор вводят всего 7 % - 10 % йода от теоретически необходимого для йодирования всего загруженного в реактор губчатого титана. В одном аппарате за полный цикл получают до 24 кг рафинированного титана, или около 10 кг/сут. Йодидный титан очень дорог. Возможно также электролитическое рафинирование титана. Анодом при электролизе служит мелкий титан, погруженный в стальную корзину, и вместе с ней в электролит из хлорида натрия или смеси хлоридов натрия и калия. В процессе электролиза титан электрохимически переходит в электролит и затем осаждается на катоде в виде крупнокристаллического осадка. Электролиз титана ведут в аргоне при температуре 850 °С и силе тока на катоде 0, 5 + 1, 5 А/см2.
2.16 Вольфрам
Технологии получения вольфрама
Непосредственная первичная переработка вольфрамовых и молибденовых концентратов, за исключением случаев выплавки ферросплавов, проводится с целью получения из них соответствующих триоксидов, которые используются при производстве металлических вольфрама и молибдена и их карбидов.
Выбор метода переработки концентратов зависит, в первую очередь, от их вида и минералогического состава. Вольфраму и молибдену свойственны максимальная степень окисления +6 и ее устойчивость для большинства химических соединений при малой вероятности существования простых катионов. Более низкие степени окисления наблюдаются преимущественно в условиях стабилизации комплексообразования. Кроме того, при выборе метода учитываются масштабы производства, технические требования к чистоте и физическим качествам получаемых триоксидов и некоторые технико-экономические показатели процессов.
Вольфрам - светло-серый металл, по виду очень похожий на сталь. По тугоплавкости он уступает только углероду и является самым прочным металлом. Прочность он сохраняет и при высоких температурах. Вольфрам практически нелетуч. Вольфрам отличается высокой химической стойкостью при нормальных условиях. На воздухе при обычной температуре он не взаимодействует с соляной, серной, азотной и фтористоводородной кислотами, устойчив к действию гидроксидов щелочных металлов растворяется только в смеси азотной и фтористоводородной кислот.
С кислородом воздуха вольфрам начинает взаимодействовать при нагреве до температуры 400 °С - 500 °С с образованием триоксида вольфрама (WO3).
В промышленной практике используют различные технологические схемы переработки концентратов с содержанием 30 % - 50 % WO3 и промпродуктов - 10 % - 20 % WO3. Промпродукты, выведенные из цикла обогащения труднообогатимых руд, перерабатываются на искусственный шеелит гидрометаллургией. Комбинированные схемы обеспечивают высокое извлечение вольфрама из таких руд. Полученный триоксид вольфрама служит исходным материалом для производства вольфрама, карбида вольфрама или других продуктов.
Выбор схемы зависит от типа и состава концентратов, масштаба производства, требований к чистоте и физическим характеристикам триоксида вольфрама.
Главным в технологической схеме является способ разложения концентрата. Известные способы разделяются на группы по виду полученных в результате разложения растворов:
- для получения растворов вольфрамата натрия используют способы с применением соды, щелочей, нейтральных солей (NaF, NaNO3 и др.). Из растворов после очистки от примесей выделяют малорастворимые соединения вольфрама или извлекают вольфрам методом экстракции или ионного обмена (сорбции);
- для получения осадков технической вольфрамовой кислоты применяют способы разложения кислотами (НСl, HNO3). Полученную техническую вольфрамовую кислоту растворяют в аммиачной воде и выделяют из раствора паравольфрамат аммония или вольфрамовую кислоту;
- при хлорировании вольфрамового сырья хлором или его соединениями возгоняют летучие хлориды и оксохлориды вольфрама. Гидролитическим разложением конденсата хлоридов и оксохлоридов получают вольфрамовую кислоту.
Самый распространенный в промышленной практике и универсальный способ разложения вольфрамитовых и шеелитовых концентратов - спекание с содой. Процесс ведется при температуре 800 °C - 900 °C во вращающихся трубчатых печах. Шихта составляется с избытком соды на 10 % - 20 % для вольфрамитовых концентратов и с избытком 80 % - 100 % от стехиометрического для шеелитовых, а также кварцевого песка. Степень разложения при этом составляет более 99 %. Данная технология применялась на Скопинском ГМЗ.
Электротермический способ разложения шеелитовых концентратов - плавка шихты при 1400 °C - 1500 °С в электропечи - обеспечивает степень вскрытия 98 %, высокую производительность, меньший расход реагентов (соды и кремнезема), меньший объем пульпы. Однако требует высокого расхода электроэнергии 1100 кВт•ч на 1 т концентрата и ведет к потерям вольфрама со шлаком.
Автоклавно-содовый способ разложения широко используется на отечественных заводах, а также в США, Японии, Великобритании, Германии, Австрии. Преимущества автоклавно-содового способа разложения вольфрамового сырья перед спеканием состоят в исключении печного процесса, предшествующего выщелачиванию, и меньшем содержании примесей в вольфраматных растворах. Кроме того, способ применим к вскрытию не только стандартных концентратов, но и низкосортных промпродуктов и хвостов обогащения, содержащих 4 % - 5 % WO3.
При разложении шеелитовых концентратов степень извлечения вольфрама в раствор достигает 98, 6 % - 99, 5 %, содержание вольфрама в отвальных хвостах не превышает 1 %. Для вольфрамитовых концентратов показатели несколько ниже.
В отечественной практике автоклавно-содовая схема применяется на Нальчикском ГМЗ.
При переработке низкокачественного сырья за рубежом отдается предпочтение автоклавно-содовой схеме, а для высококачественных концентратов используется кислотное вскрытие, являющееся в этом случае более экономичным из-за короткого производственного цикла.
Переработка растворов вольфрамата натрия, содержащих 60-150 г/л WO3, с получением триоксида вольфрама требуемой чистоты, по традиционной технологии включает; очистку от примесей кремния, фтора, фосфора, мышьяка, железа, молибдена; осаждение искусственного шеелита, разложение его кислотами с получением осадка технической вольфрамовой кислоты; растворение вольфрамовой кислоты в аммиачной воде и выделение из растворов паравольфрамата аммония методом выпарки (термическим разложением получают триоксид вольфрама).
Существенное упрощение многостадийной схемы переработки растворов вольфрамата натрия достигается при извлечении вольфрама методом экстракции с последующей реэкстракцией растворами аммиака и выделением из аммиачных растворов паравольфрамата аммония. Экстракционная технология используется на предприятиях США и освоена в России. Для экстракции используются третичные амины и четвертичные аммониевые основания.
Применение ионообменных смол - конкурирующее с экстракцией направление совершенствования схемы переработки вольфраматных растворов. К преимуществам применения смол следует отнести отсутствие сбросных растворов, содержащих органические примеси, пожаробезопасность, нетоксичность смол.
Основной промышленный способ получения порошков вольфрама - восстановление триоксида металла водородом.
Высокотемпературное восстановление водородом проводят в горизонтальных многотрубных печах, имеющих несколько зон нагрева, температура в которых регулируется автоматически.
2.17 Молибден
Технологии получения молибдена
По механической прочности молибден уступает только вольфраму, но легче его поддается обработке давлением.
При переработке молибденовых концентратов первичная цель - получение триоксида. Основным и практически единственным промышленным способом первоначальной обработки молибденитовых концентратов является окислительный обжиг, в результате которого происходит окисление молибденита с образованием огарка, загрязненного примесями.
Для получения чистого оксида молибдена применяют либо метод возгонки триоксида молибдена, либо химическую переработку огарка.
Основной промышленный способ получения порошков вольфрама - восстановление триоксида металла водородом.
Высокотемпературное восстановление водородом проводят в горизонтальных многотрубных печах, имеющих несколько зон нагрева, температура в которых регулируется автоматически.
Основной, широко применяемый в промышленной практике способ разложения молибденитовых концентратов - окислительный обжиг. Продукт обжига - огарок, содержащий триоксид молибдена и примеси в заданных пределах, поступает на выплавку ферромолибдена или служит исходным материалом для производства химических соединений, наиболее чистое по примесям из которых - триоксид молибдена. Переработка огарка может проводиться способом возгонки, однако наиболее распространены гидрометаллургические схемы переработки огарка.
В заводской практике обжиг молебденитовых концентратов проводят в печах "кипящего слоя" (КС). Обжиг в КС позволяет получать огарки с высоким содержанием выщелачиваемого в растворах аммиака молибдена, поддерживать строго определенный интервал температур 560 °С - 580 °С, не допуская спекания материала и взаимного контакта материала, предотвращая образование молибдатов.
Организация обжига концентратов с целью получения огарков, кондиционных по сере и пригодных для выплавки ферромолибдена, требует создания установки двухступенчатого обжига. Вторая стадия обжига обеспечивает дожигание серы во вращающихся трубчатых печах до содержания менее 0, 2 %. Эта технология разработана институтом "Гинцветмет" и прошла опытно-промышленные испытания.
Получение чистого триоксида молибдена из огарков ведется гидрометаллургическим аммиачным способом. Огарок выщелачивают раствором аммиака, из аммиачного раствора после очистки от примесей выделяют молибден в форме парамолибдата или полимолибдатов. Триоксид молибдена получают термическим разложением парамолибдата аммония.
В производственной практике термическое разложение парамолибдата аммония проводят при температуре 450 °С - 500 °C в трубчатых печах непрерывного действия с электрообогревом с получением чистого триоксида молибдена.
В промышленную практику внедрен гидрометаллургический способ разложения азотной кислотой. Пульпа, состоящая из концентрата и 30-35 %-ной азотной кислоты, проходит выщелачивание в последовательно установленных пачуках при перемешивании сжатым воздухом и нагреве острым паром до температуре 90 °С - 100 °С.
Молибден извлекают из кислых маточных растворов, используя различные способы сорбции или экстракции.
За рубежом применяется автоклавный способ окисления молибденита кислородом. Процесс ведется в автоклаве при температуре 120 °С - 160 °C и давлении кислорода 0, 1-0, 14 МПа (10-14 ат). Прямое извлечение молибдена в триоксид по этому способу 90 %, в кислых пульпах содержание серной кислоты составляет 75 %, в циркулирующем растворе повышается концентрация рения. Переработка медно-молибденовых ренийсодержащих промпродуктов в настоящее время осуществляется по схеме окислительного обжига с возгонкой рения, содового выщелачивания обожженного продукта с последующим выделением из растворов молибдата кальция. Возогнанный рений улавливается в мокрой системе очистки газов и затем извлекается по сорбционной схеме в товарный перренат аммония. Окислительно-автоклавное выщелачивание растворами соды и едкого натра при температуре 160 °С - 180 °С, парциальном давлении кислорода 1-2 ат, отношении Ж:Т = 1:8 и продолжительности 14-17 ч обеспечивает извлечение в раствор молибдена и рения до 98 %. Экстракционные методы извлечения молибдена и рения с последующим получением парамолибдата и перрената аммония обеспечивают извлечение из исходного сырья 96 % молибдена и около 90 % рения.
Для выбора способа переработки вовлекаемого в производство сырья необходимо учитывать качество исходного материала, наличие примесей, лимитирующих выбор конечной продукции, а также имеющиеся производственные мощности.
2.18 Иттрий
Технология получения иттрия
Соединения иттрия получают из смесей с другими редкоземельными металлами экстракцией и ионным обменом. Металлический иттрий получают восстановлением безводных галогенидов иттрия литием или кальцием c последующей отгонкой примесей. Элементы иттриевой группы получают комбинированием способов дробного осаждения с ионообменной технологией, так как для такого элемента как иттрий, продукция которого составляет значительные количества, методы функционального осаждения все еще необходимы. Наряду с ионообменной технологией применяют способы дробного осаждения, кристаллизации и экстракции.
Чистую окись иттрия можно получить ионным обменом, когда применяются 90-99 %-ные концентраты иттрия, получаемые в результате отделения его в виде основных нитратов или другими методами.
2.19 Скандий
Технология получения скандия
Металл в виде оксидов извлекают попутно при гидро- и пирометаллургической переработке вольфрамовых, оловянных, титановых, урановых руд и бокситов. Оксиды скандия хлорируют или фторируют при 700 °С - 800 °С, получая соответственно хлориды (ScCl3) и фториды (SсF3) скандия.
Известны следующие способы получения скандия из его соединений: электролитическое - из расплавленных галогенидных сред; металлотермическое - из хлорида или фторида; электролитическое - из расплава оксида скандия во фтороскандиате натрия.
В первом процессе используют в качестве электролита расплав хлоридов скандия, лития и калия.
Во втором - металлический скандий извлекают прямым восстановлением его хлоридов или фторидов металлическим кальцием или алюминием:
2ScF3+3Ca→+3CuF2+2Sc
(2.21)
Предпочтение отдается фториду, так как он негигроскопичен и его легче получить в чистом виде.
В третьем - в качестве электролита используют раствор в расплавленном Nа3SсF6. Перед металлотермическим этот способ имеет преимущества: скандий не загрязняется материалом тигля, не нужна вакуумная дистилляция избытка металловосстановителя, способ может быть реализован как непрерывный.
Для получения скандия высокой чистоты используют исходные вещества максимальной чистоты, и полученный из них металл подвергают последующей сублимации в вакууме (10-3 - 10-4 Па) при температурах 1600 °С - 1700 °C.
2.20 Редкоземельные металлы
2.20.1 Методы разделения редкоземельных элементов
Вследствие близости свойств лантаноидов их разделение - сложная задача. Современные схемы разделения лантаноидов основаны на использовании эффективных методов: жидкостной экстракции и ионного обмена. В некоторых технологических схемах применяют методы избирательного окисления кислородом, хлором, пероксидом водорода и избирательного восстановления цинком, амальгамами цинка и натрия.
Для полного разделения лантаноидов применяют разные схемы с использованием перечисленных методов. Рассмотрим это на примере схемы полного разделения РЗЭ цериевой подгруппы (см. рисунок 2.11).
На разделение обычно поступает смесь гидроксидов, очищенных от примесей. Вначале окислением выделяют церий. Далее, исходную смесь, обогащенную гадолинием, противоточной экстракцией делят на три фракции: I - лантан, празеодим и неодим; II - празеодим, неодим, самарий и европий; III - элементы иттриевой группы. Из II и III фракций восстановлением амальгамой натрия выделяют самарий и европий с последующим осаждением европия добавкой серной кислоты. Для разделения элементов в выделенных фракциях используют также экстракцию и ионообменную хроматографию.
Окисление церия до четырехвалентного состояния применяют для отделения его от других лантаноидов. Церий легко окисляется кислородом в процессе сушки смеси гидроксидов РЗЭ на воздухе при температуре 120 °С - 130 °С или при пропускании воздуха через нагретую суспензию гидроксидов. Применяют также другие окислители: хлор, пероксид водорода. После окисления Се3+ до Се4+ гидроксид трехвалентных лантаноидов растворяют в разбавленной (5-10 %-ной) азотной или соляной кислоте, в то время как гидроксид четырехвалентного церия (CeO2•nH2O) остается в осадке. Последний содержит 94 % - 96 % СеО2.
Для получения более чистого продукта используют избирательную экстракцию Се(NО3)4 из 6-8 н. раствора азотной кислоты, ТБФ или другими экстрагентами.
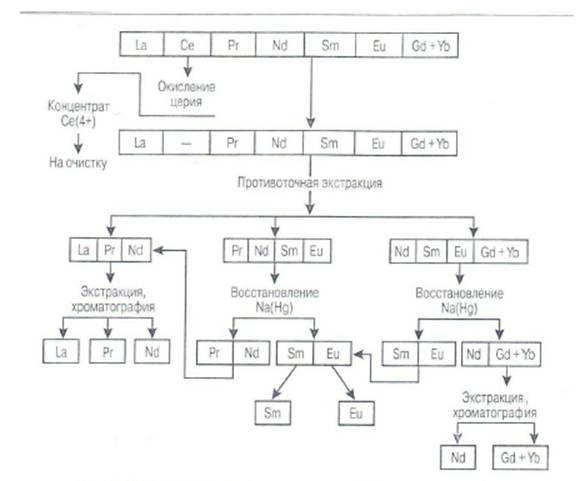
Рисунок 2.11 - Принципиальная схема разделения РЗЭ цериевой подгруппы
В настоящее время экстракционные методы - основные в схемах разделения РPЭ. В промышленной практике для разделения используют преимущественно фосфорорганические экстрагенты - ТБФ, Д2ЭГФК и карбоновые кислоты. Перспективные экстрагенты - нефтяные сульфоксиды.
При использовании экстракции ТБФ для разделения РЗЭ на подгруппы процесс ведут из нитратных растворов с концентрацией HNO3, 7-10 м/л. При этом иттрий попадает в подгруппу тяжелых РЗЭ (Dy - Lu).
Помимо нитратных растворов, для разделения РЗЭ экстракцией ТБФ используют роданидно-хлоридные растворы. В таких растворах РЗЭ присутствуют в составе комплексов Ln(СNS)3 и Ln(CNS)2Cl, устойчивость которых повышается от лантана к лютецию. Экстрагируемый комплекс имеет состав Ln(CNS)3•nТБФ. Сольватное число n = 3-4. Экстракцию из хлоридно-роданидных растворов применяют в некоторых промышленных схемах для отделения иттрия от тяжелых РЗЭ. Вследствие меньших коэффициентов распределения иттрий остается в водной фазе.
В практике разделения РЗЭ экстракцией большей частью процесс проводят в аппаратах типа "смеситель-отстойник", соединяемых в каскад. Разделение ведут, используя различные известные способы: метод противотока и варианты динамических методов, к которым относится полупротивоток.
Для разделения лантаноидов методом ионного обмена применяют различные типы катионообменных смол. Они представляют собой сильнокислотные катиониты, получаемые совместной полимеризацией стирола и дивинилбензола, и содержат активные группы SО3Н. Разделение осуществляют методом элюентной хроматографии.
Сродство ионов лантаноидов к смоле убывает от La3+ к Lu3+, т.е. в порядке уменьшения размера ионов. Однако сродство к смоле ионов РЗЭ очень близко, что не обеспечивает достаточно эффективного разделения. Лучшее разделение достигается при использовании для вымывания растворов, содержащих органические соединения, образующие с ионами РЗЭ комплексы различной устойчивости.
Вымывание происходит в последовательности, соответствующей прочности анионных комплексов лантаноидов. По мере движения вымывающего раствора вдоль колонки (или ряда последовательно соединенных колонок) смесь катионов разделяется на отдельные сорбционные зоны (полосы), перемещающиеся с определенной скоростью к ее выходу. Для вымывания применяют различные органические соединения, образующие комплексы с лантаноидами: лимонную кислоту, нитрилотриуксусную кислоту (НТА) и этилендиаминтетрауксусную кислоту (ЭДТА). Последнюю наиболее широко применяют при хроматографическом разделении РЗЭ С трехзарядными ионами лантаноидов ЭДТА образует внутрикомплексные соединения (хелаты), в которых атомы азота связаны с ионом лантаноида координационными связями. Константу устойчивости этих комплексных соединений определяют из уравнения:
![]()
(2.22)
K=[H(LnV)]/[Ln3+][HV3-]
(2.23)
Константы устойчивости комплексов лантаноидов с ЭДТА увеличиваются от лантана к лютецию, т.е. с возрастанием порядкового номера элемента. Константы устойчивости комплексов двух соседних РЗЭ отличаются одна от другой в среднем в 2, 4 раза. Это обусловливает большую избирательность действия ЭДТА при ее применении для вымывания катионов РЗЭ из катионита.
РЗЭ разделяют в системе, состоящей из ряда последовательно соединенных колонок, заполненных смолой. Первые одна или две колонки служат для насыщения смолы катионами РЗЭ, последующие колонки - разделительные. В процессе элюирования в них образуются сорбционные зоны.
На выходе из системы колонок фильтрат собирают отдельными фракциями. На рисунке 2.12 показаны выходные кривые вымывания раствором ЭДТА для случая разделения трех элементов. Первая волна соответствует выходу тербия, вторая - европия, третья - самария, что согласуется с убывающей прочностью комплексных соединений в ряду Tb-Eu-Sm.
Для регенерации ЭДТА растворы подкисляют до рН 0, 5-1. При этом комплексные соединения лантаноидов разрушаются и осаждается малорастворимая ЭДТА.
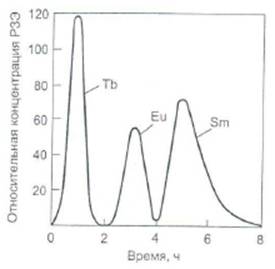
Рисунок 2.12 - Кривые вымывания тербия, европия и самария, сорбированных на смоле 0, 26 М раствором ЭДТА при рН 3, 62
Если начальная удельная загрузка разделяемой смеси РЗЭ небольшая (ниже 5 от массы смолы), а общая длина колонок для разделения достаточно велика, то выходящие из колонки фракции фильтрата содержат только один из разделяемых лантаноидов.
Хроматографический метод позволяет получить индивидуальные РЗЭ высокой степени чистоты, однако метод малопроизводителен. Поэтому большей частью предварительно разделяют элементы другими методами, применяя ионный обмен для разделения и очистки смесей близких элементов.
Ниже приводится подробное изложение технологий разделения РЗЭ на группы и индивидуальные элементы.
2.20.2 Разделение суммарных концентратов РЗЭ на группы и индивидуальные элементы
В группу лантаноидов входят 14 4f-элементов, следующих за лантаном (Ce - Lu), в группу редкоземельных (в соответствии с современными представлениями) сам лантан, иттрий (который по размерам атома и иона попадает в ряд тяжелых лантаноидов: ионные радиусы Dy3+ 1, 07Ǻ, Ho3+ 1, 05 Ǻ, Y3+ 1, 06 Ǻ [6] и сходен с ними по химическим свойствам из-за сходств внешних электронных - валентных - оболочек с лантаном), а также скандий - аналог иттрия и лантана по III B (или III побочной) группе периодической таблицы элементов Д.И. Менделеева.
В эпоху первооткрывателей был хорошо известен способ разделения РЗЭ на цериевую и иттриевую группы - фракционное осаждение двойных сульфатов. Осаждение двойных сульфатов оказалось перспективным из-за значительной разницы в растворимости соединений РЗЭ в насыщенных растворах сульфатов щелочных элементов и аммония. До недавнего времени метод широко применялся на практике. Наименьшей растворимостью в насыщенных растворах сульфатов щелочных элементов обладают двойные сульфаты РЗЭ цериевой группы (La - Sm), немного лучше растворяются одноименные соединения Eu - Tb, а элементы иттриевой подгруппы Dy - Yb и Y наиболее растворимы. Обычно двойным сульфатам (некоторые авторы относят их к комплексным солям) приписывают формулу
xR2(SO4)3•yM2SO4•zH2O,
(2.24)
где R - редкоземельный металл;
М - K, Na, NH4+;
x, y, z - переменные.
Для более четкого разделения в процессе осаждения двойных сульфатов было предложено добавлять в раствор комплексообразователь - этилендиаминтетрауксусную кислоту [10, 11] или ацетат аммония [12]. Последовательность операций, а также возможность применения еще одного комплексообразователя - двунатриевой соли этилендиаминтетрауксусной кислоты (трилон Б) описаны в [9]. С помощью такого процесса были получены 99, 99 % концентраты Gd, Dy, 99, 9 % - Ho, Lu и 97 % Tb.
Для разделения РЗЭ можно воспользоваться методом осаждения гидроксидов. Следует учитывать, что рН осаждения гидроксидов того или иного элемента из растворов зависит от прочности его соединений с анионами (комплексообразователями), присутствующими в этом растворе (с увеличением прочности комплекса рН осаждения смещается в более щелочную область), а также от начальной концентрации (увеличение концентрации иона смещает рН начала его осаждения в кислую область). На практике четкого разделения не происходит, в нерастворенной части гидроксидов остаются изоморфно соосажденные лантаноиды начала группы. Аналогичная картина наблюдается при попытках разделения путем постепенного повышения рН добавлением щелочи. Четкость разделения размывается за счет того же изоморфного соосаждения, кроме того, в технологических условиях трудно поддерживать величину рН с точностью до 0, 1-0, 2 единиц.
Применение гомогенного осаждения позволяет увеличить четкость разделения РЗЭ, однако в результате получаются скорее концентраты, чем индивидуальные элементы.
В некоторых случаях методом перекристаллизации или осаждения за 1-2 ступени возможно получить достаточно чистый лантаноид. Такой случай обычно реализуется для лантаноидов, имеющих достаточно устойчивую аномальную валентность, отличную от +3. При этом свойства лантаноида аномальной валентности настолько изменяются, что его отделение существенно облегчается.
Окисление Се(III) до Се(IV) можно произвести с помощью элементарного хлора, брома, перманганата и бромата калия, висмутата натрия, электрохимически и т.п. В производственных условиях часто прибегают к "окислительной сушке" гидроксидов. Для этого осажденные гидроксиды элементов цериевой группы сушат на воздухе, периодически перемешивая (перелопачивая). Окисление Се(III) в Се(IV) кислородом воздуха визуально отмечается потемнением (приобретением коричневого цвета) осадка. Затем смесь гидроксидов репульпируют в воде, рН суспензии доводят до 4-3. При этом все гидроксиды трехвалентных лантаноидов растворяются, гидроксид Се(IV) остается в осадке. Весьма удобно применять для этой цели барботаж элементарного хлора через щелочную суспензию гидроксидов лантаноидов Се-группы. Хлор вначале окисляет церий, переводя Се(ОН)3 в Се(ОН)4, затем за счет растворения хлора рН суспензии понижается. Наиболее основный гидроксид Се(IV) остается в осадке, в то время, как остальные гидроксиды Ln(OH)3 переходят в раствор.
Первоочередное отделение Се решает две задачи: получение достаточно чистого его концентрата, а также для уменьшения нагрузки на последующие процессы получения индивидуальных РЗЭ или их концентратов. Практически все схемы получения индивидуальных РЗЭ включали предварительное отделение превалирующего в группе элемента (Се и La - в цериевой группе, Y - в иттриевой).
После отделения Се различие в рН осаждения La и Pr становится значительным (La 7, 82; Pr 7, 35, т.е. практически 0, 5 единицы рН). В таких условиях возможно отделение La от остальных элементов Се-группы тонким регулированием рН, особенно при использовании вариантов гомогенного осаждения.
Обычно после отделения доминирующих в группе элементов (Се, La) производят осаждение Sm и Eu после восстановления их ионов до двухвалентного состояния. Двухвалентные РЗЭ проявляют свойства, сходные с ионами щелочно-земельных элементов (в частности, образующих осадок с сульфатными анионами). В иттриевой подгруппе таким способом выделяют концентрат Yb. Для проведения восстановления предпочтительно использовать материалы с повышенным содержанием восстанавливаемых элементов (предварительное отделение доминирующих в группе La, Ce, Y).
К сожалению, для доминирующего элемента иттриевой подгруппы (Y) нет столь четкого и надежного способа отделения, как для Се и La. Применяют различные методы предварительного концентрирования, как тонкое регулирование рН (нейтрализация), осаждение двойных хроматов РЗЭ и калия из хлоридных растворов и другие [16].
Для выделения индивидуальных элементов различной степени чистоты использовали дробную кристаллизацию различных соединений. Дробную кристаллизацию часто называют фракционированием и для ее проведения обычно используют те соли РЗЭ, которые имеют высокую растворимость в выбранных средах при высокой температуре, выраженную положительную зависимость растворимости от температуры (с понижением температуры растворимость резко снижается), предпочтительно образующие кристаллы с хорошо выраженной структурой, легко отделяемые от маточной жидкости. Чаще всего для целей разделения кристаллизацией используют двойные нитраты РЗЭ и магния, аммония или марганца. Трудоемкий и длительный, тем не менее, метод позволяет получить более чистые препараты отдельных РЗЭ, чем метод осаждения.
Метод дробной кристаллизации основан на различной растворимости одноименных соединений редкоземельных элементов. При разделении между твердой и жидкой фазой (в процессе кристаллизации) достигается обогащение твердой фазы менее растворимым компонентом смеси (и наоборот - жидкая фаза обогащается более растворимым компонентом). Если твердая фаза гомогенна (находится в равновесии с жидкой средой), соблюдается термодинамический закон распределения:
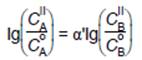 ,
,
(2.25)
где СА и СВ - концентрации компонентов А и В;
индекс I - относится к твердой фазе;
индекс II - к жидкой;
α- коэффициент разделения.
Эффективность каждой операции кристаллизации часто характеризуют коэффициентом обогащения:
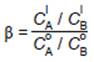
(2.26)
Для разделения дробной кристаллизацией часто использовали броматы (Ln)BrO3•9H2O, диметилфосфаты Ln[(CH3)2PO4]3, двойные нитраты 2Ln(NO3)3•3Mg(NO3)2•24H2O, Ln(NO3)3•2NH4NO3•4H2O [19].
Следует отметить, что четкость разделения, как в методе дробной кристаллизации, так и осаждения можно увеличить добавлением в раствор различных комплексообразователей (типа ЭДТА - этилендиаминтетрауксусной кислоты). При этом возможно достаточно резкое сокращение требуемого для получения искомого концентрата (или чистой соли) числа ступеней процесса.
Особенно плодотворным применение комплексообразователей оказалось при разработке ионообменных методов разделения РЗЭ (см. ниже).
Следует особо отметить огромную роль трудоемких и чрезвычайно медленных классических методов разделения РЗК, которые на начальных этапах позволили получить более или менее чистые индивидуальные металлы и нащупать некоторые из их разнообразнейших областей применения. Интерес к их практическому использованию повысил спрос на сравнительно чистые препараты, которые были необходимы в количествах, уже недоступных для использовавшихся к тому времени классических методов разделения. В 1935 году появляются синтетические органические ионообменники [23, 24], которые постоянно усовершенствовались. Одной из первых крупномасштабных областей применения ионного обмена была водоподготовка, деионизация воды. Однако скоро новые ионообменники стали находить применение в гидрометаллургии цветных и редких металлов. Появление синтетических ионообменников существенно ускорило внедрение хроматографических методов в технологию многих металлов.
Органические сорбенты или смолы - это высокомолекулярные соединения (нерастворимые в воде, но обладающие способностью к набуханию), имеющие в своем составе ионы, способные к обмену с ионами внешнего по отношению к иониту раствора. Происходящую на смоле реакцию можно записать:
RM1+M2↔RM2+M1,
(2.27)
где R - каркас смолы (обычно высокомолекулярное органическое соединение);
M1 - ион смолы, способный к обмену;
M2 - ион в растворе (извлекаемый ион).
Если обменивающиеся ионы (M1 и М2) - катионы, то смола - катионит, если анионы - анионит. В случае обмена катионов R имеет отрицательный заряд, а в случае обмена анионов - R несет положительный заряд.
Одним из широко распространенных катионитов периода бурного развития ионообменной технологии был сульфокатион КУ-2. В качестве ионогенной группировки к каркасу смолы прививали группы - SO3H, водород которых обменивался с катионом водной фазы.
Оказалось, что с увеличением основности ионов РЗЭ возрастает их способность к поглощению таким катионитом. Род "сродства" ионов РЗЭ к сульфокатиониту выглядит следующим образом (трехвалентные катионы): La > Ce > Pr > Nd > Sm > Eu > Gd > Tb > Dy > Ho > Y > Er > Tm > Yb > Lu [17]. Такой порядок сорбции может вызвать определенные вопросы. Дело в том, что в результате лантаноидного сжатия ионный радиус в ряду La - Lu уменьшается, что могло бы вызвать образование более прочного соединения Lu3+ с сульфогруппой смолы, чем соединение лантана. Однако, гидратированные радиусы лантаноидов (в связи с уменьшением ионного радиуса из-за лантаноидов сжатия) у Lu3+ больше, чем у La3+ (закономерно возрастают от La к Lu), что и приводит к ослаблению связи с ионитом Lu по сравнению с La. Если в колонку с сульфосмолой (КУ-2) непрерывно подавать раствор, содержащий все катионы лантаноидов, ионы с меньшим сродством в смоле по мере продвижения вдоль колонны будут постепенно опережать ионы, образующие более прочные соединения. На выходе из колонки первыми должны появиться ионы лютеция. Такой метод разделения называется фронтальным анализом, им можно получить в чистом виде небольшое количество наименее сорбируемого иона.
Если в смесь сорбируемых ионов ввести какой-либо комплексообразователь, то за счет образования устойчивых комплексов сорбируемость должна уменьшаться, особенно сорбируемость ионов, которые образуют более прочные комплексы.
В процессах разделения РЗК применяют большое число комплексообразователей (ЭДТА, Трилон Б, лимонная кислота, нитрилотриуксусная кислота и др. [13, 17, 26, 29]) Для организации процесса разделения в колонных аппаратах используют методы: фронтального анализа, позволяющего получить небольшие количества наименее сорбируемого элемента в чистом виде. Метод элюирования, при котором в колонне образуются отдельные зоны всех разделяемых элементов, которые с разной скоростью перемещаются вдоль колонны. При достаточной длине колонны на выходе можно получить все разделяемые элементы в чистом виде, однако увеличение длины колонны приводит к образованию весьма разбавленных растворов. Вытеснительная хроматография позволяет образовать в колонне ряд последовательных зон, в которых находятся все разделяемые элементы. Зоны продвигаются вдоль колонны с постоянной скоростью (после их формирования на определенной длине аппарата) в порядке роста сродства элемента к смоле для данного состава раствора - впереди находится наименее сорбируемый ион. Скорость продвижения зон определяется скоростью подачи раствора иона - вытеснителя, который обладает наибольшим сродством к смоле и вытесняет с нее ранее сорбированные ионы разделяемой смеси. В таком режиме можно получить все разделяемые ионы в чистом виде, отбирая выходящий из колонки раствор элемента данной зоны, отсекая порции раствора, соответствующие участкам перекрывания зон соседних по сорбируемости элементов (впереди - менее сорбируемый, позади более сорбируемый).
Метод ионообменной хроматографии внес коренной переворот в разделение РЗМ. После его внедрения роль процессов фракционного осаждения и кристаллизации снизилась до использования на начальных этапах грубого разделения РЗМ, приготовления исходных для хроматографического разделения концентратов. Открылись возможности получения чрезвычайно чистых (до нескольких девяток после запятой) препаратов индивидуальных РЗМ, в количестве, достигающих для таких элементов, как Gd, Sm, Y нескольких тонн. Их цена резко снизилась, что позволило расширить поиски областей их практического применения. Дальнейшее развитие проблемы подобно автокаталитическому процессу - открытие новых областей применения [18] обостряло проблему расширения производства, что к рубежу 1950-х гг. привело к необходимости отыскания более производительного, чем ионообменная хроматография, метода разделения. Им оказалась жидкостная экстракция. Однако ионный обмен в ряде случаев сохранил свою роль, особенно в процессах ультратонкой очистки препаратов, получения индивидуальных РЗМ особой степени чистоты.
Экстракция - это распределение данного элемента (его соли) между двумя несмешивающимися жидкими фазами, одна из которых - органическая. Экстракция элемента характеризуется коэффициентом распределения:
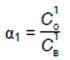 ,
,
(2.28)
где С1 - концентрация элемента 1,
индексы о и в относятся к органической и водной фазам.
Коэффициент разделения (селективности):
![]() ,
,
(2.29)
где S > 1 - элемент 1 преимущественно (по сравнению с элементом 2) переходит в органическую фазу.
Многократное повторение процесса разделения в многоступенчатых, противоточных процессах приводит к практически полному разделению смеси элементов 1 и 2 (или группы элементов по границе элементов 1-2).
В начале 1950-х гг. было убедительно показано, что ТБФ пригоден для разделения РЗЭ в соляно-, а особенно - азотнокислых средах. При экстракции из 15, 6 моль/л HNO3 коэффициенты разделения РЗЭ увеличивались с ростом атомного номера. Коэффициент разделения для пары смежных РЗЭ в этих условиях равнялся 1, 5-1, 9. На рисунке 2.13 представлена зависимость коэффициентов распределения микроколичеств РЗЭ при экстракции ТБФ в зависимости от номера элемента и кислотности водной фазы.
Рисунок 2.13 - Зависимость коэффициента распределения (D) РЗЭ от порядкового номера и равновесной концентрации HNO3 при экстракции ТБФ
Три-н-бутилфосфат - доступный и сравнительно недорогой реагент. Его производство налажено в значительных масштабах.
Начиная с 1950-х гг., экстракция постепенно становится основным современным методом разделения РЗЭ. В связи с этим направления поисков в области совершенствования применяемых экстрагентов, комплексообразователей, совершенствования аппаратурного оформления процесса можно рассматривать как основные направления, основные современные тенденции в области разделения и очистки РЗЭ.
2.20.3 Экстракционное разделение редкоземельных элементов
2.20.3.1 Физико-химические основы экстракционного разделения редкоземельных элементов
В настоящее время для экстракционного разделения РЗЭ используют растворы индивидуальных экстрагентов различных классов в инертном разбавителе, а также растворы их смесей подходящего состава. Для осуществления экстракционного разделения РЗЭ в промышленном масштабе используют технические экстрагенты, производство которых освоено в каждой стране. Наибольшее распространение получили следующие группы экстрагентов:
- нейтральные фосфорорганические соединения (НФОС);
- нейтральные соединения (НС);
- фосфорорганические кислоты (ФОК);
- карбоновые кислоты (КК);
- амины и соли аминов;
- четвертичные аммониевые соли (ЧАС);
- хелатные экстрагенты (ХЭ);
Экстракция смесями экстрагентов может быть отнесена к трем большим группам:
- экстракция синергетными смесями экстрагентов;
- бинарная экстракция;
- экстракция в присутствии хелатного или комплексообразующего агента.
В жидкостной экстракции РЗЭ из перечисленных одноименных смесей часто используют нейтральные экстрагенты, например, смеси три-н-бутилфосфата (ТБФ) и три-н-октилфосфиноксида (ТОФО).
В некоторых случаях для экстракции РЗЭ могут быть использованы тройные смеси экстрагентов, например, два нейтральных и один катионообменный или анионообменный. Зачастую второй нейтральный экстрагент играет роль модификатора для повышения растворимости экстрагируемого смешанного комплекса металла с двумя другими экстрагентами. Часто в этой роли используют высшие спирты (ВС) или ТБФ.
Синергетная экстракция, как экстракция смесями двух экстрагентов, зародилась в середине 1950-х гг.
Для количественного описания синергетной экстракции M. Taube и S. Siekierski был введен, так называемый, синергетный коэффициент SMe, вычисляемый по уравнению:
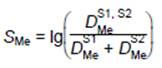 ,
,
(2.30)
где ![]() ,
, ![]() ,
, ![]() - коэффициенты распределения металла в смесь экстрагентов, в первый и во второй экстрагенты, соответственно.
- коэффициенты распределения металла в смесь экстрагентов, в первый и во второй экстрагенты, соответственно.
Если синергетный эффект невелик, то можно пользоваться соотношением (2.31):
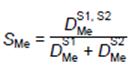 ,
,
(2.31)
В соответствии с уравнениями (2.27) и (2.28) синергетный эффект наблюдается при SMe > 0 и SMe > 1 соответственно. Если SMe < 0 и SMe < 1 для тех же уравнений, то говорят об "антисинергетном", "антисинергетическом" или "антагонистическом эффекте", т.е. о снижении распределения целевого компонента в смесь двух и более экстрагентов, по сравнению с аддитивным распределением в индивидуальные. Величина синергетного коэффициента позволяет количественно оценить экстракционную способность выбранной композиции.
При рассмотрении бинарных смесей анионообменного и катионообменного экстрагентов необходимо выделить так называемую бинарную экстракцию. Для бинарной экстракции в качестве экстрагента используют нерастворимые в водной фазе соли, состоящие из аниона органической кислоты, связанного с катионом органического основания, например, карбоксилат четвертичного аммониевого основания (ЧАО). Бинарный экстрагент образует прочную ионную связь между катионом и анионом только в определенной для каждой пары области рН равновесной водной фазы: в щелочных, нейтральных и слабокислых растворах. При понижении рН за счет введения в растворы неорганических кислот происходит протонизация органической кислоты и присоединение ее противоиона к катиону органического основания. В результате этого процесса, протекающего при повышении кислотности водного раствора, бинарный экстрагент распадается на смесь двух экстрагентов - анионообменного и катионообменного. Часто такие смеси проявляют синергетный эффект при извлечении РЗЭ из водных растворов. Соответственно бинарные экстрагенты будут также рассматриваться как смеси двух экстрагентов, образующиеся при определенных условиях экстракции.
Одним из вариантов экстракции РЗЭ является введение в водный раствор комплексообразователя того или иного типа, растворимого в водной фазе и образующего с ионом РЗМ комплексное соединение. Затем водорастворимый комплекс извлекают из водной фазы экстрагентом с образованием в органической фазе смешанного, как правило, комплексного соединения. Такая экстракция также будет рассматриваться как экстракция смесями экстрагентов.
Промышленные экстрагенты
Использование экстракционных процессов для разделения РЗЭ в промышленном масштабе невозможно без организации многотоннажного производства экстрагентов различных классов. Как правило, в каждой стране, в промышленном масштабе производятся необходимые экстрагенты: НФОС, ФОК, КК, амины и соли ЧАО, ХЭ, а также некоторые комплексообразующие реагенты. Наименования, фирменные названия, химический состав и некоторые характеристики наиболее известных, доступных и широко применяемых экстрагентов для разделения РЗЭ представлены в таблице 2.2.
Необходимо отметить, что многие в настоящее время не производятся в промышленном масштабе. К этим экстрагентам относятся: ДИОМФ, ФОР, ПАФНК, ИДДФК, ВИК-1С, ВИК-М, ТАА, ТАМАН, ГБТА. Для успешного развития редкоземельной промышленности необходимо восстановить производство перечисленных выше экстрагентов в многотоннажном объеме. Также среди экстрагентов, выпускаемых в зарубежных странах, могут быть найдены аналоги или такие же реагенты, которые могут быть использованы вместо перечисленных отечественных экстрагентов.
В этой связи остается актуальным поиск новых синергетных смесей широко известных и хорошо зарекомендовавших себя реагентов для решения новых задач по извлечению и разделению РЗЭ.
Таблица 2.2 - Характеристики некоторых промышленных экстрагентов
|
Наименование Фирменное название |
Химическое название |
Химическая формула |
Содержание, % |
Нейтральные фосфорорганические соединения (НФОС) | |||
|
ТБФ |
Три-н-бутилфосфат |
(n-С4H9O)3P=O |
100 |
|
ДИОМФ |
Ди-(изооктил)метилфосфонат |
(i-C8H17O)2(CH3)P=O |
95 |
|
ФОР |
Фосфиноксид разнорадикальный |
(i-C8H17)2(CH3)P=O |
95 |
|
ТОФО |
Три-н-октилфосфиноксид |
(n-C8H17)3P=O |
100 |
Катионообменные экстрагенты | |||
|
Д2ЭГФК |
Ди-(2-этилгексил)-фосфорная кислота |
[(С6Н13(С2Н5)О]2P(O)OH |
67-99, 8 |
|
ИДДФК |
Изо-додецилфосфетановая кислота |
70-80 | |
|
ПАФНК |
Полиалкилфосфонитрильная кислота |
[(RO)2P(N)OH] | |
|
ВИКК |
Высшие α-изокарбоновые кислоты |
H(CH2-CH2)n(C2H5)(C4H9)C(O)OH |
> 98 |
|
Versatic 10 |
α-изокарбоновая кислота |
R1R2R3C(O)OH |
99 |
|
CYANEX 272 |
Ди-(2, 4, 4-триметилпентил) фосфиновая кислота |
[(CH3)2CHCH2CH2(CH3)CH2]2PO(OH) | |
|
PC - 88A |
Моно-2-этилгексиловый эфир 2-этилгексил-фосфоновой кислоты |
[(С6Н13(С2Н5)О](С6Н13(С2Н5)) P(O)OH | |
Анионообменные экстрагенты | |||
|
ТАМАН |
Метилтриалкиламмоний нитрат |
CH3(C7H15-C9H19)3NNO3 |
> 96 |
|
ТАА |
Триалкиламин |
(С7H15-С9Н19)3N |
70-98 |
2.20.3.2 Методы экстракционного разделения РЗЭ
Для экстракционного разделения РЗЭ используют экстракционные системы, в которых величины коэффициентов разделения (факторов разделения), (βln1/ln2) ближайших пар элементов лежат в интервале значений от 1, 6 до 3, 5. Для получения РЗМ чистотой более 99 % из смеси РЗЭ требуется применение многоступенчатых экстракционных процессов, организованных по определенной схеме.
В настоящее время известно три классических метода организации многоступенчатых процессов экстракционного разделения РЗЭ - полупротивоток, противоток и экстракция с перекрестным током. Последний вариант практически не используется в промышленных схемах.
Полупротивоток характеризуется следующей организацией потоков водной и органической фаз: одна фаза находится в неподвижном состоянии, а вторая проходит через одну или N ступеней (ячеек) экстрактора, последовательно вымывая компоненты разделяемой смеси.
Противоток характеризуется движением обеих фаз через N ступеней (ячеек) экстрактора в противоположных направлениях (принцип полного противотока). При проведении полного противотока зачастую в одном каскаде объединяют два процесса - экстракционное извлечение и промывку. В этом случае исходный водный питающий раствор подают в центральную часть каскада, промывной раствор - в конец промывного каскада, а органическую фазу, проходящую противотоком к водной фазе - в начало экстракционного каскада.
Для полупротивотока выделяют три основных способа организации процесса разделения.
1. Классический полупротивоток проводят следующим образом: на первую (нулевую) ступень вводят исходную смесь компонентов, а на все остальные ступени - промывной раствор. Органическая фаза (экстрагент) последовательно проходит через все ступени. Разделяемые компоненты смеси распределяются по ступеням каскада в соответствии с их величинами коэффициентов распределения.
2. Фронтальный анализ является зеркальным отражением классического полупротивотока. В этом случае разделяемая смесь проходит непрерывно через все ступени каскада и выходит из N-й ступени совместно с органической фазой. Последнюю вводят на нулевую ячейку при заполнении каскада исходным раствором.
3. Рациональный метод разделения. При использовании этого варианта разделяемой смесью РЗЭ заполняют одну группу ячеек, а промывным раствором - вторую группу ячеек. Органическая фаза последовательно протекает через все ячейки каскада. Все компоненты разделяемой смеси будут вымываться в порядке уменьшения величин коэффициентов распределения. При обращении фаз, когда неподвижной остается органическая фаза, а проходящей - водная, порядок вымывания меняется на противоположный: в первую очередь вымываются все хуже экстрагируемые компоненты.
Особенность полупротивоточных методов разделения смеси РЗЭ заключается в том, что они практически не отличаются от аналогичных методов разделения ионным обменом или хроматографией. Это позволяет их использовать для получения особо чистых соединений индивидуальных РЗЭ, сколько угодно требуемой чистоты.
Противоточный процесс разделения РЗЭ можно проводить тремя способами:
- по схеме простого противотока (экстракция одним растворителем);
- по схеме полного противотока (экстракция двумя растворителями);
- фракционной экстракцией с накоплением среднего компонента или некоторой смеси компонентов в центральной части противоточного каскада.
В соответствии с первым методом водная или органическая фаза, содержащая разделяемую смесь РЗЭ, движется противотоком органической фазе (соответственно водной фазе) через ячейки противоточного каскада. При такой организации процесса на одном экстракционном каскаде возможно получение одного чистого компонента и одного концентрата РЗЭ, обогащенного по второму компоненту (компонентам).
При использовании метода полного противотока экстракционный каскад разделяют на две части: экстракционную и промывную. Исходный раствор смеси РЗЭ подают в середину полного каскада, промывной раствор - на последнюю ступень промывной части каскада, а органическую фазу на первую ступень экстракционной части каскада. Промывной раствор, прошедший через промывную часть каскада смешивается с питающим раствором в центральной части всего противоточного каскада. При такой организации потоков возрастает чистота разделяемых компонентов и при содержании только двух компонентов, достигается их полное разделение и получение соединений РЗЭ с заданной степенью чистоты.
Разделение с одновременным накоплением среднего компонента позволяет на одном экстракционном противоточном каскаде получать три чистых продукта. Для достижения этих целей коэффициенты распределения в промывной части каскада выбирают такими, чтобы для одного из разделяемых компонентов тройной смеси (например, компонента 2) коэффициент экстракции в экстракционной части каскада был больше 1, а в промывной - меньше 1. Процесс проводят до расчетного уровня накопления, а затем вместо исходного раствора подают промывной раствор и отмывают средний продукт от компонентов 1 и 3.
Применение этого метода позволяет в значительной степени сократить число экстракционных разделительных ступеней, снизить потребление экстрагента и улучшить экономические показатели экстракционного производства.
Таким образом, экстракционное разделение РЗЭ будет определяться следующими наиболее важными факторами:
- селективностью экстракционной системы, включающей как один экстракционный реагент, так и синергетную смесь экстрагентов;
- составом водной фазы, включающим, прежде всего, анионную составляющую водной среды (как правило, хлоридные, роданидные или нитратные среды, в отдельных случаях сульфатная среда);
- наличием высаливающих реагентов;
- наличием промышленных экстрагентов для подбора селективной экстракционной системы;
- методом экстракционного разделения или способом организации экстракционного каскада;
- подбором экстракционного оборудования для создания многоступенчатых противоточных (полупротивоточных) каскадов экстракторов (в настоящее время для этих целей используют, как правило, смесители-отстойники ящичного типа различной конструкции или центробежные экстракторы).
К перечисленным факторам необходимо добавить мероприятия по эффективному разделению фаз с целью разрушения микроэмульсий и повышения степени очистки и разделения РЗЭ в данной экстракционной системе, а также снижения потерь экстрагента. Важным фактором экономического порядка является стоимость экстрагентов, разбавителей, минеральных кислот, в среде которых проводят разделение, высаливателя. Также необходимо учитывать экологические аспекты жидкостной экстракции. Значительные затраты любого экстракционного передела связаны с мероприятиями по пожарной безопасности, так как практически большинство промышленно применяемых разбавителей пожароопасны.
При подборе оборудования для проведения жидкостной экстракции в коррозионно-активных средах необходимо учитывать стоимость материалов, из которых изготовлены экстракторы (в настоящее время это, как правило, полимерные материалы: полипропилен, фторопласт), их устойчивость к коррозионным средам и возможность их использования при повышенных температурах.
2.20.4 Состав исходных концентратов редкоземельных элементов, полученных из различных видов минерального сырья
Соединения РЗЭ получают из концентратов, выделенных из минерального сырья. Известно более 100 редкоземельных минералов, образованных оксидами, фосфатами, карбонатами, силикатами, фторидами РЗЭ. В настоящее время промышленное значение имеют только некоторые из РЗЭ минералов. Это, прежде всего, фосфаты - монацит (CePO4), ксенотим (YPO4), фтор-карбонаты - бастнезит (CeCO3F), иттросинхизит (YCa(CeCO3)2F), сложный оксид - лопарит (NaCeTi2O6). Промышленным источником РЗЭ являются также минералы коры выветривания гранитов, в которых РЗЭ в ионной форме адсорбированы на поверхности частиц.
Потенциальным промышленным минеральным сырьем, подлежащим переработке для выделения суммы РЗЭ, является гадолинит, содержащий до 50 масс. % суммы оксидов Ln2O3, гагаринит (до 40), иттрофлюорит (до 40), эвдиалит (2), апатит (до 10) и некоторые другие. Для каждого вида минерального сырья различается не только общее содержание суммы РЗЭ, но и состав или содержание каждого индивидуального РЗЭ.
При переработке перечисленных видов сырья получают концентраты РЗЭ, причем состав каждого такого концентрата соответствует составу РЗЭ в минералах (при условии количественного выделения РЗЭ). Эти концентраты (как правило, РЗЭ в них находятся в виде оксидов или карбонатов) используют как основное исходное сырье для разделения на промежуточные концентраты или на индивидуальные элементы. Содержание отдельных РЗЭ в исходном концентрате будет определять в значительной степени стратегию разделения и выбор соответствующей экстракционной системы. Вот почему необходимо знание состава концентратов, полученных из различных видов минерального сырья. В таблицах 2.3-2.4 представлены составы РЗК, выделяемых из основных промышленно перерабатываемых руд, добываемых в Российской Федерации, и для сравнения в Китае - основном производителе редкоземельных соединений для промышленного производства изделий из РЗЭ. Эти таблицы составлены на основе литературных источников и могут быть дополнены другими данными, опубликованными в открытой литературе.
Необходимо отметить, что первой стадией разделительного процесса является перевод твердых концентратов РЗЭ в раствор подходящей минеральной кислоты. В ряде способов переработки РЗЭ-содержащего минерального сырья извлечение отдельных элементов осуществляют методами осаждения. В результате такой переработки, полученные для дальнейшего экстракционного разделения исходные концентраты РЗЭ, могут изменять свой исходный состав.
Таблица 2.3 - Содержание РЗЭ в рудах и минералах России
|
РЗЭ |
La |
Ce |
Pr |
Nd |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
Y |
Лопарит, Ловозерское месторождение | |||||||||||||||
|
Содержание, % вес. |
25 |
53 |
6 |
14 |
0, 9 |
0, 08 |
0, 56 |
0, 37 |
0, 12 |
0, 08 |
0, 016 |
0, 003 |
0, 008 |
0, 002 |
0, 008 |
Апатит | |||||||||||||||
|
Содержание, % вес. |
27, 3 |
42, 8 |
4, 9 |
13, 9 |
2, 1 |
0, 7 |
1, 7 |
0, 1 |
1, 0 |
0, 1 |
0, 4 |
0, 01 |
0, 1 |
0, 02 |
4, 9 |
Красноуфимские монацитовые концентраты, в пересчете на оксиды | |||||||||||||||
|
Содержание, % вес. |
24, 6 |
43, 0 |
5, 5 |
20, 5 |
2, 0 |
0, 2 |
1, 1 |
0, 7 |
0, 3 |
0, 1 |
0, 3 |
0, 1 |
0, 05 |
0, 1 |
1, 4 |
Eu - монацит | |||||||||||||||
|
Содержание, % вес. |
19, 7 |
45, 6 |
4, 7 |
21, 7 |
3, 7 |
0, 88 |
2, 17 |
- |
0, 14 |
0, 31 |
0, 16 |
- |
0, 5 |
- |
0, 38 |
Гагаринит, Катугинское месторождение | |||||||||||||||
|
Содержание, % вес. |
2, 6 |
9, 5 |
1, 7 |
7, 9 |
3, 3 |
0, 2 |
7, 1 |
1, 1 |
9, 3 |
1, 4 |
5, 2 |
1, 0 |
3, 8 |
0, 7 |
45, 2 |
Иттрофлюорит, Катугинское месторождение | |||||||||||||||
|
Содержание, % вес. |
4, 7 |
12, 1 |
1, 7 |
6, 5 |
2, 6 |
0, 2 |
4, 7 |
0, 4 |
6, 9 |
0, 9 |
5, 2 |
1, 1 |
5, 6 |
1, 2 |
46, 2 |
Эвдиалит | |||||||||||||||
|
Содержание, % вес. |
13, 5 |
29, 1 |
3, 1 |
13, 1 |
4, 3 |
1, 6 |
3, 5 |
0, 6 |
4, 2 |
0, 9 |
2, 1 |
0, 3 |
2, 4 |
0, 3 |
21, 0 |
Таблица 2.4 - Содержание РЗЭ в концентратах минералов Китая
|
Компонент |
La |
Ce |
Pr |
Nd |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
Y |
Бастнезит из Внутренней Монголии | |||||||||||||||
|
Содержание, % вес. |
25, 0 |
49, 5 |
5, 0 |
15, 5 |
1, 5 |
0, 2 |
0, 5 |
< 0, 1 |
0, 1 |
< 0, 1 |
0, 2 | ||||
Монацит из Гуандунга | |||||||||||||||
|
Содержание, % вес. |
21, 0 |
48, 0 |
5, 5 |
16, 5 |
2, 5 |
0, 08 |
1, 8 |
0, 26 |
1, 36 |
3, 0 | |||||
Ионные руды с низким содержанием иттрия (Синву, Пингвин в Гуандуне) | |||||||||||||||
|
Содержание, % вес. |
31, 1 |
3, 4 |
8, 7 |
28, 1 |
5, 3 |
0, 6 |
4, 5 |
0, 5 |
1, 2 |
0, 8 |
0, 3 |
0, 1 |
0, 5 |
< 0, 1 |
15, 4 |
Ионные руды со средним содержанием иттрия (Синфенг в Цзянси) | |||||||||||||||
|
Содержание, % вес. |
26, 5 |
2, 4 |
6, 0 |
20, 0 |
4, 0 |
0, 8 |
4, 0 |
0, 6 |
4, 0 |
0, 8 |
1, 8 |
0, 3 |
1, 2 |
0, 1 |
27, 5 |
Ионные руды с высоким содержанием иттрия (Лонгнан в Цзянси) | |||||||||||||||
|
Содержание, % вес. |
1, 8 |
0, 2 |
0, 9 |
3, 8 |
2, 8 |
0, 02 |
5, 7 |
1, 2 |
8, 4 |
1, 8 |
5, 1 |
0, 8 |
4, 6 |
0, 6 |
62, 5 |
2.20.5 Общие схемы разделения редкоземельных элементов из суммарных концентратов
Выделенные из минерального сырья суммарные концентраты оксидов РЗЭ содержат иттрий и 14 элементов от лантана до лютеция. Для получения каждого индивидуального лантаноида необходимо провести разделение по линиям предыдущий Ln/данный Ln и последующий Ln/данный Ln. Для повышения эффективности выделения индивидуальных РЗЭ проводят их предварительное разделение из суммарных концентратов на группы или групповые концентраты. Традиционно выделяют группу легких РЗЭ (легкую группу): лантан, церий, празеодим, неодим, группу средних РЗЭ (среднюю группу): самарий, европий, гадолиний и группу тяжелых РЗЭ (тяжелую группу): от тербия до лютеция. Иттрий относят к той группе, в которой он концентрируется в разделительном процессе: либо к легкой, либо к тяжелой группе. Часто среднюю и тяжелую группу объединяют в одну среднетяжелую группу.
В соответствии с приведенной выше классификацией РЗЭ на группы, общие схемы разделения суммарных концентратов РЗЭ включают на первом этапе групповые разделения. Традиционно первым разделительным процессом является разделение концентрата РЗЭ на легкую и среднетяжелую группы по линии Nd/Sm, (см. рисунке 2.14), [18, 30]. Иттрий в зависимости от состава разделительной системы может сопутствовать как легкой, так и тяжелой группам РЗЭ, что обозначено на рисунке заключением символа Y в круглые скобки.
Вторым разделительным процессом обычно является разделение среднетяжелой группы РЗЭ на среднюю и тяжелую группы по линии Gd/Tb или Tb/Dy. В дальнейшем выделение индивидуальных РЗЭ проводят для каждой группы отдельно с учетом химических свойств элементов, попадающих в ту или иную группу. Прежде всего, это касается церия и европия, изменение валентных форм которых, позволяет их выделять из суммы легких (Ce) или средних (Eu) РЗЭ осадительными методами.
После выделения церия и европия химическими методами для каждой группы РЗЭ проводят экстракционное разделение на индивидуальные элементы. Учитывая тот факт, что в одном разделительном каскаде не удается сразу получить чистые РЗЭ, процесс разделения может быть разбит на получение концентратов с высоким содержанием (как правило, более 60 %) одного из разделяемой пары элементов и последующим выделением их из полученных концентратов в чистом виде.
Для тяжелой группы РЗЭ, включающей 7 из 14 РЗЭ и иттрий, проводят дополнительное разделение по линии Ho/Er, разграничивающей соответствующие тетрады: Gd, Tb, Dy, Ho и Er, Tm, Yb, Lu.
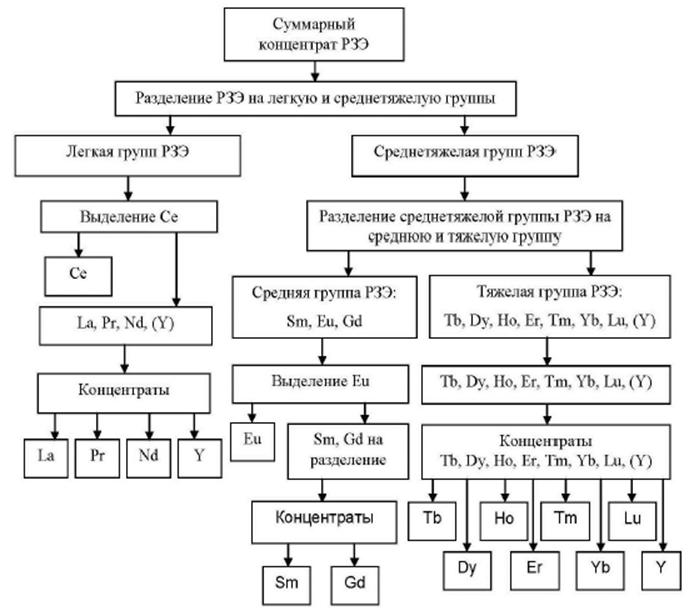
Рисунок 2.14 - Обобщенная схема разделения РЗЭ из суммарных концентратов, выделенных из различных видов минерального сырья
Таким образом, разделение тяжелой группы РЗЭ может быть проведено еще на две подгруппы с последующим выделением индивидуальных тяжелых РЗЭ и иттрия из этих подгрупп.
В общем случае, при получении индивидуальных элементов из суммарных концентратов РЗЭ, содержащих 14 элементов и иттрий, необходимо осуществить многоступенчатый процесс разделения ближайших пар элементов в противоточных экстракционных каскадах с промывкой, содержащих, как правило, от 60 до 80 ступеней. Реэкстракционные каскады содержат 10 и более ступеней.
Для разделения концентрата РЗЭ, полученного из бастнезита, предложены две схемы группового разделения, представленные на рисунках 2.15 и 2.16.
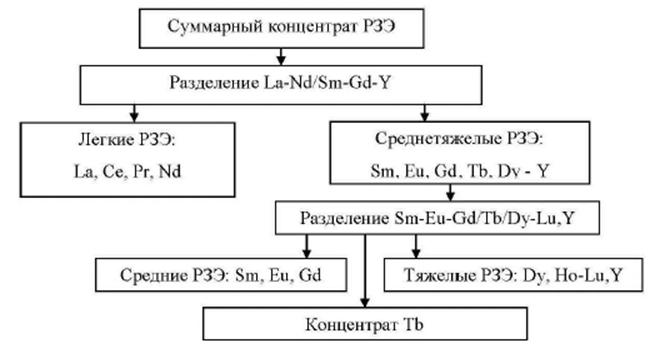
Рисунок 2.15 - Схема 1 разделения группового бастнезитового концентрата РЗЭ, реализованная на предприятиях в Китае
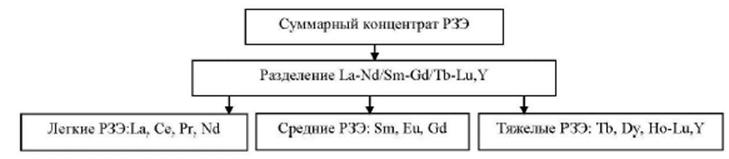
Рисунок 2.16 - Схема 2 разделения группового бастнезитового концентрата РЗЭ, реализованная на предприятиях в Китае
Экстракционное разделение бастнезитового концентрата РЗЭ проводят в солянокислых средах с использованием в качестве экстрагента М2ЭГ(2ЭГ)ФК.
Аналогичная схема была использована в Китае для разделения РЗЭ, выделенных из монацитового концентрата, после очистки от радиоактивных примесей (дезактивации).
Разделение концентратов РЗЭ, выделенных из ионных руд, проводят по схемам, представленным на рисунках 2.17 и 2.18. Вариант разделения зависит от содержания иттрия в исходном продукте. В процессе разделения, представленном на схеме 4, после отделения среднетяжелой группы из нее сначала выделяют иттриевый концентрат по линии Dy/Ho, а затем разделяют на три концентрата: средних РЗЭ (Sm, Eu, Gd), тербия и диспрозия. Из иттриевого концентрата затем выделяют чистый оксид Y2O3.
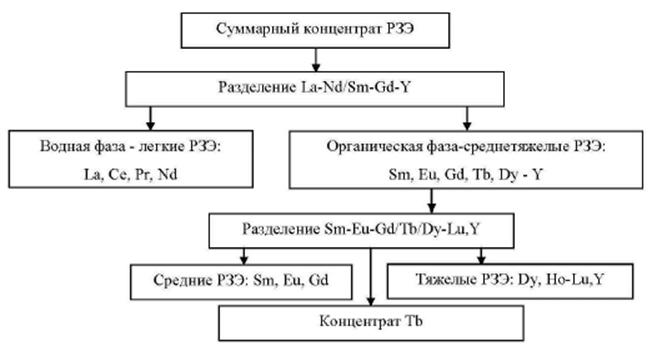
Рисунок 2.17 - схема 3 разделения группового концентрата РЗЭ из ионных руд, реализованная на предприятиях в Китае
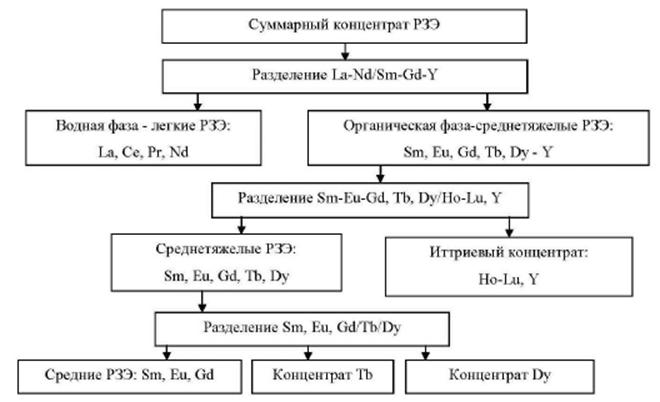
Рисунок 2.18 - Схема 4 разделения группового концентрата РЗЭ из ионных руд, реализованная на предприятиях в Китае
При групповом разделении концентрата, полученного из ионных руд с низким содержанием иттрия, таблица 2.4, используют схему 3, в соответствии с которой выделяемый из среднетяжелой группы концентрат тяжелых РЗЭ содержит более 70 % иттрия. Дальнейшую очистку иттрия от примесей тяжелых РЗЭ проводят с использованием экстракционной системы с нафтеновой кислотой из солянокислых растворов.
Система нафтеновая кислота - водные растворы РЗЭ в HCl может быть использована и для группового разделения концентратов ионных руд со средним содержанием иттрия. Особенностью таких концентратов является практически одинаковое содержание в них La и Y, таблица 2.4. Это обуславливает коэффициент разделения La/Y близкий к 1, поэтому иттрий при разделении концентрируется с элементами легкой группы. Для эффективного отделения иттрия из таких концентратов предложена схема 5 разделения РЗЭ, представленная на рисунке 2.20.
Для разделения концентрата РЗЭ, полученного из ионных руд с высоким содержанием иттрия, более 60 %, в Китае используют схему 6, представленную на рисунке 2.20. Эта схема также использует два экстрагента для групповых разделений: на первом этапе нафтеновую кислоту, а на втором этапе М2ЭГ(2ЭГ)ФК. Разделение проводят в солянокислых средах с различной концентрацией HCl. Изменение состава исходного концентрата РЗЭ в пользу высокого содержания в нем иттрия позволяет уже на втором разделительном каскаде получать иттрий, чистотой более 99, 99 %.
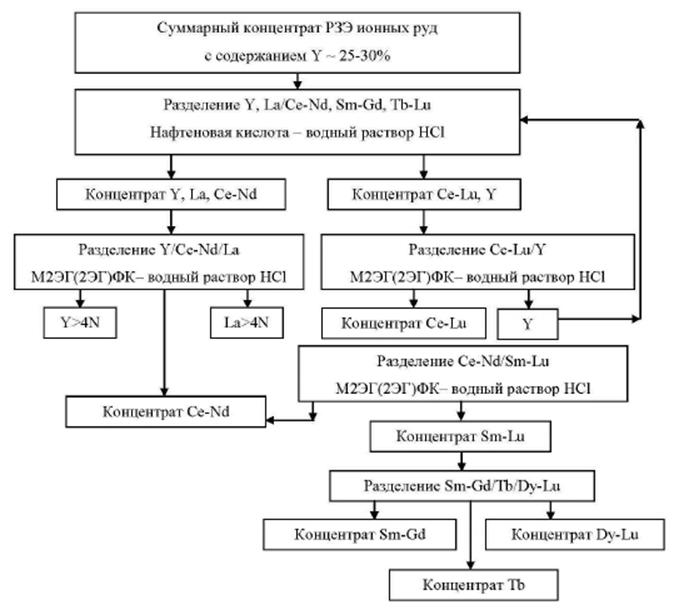
Рисунок 2.19 - схема 5 разделения группового концентрата РЗЭ из ионных руд, реализованная на предприятиях в Китае
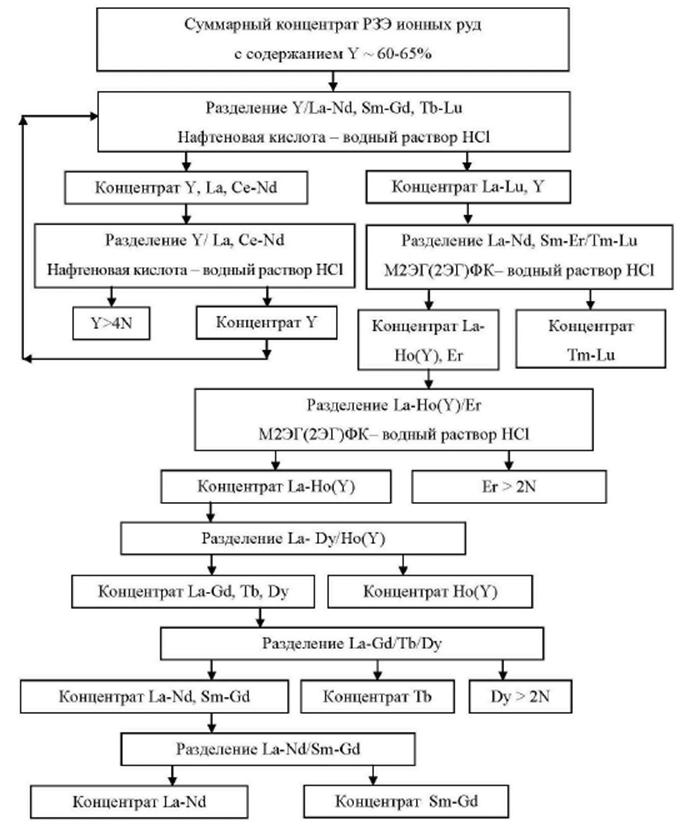
Рисунок 2.20 - схема 6 разделения группового концентрата РЗЭ из ионных руд, реализованная на предприятиях в Китае
Экстракционное разделение РЗЭ в нитратных растворах было реализовано в СССР при переработке концентрата, полученного из руд месторождения "Меловое", Казахстан, п-ов Мангышлак. Усредненный состав этого концентрата представлен в таблице 2.3. Принципиальная схема разделения РЗЭ из концентрата "Меловое" представлена на рисунке 2.21.
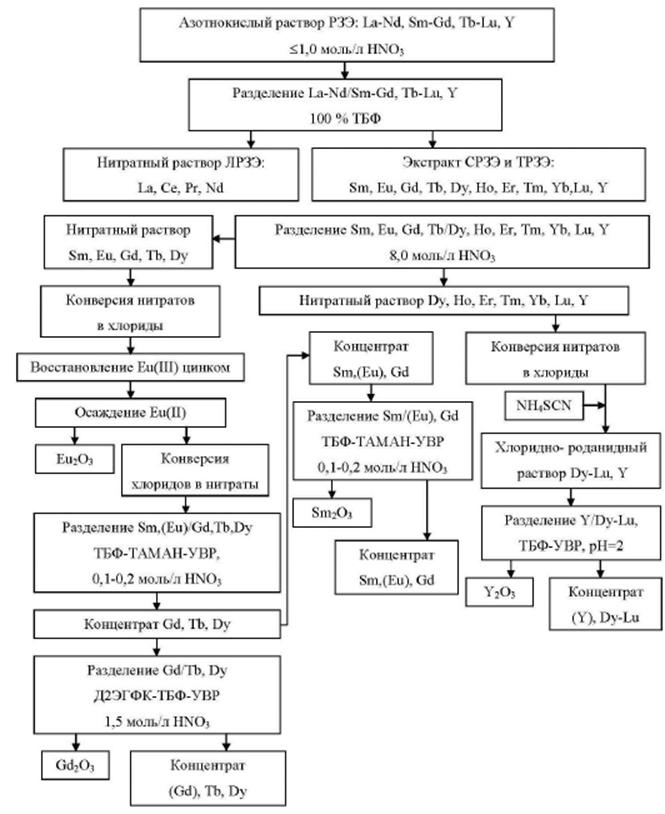
Рисунок 2.21 - схема разделения РЗЭ из концентрата месторождения "Меловое"
Рассмотренные выше схемы разделения исходных концентратов РЗЭ, полученных из минерального сырья, построены по одной общей схеме, позволяющей предварительно разделить все РЗЭ и иттрий на три большие группы - легких, средних и тяжелых РЗЭ. Иттрий, как правило, попадает при разделении в группу тяжелых РЗЭ (поэтому ее называют иттриевой группой).
Необходимо отметить, что разделительные процессы в Китае проводят преимущественно из хлоридных сред, в то время как групповое разделение в отечественных схемах проводят в нитратных средах. Исключение составляет переход от нитратных сред к хлоридным на стадии осадительного выделения Eu.
В настоящее время выделение европия при разделении средней группы РЗЭ предложено проводить экстракционным методом без изменения его валентного состояния, например, с использованием той же синергетной смеси ТАМАН+ТБФ в УВР. Однако это потребует увеличения числа разделительных ступеней при проведении процесса в противоточных каскадах с получением только двух продуктов. При переходе к так называемым трехпродуктовым каскадам разделение сразу трех компонентов Sm, Eu и Gd позволит избежать наращивания числа ступеней разделительного каскада, но может сказаться на производительности.
В соответствии с общей схемой разделения исходных концентратов РЗЭ, рисунок 2.12, дальнейшее выделение индивидуальных элементов проводят исходя из состава каждой группы, на которые был разделен первоначальный концентрат. Поэтому ниже рассмотрены схемы разделения РЗЭ легкой, средней и тяжелой групп, которые также могут быть проведены различными методами.
2.20.6 Разделение РЗЭ легкой группы: La, Ce, Pr, Nd
Для разделения РЗЭ легкой группы на индивидуальные элементы используют различные экстракционные системы, среди которых необходимо выделить растворы ТБФ в УВР для азотнокислых сред и органические кислоты - карбоновые и фосфорсодержащие - для хлоридных растворов.
В Китае для разделения La, Ce, Pr, Nd в солянокислых средах используют экстракционные системы с органическими кислотами, в частности, нафтеновую кислоту, Д2ЭГФК и М2ЭГ(2ЭГ)ФК. Церий в некоторых случаях выделяют из смеси легких РЗЭ окислительно-восстановительным методом до экстракционного разделения. Для повышения эффективности работы экстракционного каскада разделение проводят по двум линиям с получением трех продуктов в одном процессе.
При разделении концентрата легких РЗЭ, полученного при переработке бастнезита и монацита, с содержанием в нем церия (~ 50 %) и лантана (~ 25-30 %) более 80 % используют схемы 1 и 2, представленные на рисунках 2.22 и 2.23.
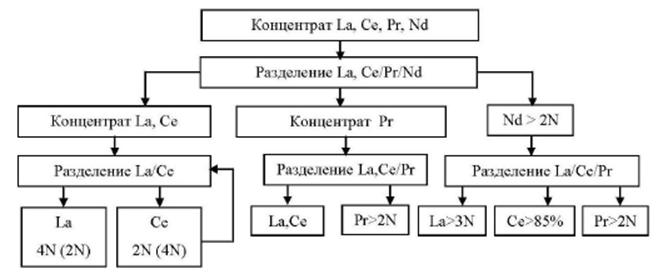
Рисунок 2.22 - схема 1 разделения концентрата РЗЭ легкой группы, полученного из бастнезита или монацита
Экстракцию проводят в системе М2ЭГ(2ЭГ)ФК в УВР - LnCl3 - HCl - H2O.
Согласно схеме 2, рисунок 2.23, на первом каскаде проводят разделение по линии Pr/Nd с получением чистого неодима и концентрата, содержащего лантан, церий и празеодим. На втором каскаде проводят разделение по двум линиям La/Ce и Ce/Pr с получением трех продуктов: чистых лантана празеодима и цериевого концентрата, содержащего более 85 % церия.
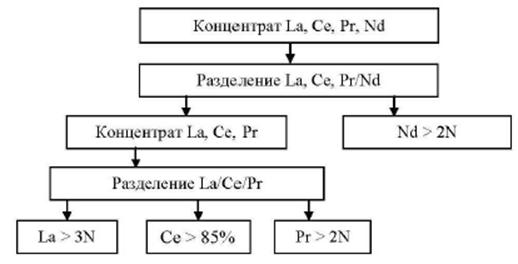
Рисунок 2.23 - схема 2 разделения концентрата РЗЭ легкой группы, полученного из бастнезита или монацита
Для концентратов легких РЗЭ с низким содержанием церия, например, полученным из ионных руд (Ce ~ 1-5 %), разделение на индивидуальные элементы проводят по схеме 3, представленной на рисунке 2.24.
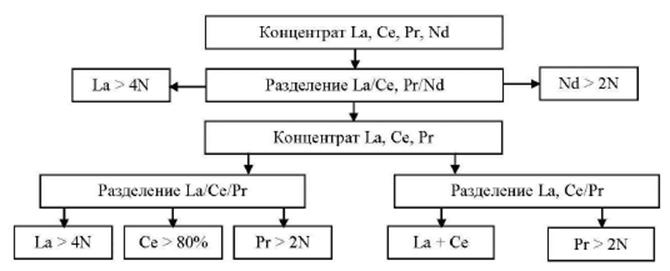
Рисунок 2.24 - схема 2 разделения концентрата РЗЭ легкой группы, полученного из бастнезита или монацита
Экстракционное разделение концентрата легкой группы РЗЭ с использованием экстракции ТБФ из нитратных растворов применяли при переработке апатитовых концентратов, рисунок 2.25.
После экстракционной очистки от нередкоземельных примесей экстракцией 100 %-ным ТБФ из 1, 5-1, 7 моль/л HNO3 и промывки экстракта водным раствором, содержащим 0, 75 моль/л NH4NO3, проводят реэкстракцию РЗЭ подкисленной HNO3 водой. Реэкстракт подают на электрохимическое окисление церия, после которого нитратный раствор разделяют на две части. Из одной части осаждают Ce(IV) аммиаком с получением 95 %-ного концентрата. Вторую часть направляют на экстракционное выделение Ce(IV) с использованием ТБФ в керосине в качестве экстрагента. Ce(IV) экстрагируют в органическую фазу, в то время как трехвалентные РЗЭ остаются в рафинате экстракции. Из экстракта осаждают гидроксид церия с последующим получением из него CeO2 чистотой 99, 9 %. Рафинат экстракции объединяют с фильтратом, полученным на стадии выделения цериевого концентрата, и проводят экстракционное разделение на индивидуальные элементы.
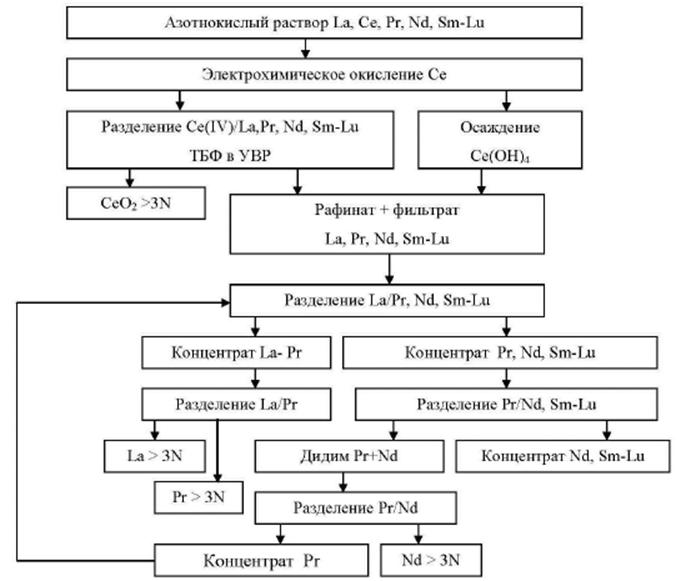
Рисунок 2.25 - Вариант схемы разделения концентрата РЗЭ легкой группы, полученного из апатита
При переработке концентрата легких РЗЭ, полученных из лопарита, также используют экстракцию растворами ТБФ в УВР для последовательного выделения из азотнокислых растворов лантана, празеодима и неодима в виде чистых оксидов, рисунок 2.26. Предварительно из нитратного раствора, содержащего все четыре элемента: La, Ce, Pr, Nd, выделяют церий окислительно-осадительным методом. Окисление проводят электрохимическим способом с осаждением гидроксида церия аммиаком. Возможен вариант окисления церия перманганатом калия в хлоридных растворах. После осаждения Ce(IV) аммиаком хлоридный раствор La, Pr, Nd конвертируют в нитратный, из которого последовательно разделяют эти три элемента на двух противоточных каскадах с промывкой.
Необходимо отметить, что процесс конверсии хлоридных солей РЗЭ в нитратные осуществляют экстракционным способом с использованием, как правило, органических кислот, в частности, Д2ЭГФК или карбоновых кислот, например, ВИК или Versatic 10. С этой целью проводят коллективную экстракцию трехзарядных катионов РЗЭ в органическую фазу, после чего реэкстрагируют требуемой кислотой (при конверсии в нитратную форму - азотной кислотой) подходящей концентрации. Для последующего разделения РЗЭ из нитратных растворов с использованием ТБФ проводят корректировку растворов по содержанию HNO3.
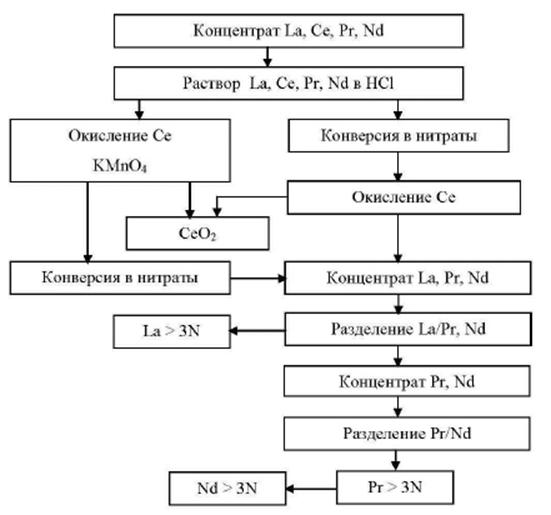
Рисунок 2.26 - Вариант схемы разделения концентрата РЗЭ легкой группы, полученного из лопарита
2.20.7 Разделение редкоземельных элементов средней группы: Sm, Eu, Gd
Разделение РЗЭ средней и тяжелой групп проводят по линиям Gd/Tb, Tb/Dy и даже Dy/Ho, так что дальнейшее разделение на индивидуальные элементы может включать не только выделение самария, европия и гадолиния, но и тербия, и в некоторых случаях даже диспрозия.
Для разделения РЗЭ средней группы используют нитратные и хлоридные среды, как это уже было показано на примере разделения РЗЭ легкой группы. В качестве экстрагентов используют как индивидуальные экстрагенты, например, фосфорсодержащие кислоты, НФОС, так и смеси экстрагентов, например ТАМАН-ТБФ, Д2ЭГФК-ТБФ.
Учитывая возможность простого восстановления Eu(III) до Eu(II), во многих разделительных схемах европий из смеси РЗЭ средней группы выделяют восстановительно-осадительным методом.
В СССР при переработке концентратов РЗЭ, полученных из фосфоритов месторождения "Меловое", разделение среднетяжелой группы проводили по линии Tb/Dy, рисунок 2.21, поэтому концентрат средней группы содержал Sm, Eu, Gd, Tb и частично Dy. Разделение этой группы на индивидуальные элементы начинали с выделения европия восстановительно-осадительным методом. Для этого предварительно проводили конверсию нитратов РЗЭ в хлориды через осаждение гидроксидов РЗЭ аммиаком и последующим растворением в HCl. В дальнейшем конверсию в хлориды проводили с использованием экстракции Д2ЭГФК из азотнокислых растворов и реэкстракцию катионов трехвалентных РЗЭ хлористоводородной кислотой. Полученные солянокислые растворы обрабатывали цинковой пылью для восстановления Eu(III) до Eu(II) и осаждали все находящиеся в растворе РЗЭ аммиаком при рН 11-12. Eu(II) и растворенный цинк оставались в растворе, который отделяли от осадка и обрабатывали азотной кислотой для окисления до Eu(II) до Eu(III). В присутствии избытка аммиака осаждался гидроксид Eu(III), в то время как цинк оставался в растворе. Осадок Eu(OH)3 снова растворяли в соляной кислоте и повторяли операцию отделения европия от соосажденных РЗЭ восстановительно-осадительным методом до получения Eu высокой степени чистоты. Гидроксиды РЗЭ, содержащие небольшие количества европия, промывали аммиаком от растворимых соединений цинка и Eu(II), после чего растворяли в азотной кислоте, осаждали оксалаты РЗЭ с последующим прокаливанием и получением концентрата РЗЭ средней группы с примесями элементов тяжелой группы следующего состава, в масс. %: Sm2O3 - 55-65; Eu2O3 - 0, 1-0, 4; Gd2O3 - 35-40; Tb3O4 - 4-6; Dy2O3 - 3-6.
Полученный концентрат растворяли в азотной кислоте и проводили экстракционное разделение по схеме, представленной на рисунке 2.27.
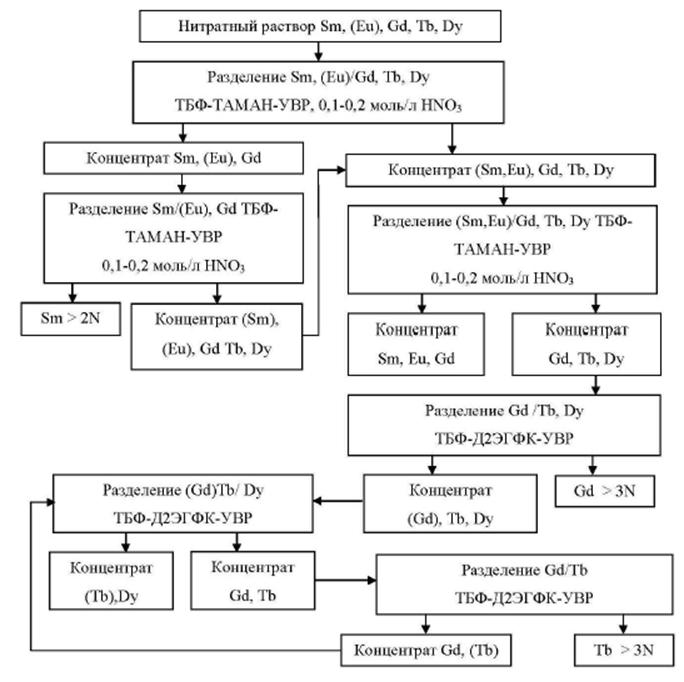
Рисунок 2.27 - Схема разделения средних РЗЭ, полученного из концентрата месторождения "Меловое"
Для проведения экстракционного разделения использовали противоточные каскады с промывкой, содержащие 70-80 разделительных ступеней в каждом каскаде. В качестве экстракторов применяли смесители-отстойники ящичного типа. Один из каскадов представлял собой каскад центробежных экстракторов ЭЦ 125. Технологически рафинат или реэкстракт предыдущего каскада являлся исходным раствором для последующего. Для корректировки растворов при переходе от одного каскада к другому осуществляли упаривание до требуемой концентрации РЗЭ. Технические решения по разделению РЗЭ средней группы по описанной выше схеме были защищены авторскими свидетельствами СССР на изобретение.
Развитие описанной технологической схемы разделения средних и некоторых тяжелых РЗЭ заключалось в замене дорогостоящего и энергозатратного процесса межкаскадного упаривания при корректировке рафинатов экстракции или реэкстрактов на осаждение РЗЭ карбонатом натрия с последующим растворением карбонатов РЗЭ до требуемой концентрации в азотной кислоте.
Разделение средней группы РЗЭ на индивидуальные элементы в хлоридных растворах нашло применение в Китае при переработке концентрата средних РЗЭ, выделенного из монацита или ионных руд, рисунок 2.26. Экстракционное разделение Sm, Eu и Gd проводят из солянокислых растворов с использованием в качестве экстрагента растворов Д2ЭГФК в УВР на одном экстракционном каскаде с получением трех продуктов: самария и гадолиния чистотой более 2N, и концентрата Eu с содержанием от 6 % до 40 % в зависимости от состава исходного сырья. Дальнейшая переработка такого концентрата проводится восстановительно-осадительным методом до получения Eu2O3 флуоресцентного качества.
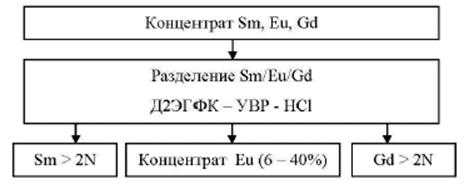
Рисунок 2.28 - Схема разделения концентратов средних РЗЭ, полученных из монацита и ионных руд в Китае
2.20.8 Разделение РЗЭ тяжелой группы: Tb - Lu
Как было описано выше, разделение среднетяжелой группы проводят по линиям Gd/Tb, Tb/Dy или Dy/Ho, поэтому выделение, например, тербия и диспрозия может проводиться при разделении концентратов РЗЭ средней группы. В то же время в тяжелую группу РЗЭ, как правило, попадает иттрий. Выделение иттрия из смесей РЗЭ также можно отнести к процессам разделения РЗЭ тяжелой группы.
Для разделения РЗЭ тяжелой группы в основном используют нитратные и хлоридные среды. Однако при выделении иттрия могут быть использованы роданидные или хлоридно-роданидные растворы.
При переработке концентратов тяжелых РЗЭ из них в первую очередь стараются извлечь в чистом виде Tb, Dy, Er, Y. Поэтому общие схемы разделения включают в основном получение обогащенных концентратов РЗЭ третьей тетрады и иттрия и экстракционное выделение из них требуемых элементов.
На рисунке 2.29 представлена схема экстракционного выделения эрбия и диспрозия из азотнокислых растворов иттрий-эрбиевого концентрата с попутным получением обогащенных концентратов других тяжелых РЗЭ и иттрия, и с использованием 1, 2 моль/л растворов ИДДФК в РЭД-3 в качестве экстрагента на всех разделительных каскадах.
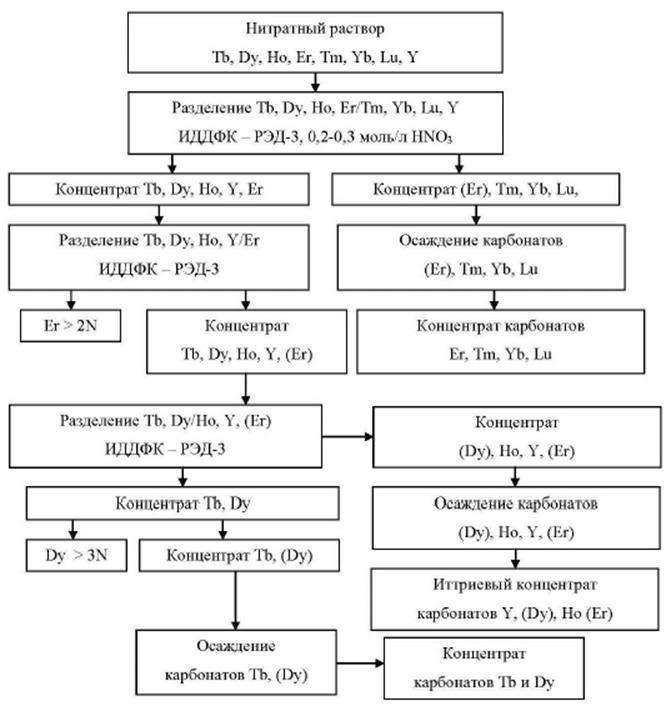
Рисунок 2.29 - Схема разделения иттрий-эрбиевого концентрата, полученного при переработке различного минерального сырья
Другие по составу концентраты, полученные по схеме, представленной на рисунке 2.29, направляют на выделение индивидуальных РЗЭ и иттрия, предварительно осаждая их из растворов в виде карбонатов. Стадия осаждения карбонатов РЗЭ позволяет исключить из схемы межкаскадные упарки водных рафинатов или реэкстрактов.
Для получения чистых оксидов тяжелых РЗЭ в рассмотренной схеме используют противоточные экстракционные каскады с промывкой и орошением их промывной и рафинатной части.
Известны способы экстракционного разделения РЗЭ с использованием фосфиновых кислот в смеси с солями тетраалкиламмония, арилфосфоновыми или алкилфосфоновыми кислотами или эфирами.
Экстракционное разделение РЗЭ с использованием алкилфосфиновых кислот впервые было запатентовано французами Jean-Louis Sabot, Alain Rollat. В дальнейшем этот процесс был запатентован и в других странах.
Указанные экстрагенты используют в чистом виде или в виде растворов, содержащих от 5 до 100 об. % экстрагента, в алифатических или ароматических углеводородах, керосине, хлорированных углеводородах. Для повышения растворимости в органическую фазу могут быть добавлены спирты, эфиры фосфорной или фосфиновых кислот, фосфиноксиды или сульфоксиды в количестве от 3 до 20 об. %.
Экстракцию проводят из водных растворов с содержанием суммы РЗЭ в пересчете на оксиды от 20 до 500 г/л при кислотности водной фазы от 0, 01 до 3, 0 моль/л азотной кислоты. рН водной фазы не может быть ниже 3. Для корректировки рН используют гидроксид натрия или аммиачную воду. Экстракцию проводят в интервале температур от 10 °С до 50 °С, преимущественно при 20 °С - 40 °С. Экстракцию РЗЭ алкилфосфиновыми кислотами можно также проводить из водных растворов серной, соляной и хлорной кислот.
Разделение тяжелых РЗЭ из хлоридных растворов с использованием алкилфосфиновых кислот, их солей или их синергетных смесей с фосфиноксидами описано также в китайском патенте.
2.20.9 Методы переработки пирохлоровых и аналогичных по составу руд и концентратов, содержащих РЗМ
Минералов, содержащих ниобий и тантал, насчитывается более 100, но из них не более 50 являются собственно ниобиевыми и танталовыми, остальные содержат ниобий и тантал в виде примесей.
Наиболее важные минералы ниобия и тантала можно подразделить на две группы:
1) тантало-ниобаты - соли танталовой и ниобиевой кислот;
2) титано-тантало-ниобаты - сложные соли титановой, танталовой и ниобиевой кислот.
Основным минералом первой группы минералов является танталит-колумбит - изоморфный ряд метатанталатов, метаниобатов железа (II) и марганца (II) (Fe, Mn)[(Nb, Ta)O3]2. Соотношение тантала и ниобия изменяется в изоморфном ряду примерно от 5:1 до 1:5.
Важнейшим представителем второй группы минералов является лопарит и изоморфный ряд пирохлора-микролита. Лопарит - породообразующий магматический минерал. Химически это титанониобат редкоземельных, щелочных и щелочно-земельных элементов. Первые в нем представлены, в основном, цериевой подгруппой, а вторые - натрием и кальцием. Формула лопарита [Na, Ca, РЗЭ][Ti, Nb]O3. Ряд пирохлора-микролита - это большое число оксофторониобатов и оксофторотанталатов которые можно описать общей примерной формулой [Na, Ca][Nb, Ta]2O6F. Важнейшие в промышленном отношении - это пирохлор [Na, Ca, РЗЭ]Nb2O6F и микролит [Na, Ca, РЗЭ]Ta2O6F. Это два крайних минерала Nb - Ta ряда.
В схемах переработки пирохлоровых карбонатитовых руд предусматриваются как гравитационные, так и флотационные процессы. Гравитационные процессы применяются при обогащении крупно- или средневкрапленных руд.
Разработан сернокислотный способ разложения лопаритового концентрата и разделения редкоземельных элементов, титана, ниобия и тантала с использованием различий в растворимости двойных сульфатов этих элементов.
Основной недостаток сернокислотного способа переработки лопаритового концентрата - не обеспечивается достаточно четкое разделение РЗЭ, Ti и Nb, Ta. Более глубокое разделение указанных элементов при переработке титано-тантало-ниобиевых концентратов достигается при вскрытии их путем хлорирования.
Описан способ переработки ниобиевых руд Bayan Obo методом сульфатизирующего обжига при 250 °C с последующим выщелачиванием при 60 °C. В результате присутствующие ниобий и РЗЭ переходят в раствор.
К настоящему времени кроме сернокислотного разработаны несколько вариантов кислотной технологии для переработки лопаритовых и пирохлоровых концентратов: нитратно-сульфатный, нитратно-хлоридный, нитратно-фторидный, щелочно-сернокислотный. Наиболее привлекателен вариант щелочно-сернокислотной переработки лопарита, позволяющий с высокой селективностью отделить редкоземельные элементы и торий от титана, ниобия и тантала.
Щелочно-сернокислотная технология основана на предварительном разложении лопаритового концентрата в расплаве гидроксида натрия. В результате разложения редкие металлы, входящие в состав концентрата, превращаются в соединения, растворимые в разбавленных кислотах.
Процесс растворения концентратов в плавиковой кислоте с последующим экстракционным разделением ниобия и тантала в сульфатно-фторидной среде широко распространен в промышленности. В то же время ввиду дороговизны и недоступности плавиковой кислоты к бедному сырью этот способ неприменим.
2.20.10 Переработка монацитовых концентратов
Минералогия исходного монацитового сырья весьма сложна и непостоянна по соотношению минералов различных месторождений.
Монацит относится к группе фосфатных минералов (фосфат церия и редкоземельных элементов, РЗЭ), содержащих уран, торий и РЗЭ [15]. Состав: (Ce, La, Y, Th) PO4; содержание тория может достигать 12 %, соотношение La:Ce, как правило, близко к 1:1. Монацит является важнейшим источником тория и РЗЭ. Встречается в береговых и речных россыпях в ассоциации с цирконом, ильменитом и рутилом.
Разработка монацитовых россыпных месторождений отличается простотой. В результате обогащения и отделения от сопутствующих минералов методами грохочения и электромагнитной сепарации получают концентраты, содержащие 95 % - 98 % монацита [12]. Для доводки концентратов и отделения от них циркона применяют флотационный метод обогащения [13].
Гидрометаллургическая переработка монацитового концентрата с целью извлечения из него тория, урана и РЗЭ включает в себя следующие основные операции.
- вскрытие исходного концентрата с получением соединений тория, урана и РЗЭ, растворимых в минеральных кислотах;
- перевод тория, урана и РЗЭ в раствор;
- отделение тория, урана и РЗЭ от фосфора;
- разделение тория, урана и РЗЭ;
Как отдельную стадию переработки монацитового концентрата необходимо выделить
- дезактивацию промежуточных растворов от продуктов радиоактивного распада тория и урана.
Таким образом, усовершенствование технологии переработки монацитовых концентратов сводится либо к разработке новых процессов для осуществления всех перечисленных выше стадий, либо к их модернизации с учетом современных достижений технологии гидрометаллургии редких и радиоактивных металлов.
Наиболее известными методами вскрытия монацитового концентрата являются сульфатизация, сплавление с едким натром, нагревание с растворами едкого натра, спекание с кальцинированной содой, сплавление с фторсиликатами, хлорирование, восстановление фосфатов при высоких температурах и некоторые другие методы [15].
Промышленное значение приобрели три основных метода вскрытия монацитового концентрата:
- сульфатизация [9-28];
- щелочная обработка (сплавление или спекание с гидроксидом или карбонатом натрия, обработка щелочными растворами NaOH [29-32];
- хлорирование концентрата [18-24];
Сущность методов щелочного вскрытия монацитового концентрата заключается в сплавлении последнего с каустической или кальцинированной содой при 400 °С - 500 °С, с последующей обработкой плава водой для перевода фосфора в раствор и растворением гидратных осадков тория, урана и РЗЭ в минеральной кислоте. Фосфор из водного раствора выделяют кристаллизацией тринатрийфосфата [29].
Сплавление с NaOH было использовано также при переработке монацитового концентрата в работах [23-30]. Сплавление монацита с гидроокисями других щелочных металлов описано в патенте [31]. Первые исследования по сплавлению монацита с карбонатом натрия представлены в работах [12, 13], а подробно сплавление с карбонатом натрия изучено в работе [32].
Хлорирование монацитового концентрата является третьим по значимости методом, применяемым для его вскрытия.
Процесс хлорирования монацитового концентрата был описан в патентах Германии, Франции, Италии, Англии. Определенные положительные результаты были достигнуты австралийскими исследователями.
Перевод тория, урана и РЗЭ в раствор зависит от метода вскрытия исходного концентрата. При сульфатизации монацита продукты вскрытия обрабатывают водой с получением сернокислых растворов целевых компонентов.
Для отделения тория и РЗЭ от фосфора предложено [10] проводить предварительное выщелачивание серной кислотой для удаления фосфорной кислоты, а затем выщелачивание водой для перевода сульфатов РЗЭ и тория в раствор.
При щелочном разложении монацитового концентрата полученный плав выщелачивают водой для отделения фосфора в виде водорастворимого тринатрийфосфата. Нерастворимые в воде гидроокиси РЗЭ и тория затем подвергают растворению в минеральных кислотах. Для растворения полученных осадков может быть использована серная, соляная и азотная кислоты. При использовании серной кислоты не возникает проблем защиты оборудования от активного хлора, однако растворимость сульфатов тория и РЗЭ меньше, чем хлоридов или нитратов и объем растворов увеличивается ~ 1, 5-2 раза. Растворение в азотной кислоте сопровождается большими потерями тория за счет захвата нерастворимым осадком титана. Поэтому наиболее часто используют растворение в соляной кислоте.
Наиболее важной и трудной задачей переработки монацита является разделение урана, тория и РЗЭ с получением их чистых соединений и/или в случае РЗЭ их смешанных концентратов.
Для разделения урана, тория и РЗЭ используют два основных промышленно апробированных метода: осадительный (различные варианты гидролитического осаждения или осаждение труднорастворимых соединений) и экстракционный (разделение урана, тория и РЗЭ жидкостной экстракцией органическими реагентами). Для аналитической химии и в технологии переработки облученного ядерного горючего для разделения этих элементов используют также сорбционные методы разделения. Разделение индивидуальных РЗЭ методом ионного обмена чрезвычайно затруднено ввиду близкого сродства РЗЭ к ионитам.
На первом этапе переработки монацитового концентрата широко применяли осадительные методы разделения урана, тория и РЗЭ, среди которых необходимо выделить:
- осадительное разделение, обусловленное различием в гидролитических свойствах элементов;
- осадительное разделение, обусловленное различием в растворимости некоторых солей.
Торий обладает менее основными свойствами, чем РЗЭ, поэтому его первым выделяют из растворов минеральных кислот после их нейтрализации. При сернокислотном разложении монацита торий может быть выделен из раствора и отделен от РЗЭ нейтрализацией различными реагентами, аммиаком, гидроксидом натрия, оксидом магния, оксидами РЗЭ [10], а также значительным разбавлением водой [9, 13, 15].
Наибольшее распространение для разделения урана, тория и РЗЭ получил метод жидкостной экстракции, позволяющий получать продукты ядерной чистоты. Этот метод был использован для разделения названных элементов при переработке монацита еще в 1940-х гг. [11]. С тех пор этот метод получил большое развитие и промышленное применение. Достаточно сказать, что практически все промышленные и вновь синтезированные в лабораториях экстрагенты были изучены для целей разделения этих элементов. Однако наиболее промышленно значимым процессом остается разделения урана, тория и РЗЭ с применением в качестве экстрагента трибутилфосфата (ТБФ). Также важную роль в процессах переработки растворов выщелачивания монацита играют ди-2-этилгексилфосфорная кислота (Д2ЭГФК), амины различного строения и четвертичные аммониевые соли (ЧАС).
В настоящее время сернокислый способ вытесняется щелочным способом вскрытия. В настоящее время предпочтение отдается щелочному методу вскрытия. Большинство перерабатывающих монацит предприятий в мире работают по щелочному методу. Он имеет преимущество в том, что позволяет регенерировать фосфор из монацита в виде товарного трифосфата натрия.
Таким образом, рассмотренные способы переработки монацита позволяют сделать следующие заключения: целевыми компонентами, составляющими монацит и имеющими практическое применение в различных отраслях экономики, являются фосфор, уран, торий и РЗЭ.
Наиболее перспективными способами комплексной переработки монацита в промышленном масштабе с извлечением всех ценных компонентов: фосфора, урана, тория и РЗЭ остаются сульфатизация и щелочное разложение монацита. В то же время более перспективным при щелочном разложении монацита является карбонатная переработка продуктов разложения, а именно карбонатное выщелачивание тория и урана из смеси их гидратов с РЗЭ.
Основными проблемами переработки монацита в связи с его переменным составом остаются вскрытие исходного концентрата и разделение урана, тория и РЗЭ. Эти процессы нуждаются в дальнейшем совершенствовании, и именно в этом направлении развиваются исследования, проводимые в настоящее время в ведущих странах, занимающихся промышленной переработкой монацита.
Для процессов разделения урана, тория и РЗЭ методами, основанными на разнице в растворимости некоторых соединений перечисленных элементов, перспективным является исследование карбонатных или карбонатно-щелочных систем.
Для совершенствования процессов экстракционного извлечения урана, тория и РЗЭ из растворов выщелачивания сложного солевого состава наиболее перспективным остается применение синергетных смесей экстрагентов различных классов.
В общем случае существуют две альтернативные схемы переработки - на основе щелочного и сернокислотного вскрытия. Поэтому целесообразно в дальнейшем прорабатывать эти два варианта схем.
Одним из возможных направлений развития схемы сернокислотного вскрытия является проведение двухстадийной сульфатизации. За счет этого целесообразно попытаться достигнуть снижения рабочей температуры процесса с 200 °С - 250 °С до 150 °С - 180 °С (при которой скорость разложения кислоты, а соответственно, и интенсивность газовыделения, резко замедляется). Проведение процесса при 150 °С - 180 °С удобно еще и тем, что исключает образование сухого спека и позволяет организовать процесс перемешивания в реакторе.
При разработке щелочной схемы переработки монацитового концентрата наиболее целесообразно наличие следующих технологических операций:
- измельчение монацитового концентрата;
- обработка монацита концентрированным раствором гидроокиси натрия;
- репульпация полученной реакционной массы с отделением щелочного раствора фосфата натрия фильтрацией;
- растворение осадка гидроксидов в минеральной кислоте (соляной или по возможности азотной) с переводом тория, урана и РЗЭ в раствор;
- последовательное экстракционное выделение из раствора тория и урана в виде чистых соединений;
- выделение суммы РЗЭ в виде промежуточного труднорастворимого соединения или экстракционное выделение индивидуальных РЗЭ непосредственно из рафината экстракции урана;
- обязательная регенерация щелочи (полная или частичная), осуществляемая либо кристаллизацией тринатрийфосфата с возвратом маточника кристаллизации (раствор 40 % - 47 % NaOH) на операцию вскрытия монацита, либо обработкой щелочного раствора фосфата натрия известью с выделением отвального трикальцийфосфата и щелочного раствора;
- обязательна тщательная многостадийная очистка всех сбросных растворов, а также растворов, направляемых на выделение тринатрийфосфата или трикальцийфосфата от радиоактивных примесей: тория, радия, полония, радиоактивного свинца.
При разработке всех схем необходимо руководствоваться принципом максимального сокращения количества радиоактивных твердых отходов, поскольку захоронение их стоит дорого. Поэтому целесообразно максимально исключить осадительные операции, приводящие к "размазыванию" тория по твердым фазам, а также бороться за полноту выделения тория в виде компактных чистых соединений, удобных как для захоронения, так и для возможной реализации.
Сернокислотный способ переработки монацитового концентрата состоит в разложении концентрата серной кислотой с последующим выщелачиванием водой сульфатов РЗЭ и тория. Из раствора раздельно выделяют соединения тория и РЗЭ.
Разложение. Измельченный монацитовый концентрат (0, 15-0, 1 мм) разлагают концентрированной серной кислотой при температуре 180 °С - 200 °С (1, 5-2 т на 1 т концентрата, что в 2, 5-3 раза превышает теоретически необходимое количество) в течение 2-4 ч. Разложение ведут в стальных или чугунных аппаратах периодического действия с мешалкой или в барабанных вращающихся сульфатизаторах с автоматической подачей серной кислоты и концентрата и непрерывной выгрузкой получаемого продукта.
Основные реакции, протекающие при разложении:
2LnPO4+3H2SO4→(Ln)2(SO4)3+2H3PO4
(2.32)
Th3(PO4)4+6H2SO4→3Th(SO4)2+4H3PO4
(2.33)
После окончания разложения пастообразную реакционную массу выщелачивают в стальных освинцованных аппаратах холодной водой (10 л на 1 кг разлагаемого концентрата). Такое разбавление необходимо для обеспечения перевода в раствор сульфатов РЗЭ и тория.
Для выделения тория и РЗЭ из сульфатных растворов применяют способ ступенчатой нейтрализации растворов с осаждением фосфатов тория и РЗЭ, основанный на различии значений рН выделения фосфата тория и фосфатов лантаноидов: фосфат тория выделяется из сернокислых растворов при рН 1, в то время как фосфаты РЗЭ осаждаются при рН ~ 2, 3.
В основе щелочного способа лежит реакция взаимодействия монацита с раствором гидр оксида натрия:
LnPO4(тв)+3NaOH(раств)→Ln(OH)3(тв)+Na3PO4(раств)
(2.34)
Полное разложение монацита достигается при тонком измельчении концентрата (96, 5 класса - 0, 044 мм) с применением 45 %-го раствора гидроксида натрия в количестве 1, 5 кг NaOH на 1 кг монацита (что составляет - 300 % от теоретически необходимого количества) и обработке при температуре 140 °С в течение - 3 ч. Повышение температуры разложения до 200 °С приводит к практически полному вскрытию. Концентрат разлагают гидроксидом натрия в стальных реакторах.
Из фильтрата после осаждения тория раствором гидроксида натрия осаждают смесь гидроксидов РЗЭ. Высушенный осадок гидроксидов лантаноидов имеет следующий примерный состав, %: РЗЭ - 73; Th - 0, 05; U - 0, 005; Fe - 0, 002; Si - 0, 4; Р - 0, 1; Cl - 7, 9.
Преимущества щелочного метода перед методом разложения монацита серной кислотой - отделение уже на первой стадии фосфора от тория и лантаноидов с получением полезного побочного продукта - фосфата натрия. Однако сернокислотный метод экономичней и более универсален - применим к монацитовым концентратам различного происхождения.
Раздел 3. Существующие уровни потребления ресурсов и выбросов в окружающую среду
3.1 Энергоресурсы в производстве редких и редкоземельных металлов
Общие сведения
Энергетические ресурсы делятся на две главные категории - невозобновляемые и возобновляемые. К невозобновляемым энергетическим ресурсам относятся углеводородные топлива - уголь, нефть, природный газ, горючие сланцы, водород, ядерное топливо и т.д. Современная энергетика в основном базируется на горючих ископаемых - угле, нефти, природном газе. Энергию получают тремя путями: производя тепло сжиганием топлива, прямым преобразованием тепловой энергии и получением специального вида энергии - электроэнергии. По существу, электроэнергия является вторичным энергоресурсом и выполняет роль посредника между источниками и потребителями энергии. Главными недостатками получения энергии является возможное негативное воздействие на окружающую среду.
Потребности в энергоресурсах значительно отличаются для различных технологий получения редких и редкоземельных металлов. Они зависят от качества сырья и продукции, использования скрытого тепла или тепла отходящих газов и производства промежуточной продукции.
Основные экологические проблемы при производстве РМ и РЗМ связаны с загрязнением воздуха и воды и образованием опасных отходов. На предприятиях обычно устанавливают собственные водоочистные сооружения и используют замкнутые системы водооборота.
Для восполнения объемов оборотной воды, используемой в технологическом процессе, и потерь, связанных с испарением, могут собираться поверхностные стоки, а также дренажные стоки с полигонов захоронения отходов. Если позволяют объемы воды, выводимой из производственного процесса, может добавляться финальный этап кристаллизации, что позволяет полностью исключить сбросы загрязняющих веществ в принимающие водные объекты.
Многие виды отходов повторно используются в производстве, но основным видом, оказывающим значительное воздействие на окружающую среду, являются остаточные продукты выщелачивания. Для подотрасли характерны некоторые локальные аспекты, такие как шум и вибрация. В связи с тем, что ряд потоков твердых и жидких отходов являются опасными, существует значительный риск загрязнения почвы.
3.1.1 Выбросы в атмосферу
Получаемые в пирометаллургических процессах выбросы в атмосферу либо улавливаются в виде дымовых газов, либо отходят в виде неорганизованных выбросов в зависимости от возраста установки и используемой технологии. Выбросы дымовых газов обычно контролируются либо в непрерывном режиме, либо периодически, и по ним представляется соответствующая отчетность. Большее беспокойство вызывают неорганизованные выбросы, которые необходимо улавливать. Также улавливаются возгоны и испарения в гидрометаллургических циклах.
К основным типам выбросов в атмосферу от производства редких и редкоземельных относятся:
- диоксид серы (SO2), иные соединения серы и кислотные пары;
- оксиды азота (NOx) и иные его соединения;
- металлы и их соединения;
- хлор, HCl, CO;
- летучие органические соединения и ПХДД/Ф;
- пыли.
Иные загрязнители в подотрасли пренебрежимо малы, потому что они либо не присутствуют в производственном процессе, либо немедленно нейтрализуются (например, фтор или фториды), либо встречаются в низких концентрациях (органика). Определенные объемы загрязняющих веществ выбрасываются в составе пылей. Источники выбросов определяются используемыми технологиями (см. таблицу 3.1). К ним относятся:
- транспортировка, погрузка/разгрузка и подготовка сырья;
- обжиг/спекание и сернокислотная установка (большинство выбросов происходят во время незапланированных остановок);
- пирометаллургические операции: возгонка (спекание, обжиг), плавка и рафинирование;
- гидрометаллургические операции: выщелачивание, экстракция, сорбция, очистка и электролиз;
- механическая обработка: измельчение, размол и гранулирование;
- литье.
Другие загрязняющие вещества не имеют видимого значения для промышленности, потому что они не присутствуют в производственном процессе, сразу нейтрализуются (например, хлор или HCl) или потому, что их концентрация слишком мала (например, CO). Выбросы в значительной степени связаны с пылью.
Таблица 3.1 - Значимость возможных выбросов в атмосферу из РМ и РЗМ производств
|
Компонент |
Обжиг и иные пирометаллургические процессы |
Выщелачивание и очистка |
Электролиз |
Механическая обработка |
Литье и т.п. |
Серно-кислотная установка |
|
Оксиды и сульфаты серы |
** (1) |
* |
**(кислотные пары) |
* |
* |
*** |
|
Оксиды азота |
* (1) |
НП |
НП |
НП |
* |
* |
|
Пыль и металлы |
*** (1) |
* |
* |
*** |
** |
НП |
|
Хлор, хлориды, ЛОС |
* (1) |
* |
НП |
НП |
НП |
НП |
|
Примечание *** наиболее важные; ** - средней важности; * - наименее важные; НП = неприменимо. (1) - прямые выбросы с этапов обжига или плавки подвергаются обработке и/или передаются на этапы газоочистки и на сернокислотную установку; по-прежнему остаются значимыми остаточные выбросы диоксида серы или оксидов азота с сернокислотной установки. Для этих источников также достаточно значимы неорганизованные и неуловленные выбросы. | ||||||
Помимо технологических выбросов образуются неорганизованные выбросы. Основными источниками неорганизованных выбросов (см. таблицу 3.2) являются:
- пыль, образующаяся при хранении, погрузке/разгрузке и обработке концентратов;
- утечки из обжиговых и плавильных печей;
- аэрозоли и пыли, содержащиеся в отходящих газах от ванн выщелачивания и очистки;
- отходящие газы градирен для устройств выщелачивания, и очистки экстракционных установок;
- отходящие газы градирен процесса электролиза;
- прочие.
Таблица 3.2. - Средние выбросы в атмосферу от установок
|
Источник |
Объем, т/год |
Удельные выбросы, г/т РМ и РЗМ |
|
Пыль от хранения, погрузки/разгрузки и обработки концентратов и огарка |
< 0, 25 |
0, 25 - 0, 75 |
|
Аэрозоли и пыли из отходящих газов от ванн выщелачивания и очистки |
< 2 |
1 - 9 |
|
Отходящие газы градирен для устройств выщелачивания и очистки |
< 4 |
2 - 16 |
|
Отходящие газы градирен процесса электролиза (0, 8 т/год) |
< 5 |
3 - 20 |
Хотя неорганизованные выбросы трудно измерить и оценить, существуют некоторые успешно применяемые методы (см. раздел 5).
Общая информация о контроле выбросов загрязняющих веществ на российских предприятиях приведена в таблице 3.3.
Таблица 3.3 - Информация о нормировании выбросов загрязняющих веществ на российских предприятиях и в справочнике НДТ ЕС
|
Загрязняющее вещество (по [1316]) |
Наличие ЗВ в разрешении |
Справочник ЕС | |||
|
Предприятие 1 |
Предприятие 2 |
Контроль |
BAT-AEL |
Передел | |
|
Азота диоксид |
+ |
+ |
- |
- | |
|
Азота оксид |
+ |
+ |
- |
- | |
|
Взвешенные частицы PM10 |
- |
- |
- |
- | |
|
Взвешенные частицы PM2, 5 |
- |
- |
- |
- | |
|
Взвешенные вещества |
+ |
+ |
пыль |
пыль |
все переделы |
|
ПХДД/Ф |
- |
- |
+ |
+ |
плавка смешанных материалов, шлаковозгонная и вельц-печи |
|
Летучие органические соединения |
- |
- |
+ |
+ | |
|
Серы диоксид |
+ |
+ |
+ |
пирометаллургия | |
|
Углерода оксид |
+ |
+ |
- |
- |
- |
|
Металлы и их соединения |
+ |
+ |
+ |
+ |
выщелачивание, очистка, электролиз, экстракция |
|
+ |
- |
+ |
+ | ||
|
Хлориды газообразные в пересчете на HCl |
+ |
+ |
+ |
+ |
Обжиг и плавка смешанных материалов |
|
Фториды газообразные в пересчете на HF |
- |
- |
+ |
+ | |
|
Серная кислота |
нет данных |
нет данных |
+ |
+ |
выщелачивание, очистка, электролиз |
3.1.1.1 Оксиды азота
Этапы обжига и плавки являются потенциальными источниками образования оксидов азота (NOx). Оксиды азота (NOx) могут образовываться из соединений азота, присутствующих в концентратах, или из азота воздуха при высокой температуре. Получаемая серная кислота может поглощать большую часть NOx, что может негативно влиять на качество серной кислоты. Если после обжига наблюдается высокий уровень NOx, из экологических соображений и для поддержания качества продукта может потребоваться очистка газов, образующихся при обжиге. Другие печи, использующие кислородно-топливные горелки, могут также демонстрировать снижение NOx. Диапазон значений концентрации для всех процессов составляет от 10 до 120 мг/нм3.
3.1.1.2 Пыль и металлы
Вынос пыли от обжига или иных пирометаллургических процессов является потенциальным источником как организованных, так и неорганизованных выбросов. Пирометаллургические газы улавливаются и обрабатываются сначала в процессе газоочистки и затем при производстве серной кислоты. Пыль удаляется из газа и возвращается в технологический процесс.
Газы после разбрызгивающих или оросительных систем, используемых из мест выгрузки огарка и слива металла также являются потенциальными источниками выбросов. В этих точках с целью предотвращения неорганизованных выбросов необходимо осуществлять максимально возможное улавливание отходящих газов и их очистку. Диапазон значений выбросов пыли из данных источников составляет от менее 1 мг/нм3 до 15 мг/нм3.
Аспирация реакторов на этапах выщелачивания, экстракции и очистки может привести к выбросу аэрозолей, которые можно при необходимости (при наличии регулярного контроля) улавливать с помощью скрубберов или туманоуловителей/демистеров. Выбросы, содержащие опасные вещества (водород), контролируют в местах возможных выбросов. Эти выбросы постоянно улавливают и пропускают через устройства газоочистки, например, скрубберы и туманоуловители (в системах мокрой очистки) и рукавные фильтры (в системах сухой очистки).
В цехе электролиза образуются выбросы аэрозолей, которые могут содержать металлы в растворенном виде. Диапазон значений выбросов пыли и паров из данных источников составляет от 0, 2 до 1, 25 мг/нм3.
В то время как для контролируемых выбросов всегда установлены определенные источники и эти выбросы можно улавливать, подвергать очистке и возвращать в процесс, неорганизованные выбросы распространяются практически по всей производственной площадке. Основными источниками неорганизованных выбросов являются места хранения и транспортировки материалов, пыль, оседающая на транспортных средствах, проездах или на открытых участках рабочей зоны, где никаких мер по их предупреждению и сокращению обычно не предпринимается. Сокращение неорганизованных выбросов достигается благодаря реализации следующих мероприятий, как:
- обновление систем улавливания и фильтрации отходящих газов;
- сокращение времени остановка печи путем усовершенствования процессов футеровки (соответственно, сокращение времени запуска и остановка, когда за ограниченный отрезок времени происходят значительные выбросы);
- укрытие/размещение внутри строений мест доставки, хранения материала, установка там газоулавливающих систем;
- усовершенствование обращения с материалами (например, путем увлажнения сыпучих материалов до и во время погрузки) и сокращение частоты транспортных операций (например, путем использования более мощных погрузчиков);
- установка обязательной мойки автотранспортных средств (для внутрицехового и внешнего транспорта);
- укрепление покрытий площадок и подъездных путей и оптимизация их уборки.
3.1.2 Сбросы в водные объекты
При производстве редких и редкоземельных металлов основными загрязняющими веществами, содержащимися в стоках, являются металлы и их соединения, а также материалы в форме суспензии.
Другие вещества, попадающие в воду в значительных количествах - это хлориды, фториды и сульфаты.
Потоками сточных вод, в которых могут содержаться вышеуказанные вещества, являются:
- стоки с этапов обжига и газоочистки: мокрые скрубберы, мокрые электрофильтры, этап извлечения ртути;
- случайные утечки из различных гидрометаллургических процессов.
Другими потенциально загрязненными потоками сточных вод, которые собираются и повторно используются как промывочная вода при фильтрации (если позволяет их качество), являются:
- стоки, образующиеся при промывке анодов и катодов;
- уплотняющая вода из вакуумных насосов;
- общие операции, включая чистку оборудования, мытье полов и т.п.;
- слив из охлаждающих контуров (обычно следующих за некоторыми закрытыми циклами водооборота);
- ливневые и поверхностные стоки (прежде всего в зонах хранения) и стоки с крыш;
- вода, подаваемая с полигонов отходов и подземных полостей.
3.1.2.1 Стоки с водоочистных сооружений
В общем случае системы мокрой газоочистки эксплуатируются при замкнутом цикле оборота жидкости.
В мокрых скрубберах производится очистка кислых насыщенных SO2 растворов, образующихся в процессе обжига. В скруббере удаляются фториды, хлориды, следы ртути (если имеется) и селена и некоторые частицы, которые проходят механическую газоочистку. Во избежание накопления загрязняющих веществ некоторое количество жидкости непрерывно сливают из скруббера.
Металлы и их соединения и материалы в виде суспензии являются основными загрязнителями в воду.
Другими важными веществами, которые попадают в воду являются хлориды, фториды и сульфаты.
Возможными потоками сточных вод, которые содержат вышеупомянутые вещества являются:
- сточные воды от мокрых скрубберов;
- сточные воды от мокрых электрофильтров;
- уплотняющей воды из насосов;
- общие операции, в том числе очистки оборудования, полов и т.д.;
- выделения из контура охлаждающей воды;
- дождевые стоки с поверхности (в частности, мест хранения) и крыши.
В мокрых электрофильтрах также образуются кислые растворы. После фильтрации их перерабатывают. Некоторое количество жидкости сливают из данного контура, чтобы удалить накапливающиеся частицы загрязняющих веществ. Перед сливом данную жидкость обрабатывают и анализируют.
Продувочная жидкость в определенных количествах содержит взвешенные твердые частицы и растворенные соли. Продувочную жидкость перед сбросом очищают либо локально, либо в центральной водоочистной установке с целью удаления твердых и растворенных веществ. Место утилизации отделенных материалов зависит от источника происхождения сточных вод.
3.1.2.2 Сточные воды от газоочистки
Как правило, влажные газоочистные системы работают с рециркуляцией жидкости. Контролируемый отбор поддерживает количество взвешенных твердых частиц и растворенных солей в определенных заданных пределах. Абсорбера либо обрабатывают отдельно или в комплексе завода по обработке воды для удаления твердых и растворенных частиц перед выгрузкой. Назначение отделенного материала зависит от происхождения сточных вод. В мокрых электрофильтрах также будет образовываться кислая скрубберная жидкость. Она будет рециркулировать после фильтрации. Некоторую жидкость следует спустить из циркуляции, чтобы удалить накопленные загрязнения. Этот раствор обрабатывают и анализируют перед сбросом.
Таблица 3.4 - Источники отработанной воды и технологии их переработки
|
Наименование процесса |
Операция/источник |
Возможное использование/обработка |
|
Главный |
Дождевая вода с дорог, тротуаров, крыш, от мытья дорог, грузового автотранспорта и т.д. |
Установка обработки воды, затем удаление или рециркуляция |
|
Плавильные операции |
Вода охлаждения печей, машин и оборудования |
Рециркуляция |
|
Система очистки газа |
Конденсат от охлаждения газа и водного скруббера Конденсат от удаления ртути |
Удаление суспензии, остаток как исходный материал. После удаления ртути на очистку воды. Рециркуляция |
|
Завод серной кислоты |
Вода от охлаждения оборудования. Протечки |
Рециркуляция На установку обработки воды |
|
Склад сырья |
Поверхностная вода (дождевая) |
На установку обработки воды |
|
Общее оборудование |
Ремонт |
На установку обработки воды |
|
Установка очистки воды |
Обработка сточной воды |
Остаток для текущего использования/сброс |
3.1.2.3 Слив электролита и экстрагентных фаз
Электролит и экстракционные фазы можно сливать из ванн и с целью контроля накопления примесей, например магния, которые могут отрицательно влиять на работу электролитических ванн. Поток, обращающийся через электролитические ванны, относится к тому же закрытому водному контуру, к которому принадлежат этапы выщелачивания и очистки. Серная кислота, образующаяся во время электролиза, поступает в процесс выщелачивания, а оставшаяся часть жидкости очищается и подается на электролиз.
Стоки из цикла электролиза, выщелачивания, экстракции и очистки являются сильнокислыми и взвешенные твердые частицы в высокой концентрации. Объем стоков зависит от состава цинковых концентратов, используемых на этапе обжига. Элементы, которые склонны накапливаться в контуре, особенно магний, определяют объем сливаемой жидкости и необходимость ее очистки. Стоки из этой системы можно перерабатывать с целью извлечения Mg, Na, K, хлоридов и фторидов.
В таблице 3.5 представлены сводные данные по потенциальным источникам сточных вод и технологиям их переработки.
Таблица 3.5 - Потенциальные источники стоков и технологии их переработки
|
Этап техпроцесса |
Операция/источник |
Использование/переработка |
|
Общие операции |
Ливневые стоки с дорог, площадок, крыш, мокрая уборка дорог, мытье грузовиков и т.д. |
Повторное использование и/или переработка на водоочистной установке |
|
Обжиг/мокрая газоочистка |
Мокрая очистка газов из обжиговой печи |
Водоочистная установка |
|
Выщелачивание |
Общие операции, включая мокрую газоочистку |
Возврат на выщелачивание |
|
Экстракция |
Отстаивание, очистка |
Возврат на экстракцию |
|
Сорбция |
Отстаивание, очистка |
Возврат на сорбцию |
|
Очистка |
Общие операции |
Возврат на выщелачивание |
|
Электролиз |
Чистка ванн, анодов и катодов |
Возврат на выщелачивание |
|
Все технологические установки |
Техобслуживание |
Водоочистная установка |
|
Водоочистная установка |
Очистка стоков |
Для некоторых методов повторное применение/сброс |
3.1.3 Остаточные продукты технологических процессов
Производство металлов приводит к образованию ряда побочных продуктов, остаточных продуктов и отходов. Твердые остаточные продукты, образующиеся при реализации различных процессов и этапов очистки, могут использоваться по трем направлениям:
- повторное использование в данном процессе или на предыдущих процессах;
- переработка на последующих этапах с целью извлечения других металлов;
- окончательная утилизация после переработки, обеспечивающей безопасную утилизацию.
Значимыми являются следующие образующиеся твердые отходы:
- твердые остаточные продукты с высоким содержанием металлов, образующиеся в процессах выщелачивания, экстракции очистки и электролиза цинка. Эти продукты обычно повторно перерабатываются на соответствующем этапе технологического процесса.
Пыль или шлам от обработки газов используются в качестве сырья для производства других металлов, таких, как Ge, Ga, In или могут быть возвращены на переплавку или в контур выщелачивания для извлечения свинца и олова.
Селеновые остатки возникают из предварительной обработки ртутных или селеновых потоков от газовой очистки.
3.2. Существующие уровни выбросов и потребления в производстве тугоплавких редких металлов
Тугоплавкие металлы имеют высокую точку плавления и также характеризуются другими специфическими физико-химическими свойствами, такими как высокая плотность, инертность, коррозионная и кислотная стойкость. Например, цирконий имеет способность захватить медленные нейтроны, что дает этому металлу важную роль в строительстве атомных реакторов. Тугоплавкие металлы производятся и как металлический слиток (стержни) с использованием электронно-лучевых печей и как металлический порошок в качестве исходного материала для порошковой металлургии типа прессованием или спеканием.
В разделе 2 проведен обзор общих методов, используемых при производстве редких металлов. Тяжелые металлы переносятся в процесс в виде микроэлементов в первичное или вторичное сырье. Металлы с температурой кипения ниже температуры процесса будут выделяться в виде газов в виде пара металлов, которые частично конденсируются и окисляются, чтобы образовать часть пыли и дыма из камеры обжига. Пары металлов и отходящие газы, образующиеся при плавке или рафинировании тугоплавких металлов в электронно-лучевой печи, собираются вакуумной системой и затем конденсируются интенсивным охлаждением. Другим экологическим воздействием производства тугоплавких металлов, таких как тантал, цирконий и гафний, являются радиоактивные уровни некоторых сырьевых материалов. Также следует учитывать токсикологию некоторых тугоплавких металлов, например хрома, марганца и ванадия.
Производство тугоплавких металлов обычно требует высоких температур. Экологическое воздействие на воздух, воду и землю может быть классифицировано как следующее.
Потребление сырья и энергии.
Выбросы в атмосферу:
- выбросы пыли и дымов от плавки, производства твердосплавов и карбидов;
- другие выбросы в атмосферу - аммиак (NH3), кислотный дым (HCl), фтористый водород (HF);
- ЛОС и тяжелые металлы.
Шум и вибрация.
Твердые остатки, отходы и полупродукты:
- пыль, дымы и шлам;
- шлак.
Сброс воды:
- перелив воды из скрубберов;
- сточные воды от грануляции шлака и металла;
- утечка из циклов охлаждающей воды.
3.2.1. Потребление сырья и энергии
Имеющиеся данные о потреблении сырья и энергии для производства тугоплавких металлов представлены в виде удельных входных факторов на основе тонны производственного продукта в следующих таблицах.
Таблица 3.6 - Данные о потреблении сырья и энергии для производства тугоплавких металлов в качестве конкретных факторов воды
|
Руда и концентраты, кг/т |
н.о. |
|
Потребление энергии кВт/т |
1000-15 000 (АРТ* - производство) 3500-12 000 (производство карбида) 1500-2500 (цинк процесс) |
|
Газ, м3/т |
н.о. |
|
Вода, м3/т |
н.о. |
|
Порошок Al, кг/т |
n.r |
|
Порошок кальция, кг/т |
n.r |
|
Другие, кг/т |
н.о |
|
АРТ - паровольфрамат аммония н.о. - данные отсутствуют n.r. - не имеет значения в этом процессе производства | |
В таблице 3.7 представлена информация о данных процесса для плавки тугоплавких металлов в электронно-лучевой печи. В электронно-лучевых печах электронные пушки создают высокоэнергетические электроны, которые передают энергию на загрузку в печи, чтобы обеспечить ее плавление.
Таблица 3.7 - Показатели плавки тугоплавких металлов в электронно-лучевой печи
|
Металл |
Емкость тигля, т |
Мощность печи, МВт |
Производительность т/ч |
Потребление энергии кВт/т |
|
Ниобий |
0, 5-2 |
< 1, 2 |
0, 02-0, 4 |
6000-15 000 |
|
Тантал |
0, 5-2 |
< 1, 2 |
0, 02-0, 4 |
6000-15 000 |
|
Молибден |
0, 02-0, 1 |
< 5000 | ||
|
Вольфрам |
0, 02-0, 1 |
< 5000 | ||
|
Титан |
0, 2-0, 1 |
1000 |
Электронно-лучевые печи используются для плавления и/или очистки тугоплавких металлов, таких как ванадий, ниобий и тантал, металлов, таких как молибден и вольфрам, а также реактивных металлов, таких как цирконий и гафний.
3.2.2. Выбросы
3.2.2.1 Выбросы в атмосферу
Согласно необходимому сырью и используемым операциям, например, дробление, сушка, плавка, разделение металлов и шлаков, прокаливание, восстановление водорода, цементация и обработка продукта, одним из наиболее важных источников воздействия на окружающую среду являются выбросы пыли и дыма. Выбросы пыли как в трубу или в виде неорганизованных утечек являются важными, поскольку вредные металлические соединения, такие как марганец и кобальт, могут быть частью пыли. Выгрузка и хранение сырья может привести к образованию пыли, когда материал подается из различных источников, таких как барабаны, пластиковые пакеты или гибкие промежуточные контейнеры (FIBC), в бункеры. Пыль и дым, которые образуются при плавке или плавлении, например титана, или при производстве порошка, собираются напыльниками и переносятся в систему пылеулавливания (например, тканевым фильтром или влажным скруббером). Выбросы через трубу, как правило, контролируются постоянно или периодически на местах или консультантами за пределами площадки и сообщаются компетентным органам.
3.2.2.2 Выбросы в воду
Для производства тугоплавких металлов выбросы в воду очень зависят от процесса и системы борьбы с загрязнением, а также от типа используемой очистки сточных вод. Существуют различные системы водоподготовки и очистки сточных вод. На некоторых заводах используется центральная станция очистки сточных вод, в которой вода из разных производственных процессов, а также поверхностная сточная вода будут очищаться вместе. В других установках используется отдельная система очистки дождевой воды и специальных процессов обработки для различных потоков сточных вод. Основными загрязнителями воды являются взвешенные твердые вещества и соединения металлов. Сточные воды обрабатывают для удаления растворенных металлов и твердых веществ и рециркулируют или повторно используют в максимально возможной степени в процессе. Возможные потоки сточных вод:
- поверхностные стоки и дренажные воды;
- сточные воды из мокрых скрубберов;
- сточные воды из шлаков и металлического гранулирования;
- охлаждающая вода.
Загрязненную воду обычно ведут к загустителю или отстойному водоему для осаждения взвешенных твердых частиц.
Стадии осаждения часто используются для удаления металлических соединений из воды. Взвешенные твердые вещества в основном состоят из очень мелких частиц, поэтому может потребоваться добавить флокулянт для облегчения осаждения в загустителях. После обработки в загустителе или отстойном водоеме взвешенные твердые вещества обычно ниже 20 мг/л, что позволяет повторно использовать в скрубберах, в качестве охлаждающей воды или в качестве технологической воды для других целей.
3.2.2.3 Сводные данные о выбросах за счет производства тугоплавких металлов
Принимая во внимание различные процессы, используемые при производстве тугоплавких металлов, в следующей таблице дается обзор экологических данных по выбросам в атмосферу, воду и землю. Различие между использованием первичного и вторичного сырья заключается в том, что вторичные тугоплавкие металлы могут быть напрямую использованы в производстве стали и сплавов, в том числе феррониобий (ванадий) без затрат на основное их производство.
Таблица 3.8 - Выбросы при производстве вольфрама и его порошка
|
Тугоплавкие металлы |
Выбросы в атмосферу |
Сброс в воду |
Образование, рециклинг или повторная переработка отходов |
Примечание | ||||
|
Вольфрам |
мг/нм3 | |||||||
|
Первичные материалы |
Пыль |
Склад пересыпка |
руды |
и |
< 10 |
- Система охлаждения воды сконструирована как оборотная, и не контактирует с материалами. - Сбросная вода из скруббера контролируется на W и NH4 и при необходимости обрабатывается для снижения их концентрации |
- Пыль, уловленная в системе пылеулавливания, возвращается в процесс - Отходы от кристаллизации и сушки АРТ |
- Выбросы пыли обычно ниже представленных ELV (20 мг/нм3, так как порошок вольфрама ценный материал - Только доступные запыленности выбросов исключительно в диапазоне 1-3 мг/нм3 - Эти данные являются точными для производства вольфрамовых порошка и карбида - Аммиачные соединения - очень пахнущая субстанция, что может стать проблемой |
|
Пыль |
Кальцинация |
1-6 | ||||||
|
Пыль |
Восстановление водородом |
< 5 | ||||||
|
Пыль |
Пыление |
< 10 | ||||||
|
Пыль |
Продукт пересыпки |
< 10 | ||||||
|
Пыль |
Неорганизованные выбросы при погрузке и выгрузке. Витание мелких частиц | |||||||
|
NH3 |
Неорганизованные дымы распада аммиачных продуктов от кальцинации |
< 60 | ||||||
|
H2 |
Возможен риск воспламенения от водородных дымов | |||||||
|
Вторичные материалы |
Пыль |
Аналогично как для первичных материалов |
< 10 |
Система охлаждения воды сконструирована как оборотная, и не контактирует с материалами |
Кобальт обычно добавляют к твердой металлосодержащей пыли | |||
|
Zn |
Дымы цинка из процессов дистилляции |
n.a. | ||||||
|
Co |
Дымы кобальта из процессов дистилляции (СО-часть металлоскрапа) |
< 1 | ||||||
Таблица 3.9 - Выбросы при производстве ванадия и молибдена
|
Тугоплавкие металлы |
Выбросы в атмосферу |
Сброс в воду |
Образование, рециклинг или повторная переработка отходов |
Примечание | ||
|
Ванадий |
мг/нм3 | |||||
|
Первичные материалы |
Пыль |
От приготовления шихты, например, измельчение |
< 10 |
Нет доступной информации по образованию сбросной воды |
- Пыль, уловленная в системе пылеулавливания - Хвосты выщелачивания - Нет доступной информации по образованию отходов |
- Порошок кальция, используемый как восстановитель должен складироваться очень осторожно, так как имеется высокая пожароопасность |
|
Пыль |
От смешения солей щелочных металлов для обжига |
< 3 | ||||
|
Ca |
Остатки кальция могут выделяться при использовании порошка кальция как восстановителя |
n.a. | ||||
|
Al |
Остатки алюминия могут выделяться при использовании порошка кальция как восстановителя |
n.a. | ||||
|
Вторичные материалы |
Возможны различные выбросы от химических процессов в зависимости от исходных материалов и технологии. Данные недоступны. |
Нет доступной информации по образованию сбросной воды |
Нет доступной информации по образованию отходов | |||
|
Молибден |
мг/нм3 | |||||
|
Первичные материалы |
Пыль |
От перегрузки и приготовления шихты на складе, очищенные в мешочном фильтре |
< 10 |
Нет доступной информации по образованию сбросной воды |
Нет доступной информации по образованию отходов |
Согласно международной классификации, триоксид молибдена (MoO3) классифицируется и как вредный (ХN) |
|
Пыль |
Неорганизованные дымы распада аммиачных продуктов от кальцинации |
n.a. | ||||
|
Mo |
Дымы |
n.a. | ||||
|
Н2 |
Возможные риски возгорания от водородных дымов | |||||
|
Вторичные материалы |
Возможны различные выбросы от химических процессов в зависимости от исходных материалов и технологии. Данные недоступны. |
Нет доступной информации по образованию сбросной воды |
Нет доступной информации по образованию отходов | |||
Таблица 3.10 - Выбросы при производстве титана
|
Тугоплавкие металлы |
Выбросы в атмосферу |
Сброс в воду |
Образование, рециклинг или повторная переработка отходов |
Примечание | ||
|
Титан |
мг/нм3 | |||||
|
Первичные материалы |
Пыль |
< 10 |
- Жидкие стоки образовываются в мокром скруббере. Эти стоки могут содержать HCl, TTC и NaOH. - Жидкие стоки появляются единожды при использовании охлаждающей воды через основание или при продувке закрытой системы охлаждающей воды реакционных резервуаров и тиглей в плавильных печах - Моющая отходы вода - Кислотное выщелачивание и промывка - Очищающий сток хлорид титана |
- Пыль, собираемая в системе пылеулавливания - Пыль содержит титан, диоксид титана и оксид натрия - Некоторые плавильные печные тигли охлаждаются жидким натрий-калиевым сплавом (NaK) и небольшим количеством окисленных этих материалов, образующихся в виде шлама. Шлам взаимодействует с водой и образовавшаяся жидкость выгружается на завод по очистке стоков |
- Частицы титана состоят из относительно грубых частиц, которые быстро оседают и представляют пожароопасность. - Частая очистка обеспечивает отсутствие накопления, и пыль обычно продают как побочный продукт - ТТС (тетрахлорид титана) | |
|
Пыль |
Пыль, содержащая титановые включения, соль и возможно небольшие количества натрия образовывается при сливе расплава из реактора | |||||
|
Пыль |
Неорганические выбросы |
n.a. | ||||
|
Пары кислоты |
Пары соляной, плавиковой и азотной кислоты |
n.a. | ||||
|
TiOCl |
Пары гидрозолей ТТС в контакте с влажным воздухом образуют туман, содержащий диоксид титана, оксихлорид титана (TiOCl) | |||||
|
ТТК |
Аргон, используемый для создания инертной атмосферы в реакторе захватывает следы ТТС и натрия | |||||
|
TiO2 NaO |
Дымы от очистки крышек реакторов содержащие диоксид титана и оксид натрия | |||||
|
Cl |
< 5 | |||||
|
Вторичные материалы |
Выбросы сопоставимы с вышеприведенными выбросами в атмосферу |
Сточные воды аналогичны как и для первичных материалов |
Отходы как для первичных материалов | |||
Таблица 3.11 - Выбросы при производстве тантала
|
Тугоплавкие металлы |
Выбросы в атмосферу |
Сброс в воду |
Образование, рециклинг или повторная переработка отходов |
Примечание | ||
|
Тантал |
мг/нм3 | |||||
|
Первичные материалы |
Пыль |
Склад и перегрузка исходных материалов |
< 10 |
- Система охлаждающей воды для электронно-лучевой печи сконструирована как замкнутый цикл и не имеет контакта с материалами - Информация не доступна об образовании других стоков. |
- Пыль, собираемая в системе пылеулавливания рециркулирует в процесс - Нет доступной информации об образовании других отходов |
- Эти данные подходят для производства порошка тантала и его карбида. - Аммиачные соединения имеют сильный запах, который может создать проблему. - Некоторые материалы тантала имеют высокую радиоактивность - HF (фтористый водород) высокотоксичен и легко абсорбируется на поверхности контакта |
|
Пыль |
Кальцинация |
< 5 | ||||
|
Пыль |
Восстановление водородом |
< 5 | ||||
|
Пыль |
Карбонизация |
< 5 | ||||
|
Пыль |
Пыление |
< 10 | ||||
|
Пыль |
Продукты перегрузки (тонкая пыль) |
< 10 | ||||
|
Пыль |
Неорганизованные выбросы при загрузке и выгрузке печи. Витание мелких частиц |
n.a. | ||||
|
NH3 |
Трубные и/или неорганизованные аммиачные дымы от кальцинации |
< 60 | ||||
|
HF |
Водород-фтор |
< 1 | ||||
|
H2 |
Возможна пожароопасность от водородных дымов | |||||
|
Вторичные материалы |
Пыль |
Так же как и при первичных материалах |
- Система охлаждающей воды для электронно-лучевой печи сконструирована как замкнутый цикл и не имеет контакта с материалами. - Выщелачивание сплава тантала и промывка - Выщелачивание шлама и промывка - Кислотная мойка танталового порошка и промывка - Выщелачивание конденсатора и промывка |
- Пыль, собираемая в системе пылеулавливания рециркулирует в процесс - Нет доступной информации об образовании других отходов |
- HF (фтористый водород) высокотоксичен и легко абсорбируется на поверхности контакта - Склад перегрузка HF должны это учитывать - Кобальт обычно добавляют в твердый металлический порошок | |
|
H2 |
Возможна пожароопасность от водородных дымов | |||||
|
NH3 |
Трубные и/или неорганизованные аммиачные дымы от кальцинации |
< 60 | ||||
|
HF |
Водород-фтор |
< 1 | ||||
|
Следы металлов Co, MnO, Ni и Ag могут быть в скрапе тантала и могут быть удалены |
Ni < 1 Co < 1 | |||||
Таблица 3.12 - Выбросы при производстве ниобия
|
Тугоплавкие металлы |
Выбросы в атмосферу |
Сброс в воду |
Образование, рециклинг или повторная переработка отходов |
Примечание | ||
|
Ниобий |
мг/нм3 | |||||
|
Первичные материалы |
Пыль |
От всех источников очищенных в мешочном фильтре |
< 10 |
- Нет доступной информации об образовании стоков. |
- Пыль, собираемая в системе пылеулавливания - Шлак от восстановления в вакуумной печи - Известно, что пирохлор, который является значительным сырьевым ресурсом, может иметь высокий уровень радиоактивности и поэтому термический плавильный процесс потенциально экологически грязен с должным вниманием к удалению шлака. - Нет доступной информации об образовании отходов. |
- Ниобий и его соединения имеют очень низкую токсичность - HF (плавиковая кислота) очень токсична и может легко абсорбироваться на контактной поверхности - Следа и перегрузка HF должны выполняться расчетливо |
|
Пыль |
< 5 | |||||
|
Пыль |
От производства карбидов ниобия |
< 5 | ||||
|
Пыль |
Неорганизованные выбросы |
n.a. | ||||
|
VOC |
От жидкой экстракции |
n.a. | ||||
|
NF |
Выбросы NF |
< 1 | ||||
|
HCl |
< 10 | |||||
|
Al |
Алюминиевые остатки могут быть отделены просеиванием порошка для использования как восстановитель |
< 5 | ||||
|
Другие выбросы зависят от исходного сырья и процесса. Дополнительные сведения недоступны. | ||||||
|
Вторичные материалы |
Пыль |
От всех источников очищенных в мешочном фильтре |
< 10 |
- Нет доступной информации об образовании стоков. |
- Нет доступной информации об образовании отходов. |
- HF (фтористый водород) высокотоксичен и легко абсорбируется на поверхности контакта - Склад перегрузка HF должны это учитывать - Кобальт обычно добавляют в твердый металлический порошок |
|
HF |
Выбросы HF при копании |
< 1 | ||||
|
Другие выбросы зависят от исходного сырья и процесса. Дополнительные сведения недоступны. |
- HF (фтористый водород) высокотоксичен и легко абсорбируется на поверхности контакта - Склад перегрузка HF должны это учитывать | |||||
Таблица 3.13 - Выбросы при производстве рения, циркония и гафния
|
Тугоплавкие металлы |
Выбросы в атмосферу |
Сброс в воду |
Образование, рециклинг или повторная переработка отходов |
Примечание | ||
|
Рений |
мг/нм3 | |||||
|
Первичные материалы |
Пыль |
От всех источников очищенных в мешочном фильтре |
< 10 |
- Формирование стоков - Нет доступной информации об образовании стоков. |
- Пыль, собираемая в системе пылеулавливания |
- Рений и его соединения имеют очень низкий уровень токсичности |
|
Пыль |
< 5 | |||||
|
Пыль |
Неорганизованные выбросы |
n.a. | ||||
|
Другие выбросы зависят от исходного сырья и процесса. Дополнительные сведения недоступны. | ||||||
|
Вторичные материалы |
Выбросы зависят от использованного сырья и процесса. Данные недоступны. |
- Нет доступной информации об образовании стоков. |
- Нет доступной информации об образовании отходов. | |||
|
Цирконий и гафний |
мг/нм3 | |||||
|
Первичные материалы |
Пыль |
От всех источников очищенных в мешочном фильтре |
< 10 |
- Нет доступной информации об образовании стоков. |
- Zr и Hf также ассоциируются с радиоактивными металлами (уран, полоний и торий), которые могут быть в остатке - Кислотное выщелачивание при производстве металлического циркония и сплава - Бросовая кислота - Нет доступной информации об образовании отходов. |
- Получение циркония имеет значительный экологический риск, связанный с его остаточной радиоактивностью от радиоактивных металлов (уран, полоний и торий), находящихся в тяжелом песке, который используется как сырье. Уровень радиации не публикуется. |
|
Пыль |
Неорганизованные выбросы |
n.a. | ||||
|
F |
Неорганизованные выбросы |
n.a. | ||||
|
Радиоактивность от циркония |
n.a. | |||||
|
Хлорирующий процесс для части циркониевого концентрата и возгонки тетрахлорида циркония требует строгих ограничительных процедур. Другие выбросы зависят от исходного сырья и процесса. Дополнительные сведения недоступны. | ||||||
|
Вторичные материалы |
Выбросы зависят от использованного сырья и процесса. Данные недоступны |
- Нет доступной информации об образовании стоков. |
- Нет доступной информации об образовании стоков. | |||
Раздел 4. Определение наилучших доступных технологий
Термин "наилучшие доступные технологии" (НДТ) определен в Федеральном законе от 10 января 2002 г. N 7-ФЗ "Об охране окружающей среды" ([1]).
Под "технологией" в целом понимают совокупность методов обработки, изготовления, изменения состояния, свойств и формы сырья, материалов или полупродуктов, осуществляемых в процессе производства продукции. Здесь имеют в виду и собственно технологию, и способ, с помощью которого описываемый объект спроектирован, построен, эксплуатируется и выводится из эксплуатации. Это не только технология производства, но и различные технические и нетехнические методы повышения экологической результативности (экологический менеджмент, управленческие решения).
Под "доступной" понимают экономически целесообразную технологию, которая достигла уровня, позволяющего обеспечить ее внедрение в той отрасли цветной металлургии, которая отвечает за производство редких и редкоземельных металлов, с учетом экономической и технической обоснованности, затрат и преимуществ; при этом технология должна быть реализована хотя бы на двух предприятиях отрасли.
Под "наилучшей" понимают технологию, обеспечивающую охрану окружающей среды и ресурсосбережение (ресурсы здесь - сырье, вода, энергия) в максимальной мере.
Порядок определения технологии в качестве НДТ определен постановлением Правительства Российской Федерации от 23 декабря 2014 г. N 1458 "О порядке определения технологии в качестве наилучшей доступной технологии, а также разработки, актуализации и опубликования информационно-технических справочников по наилучшим доступным технологиям" ([5]), на основании которого Министерство промышленности и торговли Российской Федерации разработало Методические рекомендации по определению технологии в качестве наилучшей доступной технологии.
Согласно перечисленным документам при отнесении технологических процессов, технических способов и методов, оборудования к НДТ необходимо руководствоваться следующими критериями:
а) наименьший уровень негативного воздействия на окружающую среду в расчете на единицу времени или объем производимой продукции (товара), выполняемой работы, оказываемой услуги либо соответствие другим показателям воздействия на окружающую среду, предусмотренным международными договорами Российской Федерации; приоритетным, оказывающим наименьшие отрицательные воздействия на окружающую среду, рекомендовано считать воздействие от отходов, затем выбросов в воду и загрязнение почвы; воздействие от выбросов в воздух рекомендовано рассматривать как фактор, имеющий наибольший отрицательный эффект;
б) экономическая эффективность внедрения и эксплуатации; анализ экономической эффективности заключается в оценке затрат на внедрение и эксплуатацию технологии и выгоды от ее внедрения методом анализа затрат и выгод; в процессе оценки целесообразно разделять объекты на новые и действующие;
в) применение ресурсо- и энергосберегающих методов; г) период внедрения;
д) промышленное внедрение технологических процессов, оборудования, технических способов, методов на двух и более объектах в Российской Федерации, оказывающих негативное воздействие на окружающую среду.
В качестве источников информации о применяемых на практике технологиях, относящихся к НДТ, использованы сведения, полученные в результате анкетирования предприятий отрасли, результаты научно-исследовательских работ, а также информация, полученная в ходе консультаций с профильными экспертами.
Наилучшие доступные технологии и методы, а также - в необходимых случаях - соответствующие им технологические показатели (значения концентрации выбросов) определены технической рабочей группой применительно к следующим основным процесса производства редких и редкоземельных металлов:
1) процессы подготовки сырья и его опробование: сушка, дробление, смешение, спекание и кальцинация;
2) процесс спекания и кальцинация, выщелачивание;
3) методы разделения;
4) гидрометаллургические технологии.
Раздел 5. Наилучшие доступные технологии
5.1 Общие НДТ для производства редких и редкоземельных металлов
5.1.1 Системы экологического менеджмента (СЭМ)
НДТ 1. Повышение общей результативности природоохранной деятельности. Внедрение и поддержание системы экологического менеджмента (СЭМ), соответствующей требованиям ГОСТ Р ИСО 14001* или ISO 14001*, а также поддержание в качестве составляющей СЭМ системы управления эксплуатацией, ориентированной на поддержание эффективности систем пылеподавления и пылеулавливания и разработка плана мероприятий по неорганизованным выбросам, предусматривающего, в том числе инвентаризацию наиболее характерных источников неорганизованных выбросов.
──────────────────────────────
* Соответствие систем менеджмента указанным стандартам не означает ее обязательную сертификацию.
5.1.2 Энергоменеджмент
НДТ 2. Повышение эффективности использования энергии: использование комбинации двух или более методов, приведенных в таблице 5.1
Таблица 5.1
|
Метод/оборудование |
Применимость | |
|
а) |
Система управления энергоэффективностью (например, в соответствии с требованиями международного стандарта ISO 50001) |
Общеприменима |
|
б) |
Использование избыточного тепла (например, пара, горячей воды или горячего воздуха), образующегося при реализации основных процессов |
Применяется для пирометаллургических процессов |
|
в) |
Повышение температуры выщелачивающих растворов с использованием пара или горячей воды за счет избыточного тепла |
Применяется для гидрометаллургических процессов |
|
г) |
Подача на горелки воздуха, обогащенного кислородом, для уменьшения потребления энергии за счет автогенного процесса обжига и нагрева при спекании материалов |
Применяется для печей, в которых используется сырье, содержащее серу или углерод |
|
д) |
Низкотемпературная сушка концентратов и влажного сырья перед плавкой |
Общеприменима |
|
е) |
Теплоизоляция объектов, функционирующих при высоких температурах, например, трубопроводов пара и горячей воды | |
|
ж) |
Использование тепла, образующегося при производстве серной кислоты из диоксида серы, для предварительного нагрева газа, используемого на заводе серной кислоты, или для выработки пара и / или горячей воды |
Применяется для заводов по производству цветных металлов, включающих производство серной кислоты или жидкого SO2 |
|
з) |
Использование высокоэффективных электродвигателей, оборудованных частотными преобразователями, для таких устройств как, например, вентиляторы. |
Общеприменима |
|
и) |
Системы контроля, которые автоматически активируют включение местных отсосов пыли или отходящих газов только при возникновении выбросов |
5.1.3 Контроль технологических процессов и мониторинг эмиссий
НДТ 3. Обеспечение стабильности производственного процесса: внедрение системы автоматизированного контроля и использование комбинации двух или более методов, приведенных в таблице 5.2.
Таблица 5.2
|
Метод/оборудование |
Применимость | |
|
а) |
Проверка и сортировка исходных материалов в соответствии с требованиями, определяемыми используемым технологическим оборудованием и применяемыми методами сокращения загрязнения |
Общеприменимы |
|
б) |
Тщательное перемешивание различных материалов, входящих в состав шихты для достижения оптимальной эффективности переработки и сокращения выбросов и отходов | |
|
в) |
Системы взвешивания и дозирования шихты | |
|
г) |
Использование микропроцессорных устройств для контроля скорости подачи материала, ключевых технологических параметров, включая сигнализацию, условий сжигания и подачи дополнительного газа | |
|
д) |
Непрерывный инструментальный контроль температуры, давления в печи и подачи газа | |
|
е) |
Контроль критических параметров процессов, реализуемых на установках очистки воздуха, таких как температура газа, количество подаваемых реагентов, падение давления, ток и напряжение на электрофильтре, объем подачи и pH жидкости в мокром скруббере, состав подаваемого газа (например, O2, CO, ЛОС) | |
|
ж) |
Контроль содержания пыли в отходящих газах перед их подачей на завод серной кислоты | |
|
з) |
Непрерывный инструментальный контроль уровня вибрации для обнаружения завалов и возможных отказов оборудования |
Применяется для заводов по производству цветных металлов, включающих производство серной кислоты или жидкого SO2 |
|
и) |
Непрерывный инструментальный контроль силы тока, напряжения и температуры электрических контактов |
Общеприменим |
|
к) |
Контроль и регулирование температуры для предотвращения образования выбросов металлов и оксидов металлов из-за перегрева |
Применяются для процессов электролиза |
|
л) |
Использование микропроцессорных устройств для контроля подачи реагентов и работы очистного оборудования, включая непрерывный инструментальный контроль температуры, мутности, рН, электропроводности и объемов стока |
Применяются для установок очистки сточных вод |
5.1.4 Общий подход к предотвращению неорганизованных эмиссий
НДТ 4. Уменьшение неорганизованных выбросов, образующихся при хранении сырья, заключается в использовании комбинации двух или более методов, приведенных в таблице 5.3.
Таблица 5.3
|
Метод/оборудование |
Применимость | |
|
а) |
Использование закрытых помещений или емкостей/бункеров |
Применяется для пылящих материалов, таких как концентраты, флюсы и пульпа |
|
б) |
Сооружение укрытий над площадками хранения |
Применяется для непылящих материалов, таких как концентраты, флюсы, твердое топливо, крупнотоннажные насыпные материалы и кокс, а также вторичного сырья, содержащего растворимые в воде органические соединения |
|
в) |
Герметичная упаковка |
Применяется для хранения пылящих материалов, а также вторичного сырья, содержащего растворимые в воде органические соединения |
|
г) |
Сооружение укрытий над пролетами |
Применяется при гранулировании/ агломерации материала |
|
д) |
Размещение устройств для улавливания пыли/газов в точках загрузки и перегрузки |
Применяется в местах складирования пылящих материалов |
|
е) |
Использование для сооружения емкостей строительных материалов, устойчивых к загружаемым материалам |
Общеприменимо |
|
ж) |
Применение надежных систем обнаружения утечек и индикации уровня заполнения емкостей с подачей сигналов для предотвращения их переполнения |
Общеприменимо |
|
з) |
Хранение концентрированной серной кислоты и других агрессивных материалов в емкостях с двойными стенками или в емкостях, размещенных внутри устойчивого к воздействию агрессивных сред обвалования двойной вместимости |
Общеприменимо |
|
и) |
Проектирование площадок для хранения таким образом, чтобы любые утечки из емкостей и систем доставки удерживались внутри обвалования, способного вместить объем жидкости, равный по крайней мере объему наибольшей емкости, размещенной внутри обвалования. Площадка для хранения должна быть обвалована и иметь покрытие, не подверженное воздействию хранящегося агрессивного материала |
Общеприменимо |
|
к) |
Сбор и обработка эмиссий, образующихся при хранении, с помощью систем, предназначенных для обращения с химическими веществами, которые подлежат хранению. Вода, использованная для смыва пыли, также должна собираться и очищаться перед сбросом |
Общеприменимо при хранении газов. При хранении жидкостей любые утечки должны собираться и обрабатываться |
|
л) |
Регулярная уборка и, при необходимости, увлажнение площадки хранения |
Общеприменимы |
|
м) |
Хранение материалов там, где это возможно, в одной куче вместо нескольких |
Применяется при складировании на открытом воздухе |
|
н) |
Использование нефтеловушек и песколовушек в дренаже открытых площадок хранения. Использование для хранения материалов, которые могут содержать нефтепродукты (например, замасленной стружки), бетонированных площадок с бортами или иными удерживающими устройствами |
Применяется при складировании на открытом воздухе |
НДТ 5. Уменьшение неорганизованных эмиссий, образующихся при обработке и транспортировке сырья. Использование комбинации двух или более методов, приведенных в таблице 5.4.
Таблица 5.4
|
Метод/оборудование |
Применимость | |
|
а) |
Сооружение закрытых конвейеров или пневматических систем для транспортировки и обработки пылящих концентратов, флюсов и пульпы |
Общеприменимо |
|
б) |
Сооружение конвейеров для непылящих твердых материалов под навесами | |
|
в) |
Установка устройств для сбора пыли в пунктах доставки, вентиляционных отверстиях, пневматических транспортных системах и точках перегрузки на конвейерах передачи и их подключение к системе фильтрации |
Применяется при использовании пылящих материалов |
|
г) |
Использование для обращения с измельченными или водорастворимыми материалами закрытых мешков или бочек |
Общеприменимы |
|
д) |
Использование специальных контейнеров для обработки уложенных на поддонах материалов | |
|
е) |
Разбрызгивание воды для увлажнения материалов в местах их обработки | |
|
ж) |
Использование максимально коротких маршрутов транспортировки | |
|
з) |
Уменьшение высоты падения с конвейерных лент, механических лопат или захватов | |
|
и) |
Регулировка скорости открытых ленточных конвейеров (< 3, 5 м/с) |
Применяется при использовании открытых ленточных конвейеров |
|
к) |
Минимизация скорости спуска или свободного падения материалов с высоты |
Общеприменимы |
|
л) |
Размещение передающих конвейеров и трубопроводов на безопасных открытых площадках выше уровня земной поверхности с целью оперативного обнаружения утечек и предупреждения повреждений транспортными средствами и другим оборудованием. Если для перемещения неопасных материалов используются подземные трубопроводы, местоположение их трасс должно быть документально зафиксировано и отмечено на местности соответствующими предупреждающими знаками; должны применяться системы безопасного ведения земляных работ | |
|
м) |
Мойка колес и шасси транспортных средств, используемых для доставки или обработки пылящих материалов |
Не применяется в условиях, которые могут привести к обледенению |
|
н) |
Проведение плановых кампаний по уборке дорог |
Общеприменимы |
|
о) |
Разделение несовместимых материалов (например, окислителей и органических материалов) | |
|
п) |
Минимизация материальных потоков между процессами |
НДТ 6. Предупреждение или сокращение неорганизованные выбросов: оптимизация параметров эффективности улавливания и очистки отходящих газов и использование комбинации двух или более методов, приведенных в таблице 5.5.
Таблица 5.5
|
Метод/оборудование |
Применимость | |
|
а) |
Использование закрытых печей, оснащенных системами пылеулавливания, или оснащение печей и другого технологического оборудования вытяжными системами |
Применение может быть ограничено соображениями безопасности (например, типом/конструкцией печи, наличием угрозы взрыва) |
|
б) |
Оснащение печей и конверторов вторичными системами отведения газов в точках загрузки и выгрузки |
Применение может быть ограничено соображениями безопасности (например, типом/конструкцией печи, наличием угрозы взрыва) |
|
в) |
Сбор пыли и испарений в местах перегрузки пылящих материалов (например, в точках загрузки и выгрузки печей, на литейных лотках) |
Общеприменим |
|
г) |
Оптимизация конструкции и технологии эксплуатации вытяжных устройств и газоходов с целью улавливания газов, возникающих при загрузке шихты и отходящих от разогретого металла; выдача и перемещение расплавов сульфидов или шлаков по закрытым желобам |
Для существующих заводов применение может быть ограничено имеющимся пространством и сложившейся планировкой размещения объектов в цехах |
|
д) |
Сооружение укрытий печей/реакторов, например с помощью местной аспирации, для улавливания выбросов при загрузочных операциях и выдаче расплавов |
Для существующих заводов применение может быть ограничено имеющимся пространством и сложившейся планировкой размещения объектов в цехах |
|
е) |
Использование систем, позволяющих подавать сырье небольшими порциями |
Применяется только для полузакрытых печей |
|
ж) |
Очистка улавливаемых отходящих газов с помощью систем, сконструированных с учетом особенностей их состава |
Общеприменима |
5.1.5 Сокращение выбросов NOх
НДТ 7. Предотвращение выбросов NO, NO2 от пирометаллургических процессов: использование одного из методов, приведенных в таблице 5.6.
Таблица 5.6
|
Метод/оборудование |
Применимость | |
|
а) |
Горелки с низкими выбросами NOX |
Общеприменимы |
|
б) |
Кислородно-топливные горелки |
Общеприменимы |
Таблица 5.7 - Технологический показатель: выбросы NO, NO2 от пирометаллургических процессов
|
Параметр |
Единица измерений |
Средний уровень выбросов для НДТ* |
|
NO, NO2 (суммарно) |
мг/нм3 |
≤ 60 |
|
* Среднесуточное значение или среднее значение за период пробоотбора | ||
5.1.6 Отведение сточных вод
НДТ 8. Предотвращение образования сточных вод: использование одного из или комбинации методов, приведенных в таблице 5.8.
Таблица 5.8
|
Метод/оборудование |
Применимость | |
|
а) |
Измерение объемов используемой и сбрасываемой воды |
Общеприменимо |
|
б) |
Возврат в технологический процесс воды, использованной для промывки (в том числе промывки анодов и катодов), и разлитой воды |
Общеприменим |
|
в) |
Повторное использование слабых кислот из стоков, образующихся в мокрых электростатических фильтрах и мокрых скрубберах |
Применяется в зависимости от содержания в сточных водах металлов и твердых веществ |
|
г) |
Использование очищенных поверхностных стоков |
Общеприменимо |
|
д) |
Использование системы охлаждения с замкнутым контуром |
Применение может быть ограничено технологическими соображениями, когда требуется низкая температура |
|
е) |
Повторное использование воды, проходящей через очистные сооружения |
Применяется в зависимости от содержания солей |
НДТ 9. Предотвращение загрязнения незагрязненных вод и сокращение сбросов загрязняющих веществ в водные объекты: отделение незагрязненных стоков от других сточных вод, которые требуют очистки.
Применимость НДТ 9: отделение незагрязненных ливневых стоков может быть неприменимо на существующих установках.
НДТ 10. Сокращение сбросов загрязняющих веществ со сточными водами: очистка сточных вод, образующихся при производстве редких и редкоземельных металлов с целью удаления металлов и сульфатов с использованием одного из или комбинации методов, приведенных в таблице 5.9.
Таблица 5.9
|
Метод/оборудование |
Применимость | |
|
а) |
Химическое осаждение |
Общеприменимы |
|
б) |
Седиментация | |
|
в) |
Фильтрация |
Таблица 5.10 - Технологические показатели: средний уровень концентраций загрязняющих веществ в прямых сбросах, образующихся при производстве редких и редкоземельных металлов, в принимающие водные объекты
|
Параметр |
Единица измерения |
Концентрация загрязняющего вещества* |
|
Алюминий |
мг/л |
0, 3 |
|
Никель |
мг/л |
0, 3 |
|
Диоксид титана |
мг/л |
0, 1 |
|
Цинк |
мг/л |
0, 08 |
|
* В случае замкнутого цикла водооборота показатели не применяются. | ||
5.2 НДТ для отдельных этапов производства редких и редкоземельных металлов
5.2.1 Выбросы в воздух
5.2.1.1 Неорганизованные выбросы
НДТ 11. Предотвращение или уменьшение неорганизованных выбросов от подготовки (например, измерения, смешения, дробления) первичных материалов: использование одного из или комбинации методов, приведенных в таблице 5.11.
Таблица 5.11
|
Метод/оборудование |
Применимость | |
|
а) |
Закрываемые конвейерная или пневматическая системы передачи для пылящего материала |
Общеприменимы |
|
б) |
Закрываемое оборудование. При использовании пыльных материалов выбросы собирают и направляют в систему подавления выбросов |
Применяется только для подачи смесей, подготовленных с использованием системы, включающей бункер с дозатором или взвешиванием |
|
в) |
Смешение сырья осуществляется в закрытом здании |
Применяется только для пылящих материалов. Для существующих установок это может быть затруднено из-за недостаточного пространства |
НДТ 12. Предотвращение или уменьшение неорганизованных выбросов от предварительной обработки материалов (такой как сушка, демонтаж, спекание, брикетирование, грануляция, просеивание и классификация) при производстве редких и редкоземельных элементов: использование одного из или комбинации или комбинации методов, приведенных в таблице 5.12.
Таблица 5.12
|
а) |
Закрытая конвейерная или пневматическая системы передачи для пылящего материала |
|
б) |
Закрытое оборудование. При использовании пылящих материалов выбросы собирают и направляют в систему подавления выбросов |
НДТ 13. Предотвращение или уменьшение неорганизованных выбросов от загрузки сырья редких и редкоземельных металлов до получения огарка или спека: использование одного или комбинации методов, приведенных в таблице 5.13.
Таблица 5.13
|
Метод/оборудование |
Применимость | |
|
а) |
Герметичная система загрузки, такая как двойной колокол, закрытые конвейеры и питатель, оснащенные системой отвода газа |
Общеприменима |
|
б) |
Изолированные или отгороженные печи с уплотнением подачи сырья |
Уплотнительная дверь применима только для процессов с прерывистой подачей и выходом |
|
в) |
Эксплуатация печи и газовые маршруты под разряжением и с достаточной скоростью отвода газа для предотвращения повышения давления |
Общеприменима |
|
г) |
Уплотнение сочленений с газоходом и леткой при загрузке и выпуске металла |
Общеприменимо |
|
д) |
Закрытое здание |
Общеприменимо |
|
е) |
Полная герметизация с системой отвода газа |
Применяется для новых заводов. При реконструкции действующих установок применение может быть затруднено из-за потребности в помещениях |
|
ж) |
Поддержание герметичности печи |
Общеприменимо |
|
з) |
Поддержание температуры в печи на минимально необходимом уровне |
Общеприменима |
|
и) |
Система газоотвода для загрузки и сочленения с системой фильтрации |
Общеприменимо |
|
к) |
Предварительная подготовка пылевидного сырья, например гранулирование |
Применяется только когда процесс и печь может использовать гранулированное сырье |
|
л) |
Установка домика (укрытия для ковшей при выпуске) |
Общеприменима |
5.2.1.2 Организованные выбросы пыли
НДТ 14. Сокращение выбросов в воздух пыли (взвешенных веществ) и металлов от подготовки сырья (например, прием, обработка, хранение, измерение, перемешивание, смешивание, сушка, измельчение, просеивание) в производстве редких и редкоземельных элементов: использование рукавного фильтра.
Таблица 5.14 - Технологический показатель НДТ 14: выбросы взвешенных веществ от процессов подготовки сырья
|
Параметр |
Единица измерений |
Средний уровень выбросов для НДТ* |
|
Пыль |
мг/нм3 |
40 |
|
* Среднесуточное значение или среднее значение за период пробоотбора. | ||
НДТ 15. Для сокращения выбросов в воздух пыли (взвешенных веществ) и окислов металлов, за исключением тех, которые направляются на производство серной кислоты или жидкого SO2 от загрузки обжига, плавки и получения огарков и спеков в производстве редких и редкоземельных металлов, НДТ предусматривает использование рукавного фильтра.
Таблица 5.15 - Технологические показатели НДТ 15: выбросы от процессов загрузки, плавки и выпуска металла
|
Параметр |
Единица измерений |
Средний уровень выбросов для НДТ* |
|
NO, NO (суммарно) |
мг/нм3 |
60 |
|
Аммиак |
мг/нм3 |
100 |
|
Пыль |
мг/нм3 |
50 |
|
Хлор |
мг/нм3 |
30 |
|
* Среднесуточное значение или среднее значение за период пробоотбора. | ||
5.2.1.3 Выбросы органических соединений
НДТ 16. Уменьшение выбросов органических соединений в атмосферу из сушки исходного материала и процесса обжига, спекания и плавки при производстве металлопродуктов редких и редкоземельных: использование одного из или комбинации методов, приведенных в таблице 5.16.
Таблица 5.16
|
Метод/оборудование |
Применимость | |
|
а) |
Выбирать и подавать сырье в соответствии с печью и используемыми методами подавления выбросов |
Общеприменимо |
|
б) |
Оптимизировать условия сгорания для уменьшения выбросов органических соединений |
Общеприменимо |
НДТ 17. Сокращение выбросов ПХДД/Ф и ЛОС в воздухе при комбинированных технологиях переработки нетрадиционного сырья редких и редкоземельных элементов использует один или комбинацию методов, приведенных в таблице 5.17.
Таблица 5.17
|
Метод/оборудование |
Применимость | |
|
а) |
Выбор и подача сырья в соответствии с печью, использующей методы подавления выбросов |
Общеприменимы |
|
б) |
Системы загрузки сырья небольшими порциями |
Применяется только для полузакрытых печей |
|
в) |
Внутренняя система горелки |
Применяется только для печей |
|
г) |
Фор-камера или рекуператор |
Общеприменимы |
|
д) |
Избегать систем дымоотсоса с высокой запыленностью поверхности при температуре > 250 °C |
Общеприменимо |
|
е) |
Использование эффективной системы сбора пыли |
Общеприменимо |
|
ж) |
Использование инжекции кислорода в верхней зоне печи |
Общеприменимо |
|
з) |
Оптимизировать условия сгорания для подавления выбросов органических соединений |
Общеприменимо |
5.2.2 Почва и защита подземных вод
НДТ 18. Предотвращение загрязнения почвы и грунтовых вод, дробления, просеивания и операций классификации: использование кислотостойкой поверхности пола и системы для сбора кислотных проливов.
5.2.3 Образование и очистка сточных вод
НДТ 19. Предотвращение образования сточных вод при щелочном выщелачивании: повторное использования воды от кристаллизации раствора соли щелочного металла.
5.2.4 Отходы
НДТ 20. Уменьшение количества отходов, направляемых на захоронение от производства редких и редкоземельных металлов: организация операций на месте, с целью упрощения повторного использования остатков или, если это невозможно, их направление на рециклинг с использованием одного из или комбинации методов, приведенных в таблице 5.18.
Таблица 5.18
|
Метод/оборудование |
Применимость | |
|
а) |
Вторичное использование пыли из системы удаления пыли в процессе производства обжига, спекания РМ и РЗМ |
Общеприменимо |
|
б) |
Восстановление Se и Te от влажной или сухой очистки газов из пыли/шлама |
Применимость может быть ограничена количеством присутствующей ртути |
|
в) |
Восстановление металлов из шлама очистки сточных вод |
Прямая переплавка шлама от установки очистки сточных вод может быть ограничена наличием нежелательных в плавке элементов, таких как As, Cd и Tl |
НДТ 21. Повторное использование или восстановление серной кислоты, полученной от процесса обжига сульфидных концентратов: использование одного из или комбинации методов, приведенных в таблице 5.19.
Таблица 5.19
|
Метод/оборудование |
Применимость | |
|
а) |
Повторное использование в качестве сырья на химическом заводе |
Применимость может быть ограничена в зависимости от наличия местного химического завода |
|
б) |
Производство гипса |
Используется, только если примеси, присутствующие в регенерации кислоты, не оказывают влияния на качество гипса, или гипс более низкого качества может быть использован для других целей, таких как составляющая флюса |
|
в) |
Производство сульфата натрия |
Применяется только для процесса выщелачивания |
НДТ 22. Уменьшение количества отходов производства редких и редкоземельных металлов, отправляемых на захоронение: организация операций на месте с целью облегчения процесса повторного использования остаточных продуктов или, если это невозможно, направление их на рециклинг с применением одного из или комбинации методов, приведенных в таблице 5.20.
Таблица 5.20
|
Метод/оборудование | |
|
а) |
Переработка остатков и отходов в специальных установках для получения материалов |
|
б) |
Обработка остатков и отходов для использования в других областях |
5.2.5 Выбросы в атмосферный воздух
5.2.5.1 Неорганизованные выбросы
НДТ 23. Уменьшение неорганизованных выбросов пыли, образующихся в процессе подготовки сырья для обжиговой печи и при загрузке в нее этого сырья: использование мокрой шихты.
НДТ 24. Уменьшение неорганизованных выбросов пыли, образующихся при обработке огарка: выполнение операций при пониженном давлении.
НДТ 25. Уменьшение неорганизованных выбросов, образующихся при промывке, разделении твердых и жидких фракций и очистке, заключается в использовании одного из или комбинации методов, приведенных в таблице 5.21.
Таблица 5.21
|
Метод/оборудование |
Применимость | |
|
а) |
Укрытие емкости крышкой |
Общеприменимо |
|
б) |
Укрытие впускных и выпускных лотков для технологической жидкости |
Общеприменимо |
|
в) |
Соединение емкостей с механической вытяжной централизованной системой газоочистки или с локальными системами для одной емкости |
Общеприменимо |
НДТ 26. Уменьшение неорганизованных выбросов паров, образующихся при электроизвлечении: использование в электролизерах добавок, особенно пенообразующих агентов.
5.2.5.2 Выбросы аэрозолей и паров
НДТ 27. Уменьшение выбросов аэрозоля металлосоединений, образующихся при производстве оксидов РЗМ: использование одного из методов, приведенных в таблице 5.22.
Таблица 5.22
|
Метод/оборудование |
Применимость | |
|
а) |
Мокрый скруббер |
Общеприменим |
|
б) |
Центробежная система |
Общеприменим |
Таблица 5.23 - Технологический показатель НДТ 30. Выбросы металлосодержащей пыли, образующиеся при выщелачивании, очистке и электролизе
|
Параметр |
Единица измерения |
Средний уровень выбросов для НДТ* |
|
Пыль |
мг/нм3 |
40 |
|
* Среднесуточное значение или среднее значение за период пробоотбора. | ||
5.2.5.3 Охрана почвы и подземных вод
НДТ 28. Предотвращение загрязнения почвы и грунтовых вод: использование одного из или комбинации методов, приведенных в таблице 5.24.
Таблица 5.24
|
Метод/оборудование | |
|
а) |
Водонепроницаемая обвалованная площадка для емкостей, используемых при выщелачивании |
|
б) |
Водонепроницаемая обвалованная площадка для емкостей, используемых при очистке |
|
в) |
Система вторичного защитного обвалования цехов электролиза |
НДТ 29. Сокращение потребления воды и предотвращения образования сточных вод заключается в использовании одного из или комбинации методов, приведенных в таблице 5.25.
Таблица 5.25
|
Метод/оборудование | |
|
а) |
Возврат стоков от процесса очистки/утечек жидкостей с обжиговой печи, сернокислотной установки, электролизеров и литейной на стадию выщелачивания |
|
б) |
Возврат стоков от процесса очистки/утечек жидкостей с этапов выщелачивания и очистки, от промывки фильтрационного кека и влажной газоочистки на этапы выщелачивания и/или очистки |
5.2.5.4 Отходы
НДТ 30. Сокращение объемов образования отходов, предназначенных для конечной утилизации: организация операций на промышленном объекте таким образом, чтобы содействовать повторному использованию остаточных продуктов или, если это невозможно, их вторичной переработке с использованием одного или комбинации методов, приведенных в таблице 5.26.
Таблица 5.26
|
Метод/оборудование |
Применимость | |
|
а) |
Повторное использование пыли, образующейся при хранении и обработке концентрата и на иных стадиях технологического процесса (включая подачу концентрата) |
Общеприменимо |
НДТ 31. Обработка отходов выщелачивания с целью обеспечения их пригодности для конечной утилизации: их пирометаллургическая обработка в вельц-печи.
Применимость: применимо только для отходов выщелачивания нейтральным растворителем с незначительным содержанием феррита цинка и/или драгоценных металлов в невысокой концентрации.
НДТ 32. Уменьшение выбросов пыли и металлов, образующихся при гранулировании и переработке пылевидного сырья, заключается в использовании рукавного фильтра.
Таблица 5.27 - Технологический показатель НДТ 32. Выбросы металлосодержащей пыли, образующиеся при гранулировании и переработке пылевидного сырья
|
Параметр |
Единица измерения |
Средний уровень выбросов для НДТ* |
|
Пыль |
мг/нм3 |
50 |
|
* Среднесуточное значение или среднее значение за период пробоотбора. | ||
Раздел 6 Экономические аспекты применения наилучших доступных технологий
6.1 Факторы, влияющие на данные по затратам
В настоящем разделе рассмотрены вопросы, касающиеся оценки затрат промышленных предприятий по производству редких и редкоземельных металлов на реализацию отдельных природоохранных мероприятий, в том числе на приобретение, монтаж, наладку и эксплуатацию оборудования, которое обеспечивает сокращение эмиссий загрязняющих веществ в окружающую среду.
Приводимые данные получены из различных источников: от предприятий, поставщиков технологий и оборудования, консультантов. Использованы открытые данные, почерпнутые из сети Интернет, корпоративных докладов и отчетов, научно-технической литературы и др. Однако эта информация не является универсальной и не может быть использована для достоверной оценки необходимых будущих вложений каждого конкретного предприятия в технологии и оборудование, которые позволят сократить выбросы загрязняющих веществ в окружающую среду. Она отражает лишь примерный масштаб необходимых затрат для реализации природоохранных мероприятий.
Зачастую имеющиеся данные не позволяют дифференцировать затраты по отдельным их компонентам, т.е. разделить общую сумму на затраты, относящиеся к природоохранным мероприятиям, и на затраты, связанные с общей модернизацией производства и пусконаладочными работами. Таким образом, оценка фактического объема ресурсов, направленных на охрану окружающей среды, крайне затруднительна, поскольку природоохранные мероприятия, как правило, сопряжены с производственным процессом. Единственными "чистыми" затратами являются затраты и технологии, которые не имеют иных целей, кроме как уменьшение и предотвращение эмиссий загрязняющих веществ в окружающую среду.
Однако само по себе наличие более детальной информации не является однозначной гарантией применимости имеющихся сведений для оценки требуемых предприятиями вложений в технологии и оборудование природоохранного значения. Помимо масштаба предприятия и особенностей технологического процесса производства редких и редкоземельных металлов, существенное влияние на потенциальные расходы оказывают и другие факторы:
- логистика и развитость транспортной инфраструктуры, оказывающие непосредственное воздействие на поставку материалов и продукции;
- прямые операционные издержки, связанные, например, с особенностями трудового законодательства и местного рынка труда, климатическими условиями, удаленностью отдельных цехов и участков, наличием и стоимостью энергии и инфраструктуры, специальными требованиями по охране окружающей среды;
- расходы, связанные со сбытом и доступом на рынок, на масштаб которого влияет также развитость транспортной инфраструктуры, климатические условия, структура рынка и ограничения, обусловленные выходом на новые рынки;
- принципиально важна для производства редких и редкоземельных металлов конъюнктура рынка: стоимость сырья и используемых в производстве материалов, цена конечной продукции и ее динамика, объем спроса и возможности для расширения производства;
- индивидуальные особенности конкретного инвестиционного проекта: график и протяженность инвестиций во времени, условия поставки и различные сроки эксплуатации оборудования, доступность энергетической и иной инфраструктуры, процентная ставка и доступность кредитных ресурсов, корпоративная структура.
Указанные факторы свидетельствуют о том, что полные и достоверные экономические расчеты возможны только с учетом местных условий и ключевых параметров, влияющих на финансовые показатели предприятий.
В настоящее время в Российской Федерации немаловажную роль в оценке достоверности сведений о затратах предприятий оказывает высокая волатильность валютных и финансовых рынков. Поэтому необходима корректировка данных, так как годовая процентная ставка, расходы на ссудные выплаты, уровень инфляции и валютные курсы в текущий момент времени могут быть несопоставимы с условиями, в которых ранее предприятия осуществляли соответствующие вложения.
Необходимо принимать во внимание и тот факт, что затраты на модернизацию предприятия, с одной стороны, могут содержать значительный валютный вклад, связанный с приобретением, монтажом, наладкой и зачастую эксплуатацией природоохранного и иного оборудования (и технологий), который ввиду существенного изменения курса валют в рублевом эквиваленте значительно увеличивается. С другой стороны, рублевые затраты на строительство, приобретение работ и услуг на местном рынке, административные расходы подвержены инфляции. Все это важно учитывать при оценке будущих затрат на модернизацию предприятия и его экологическую результативность. Нельзя не считаться с тем, что строительство отдельных объектов затягивается на годы с момента выделения средств, инфляция влияет на заработную плату, растут административные расходы и стоимость материалов, следовательно, объем затрат увеличивается по сравнению с первоначально утвержденным.
Подытоживая вышесказанное, важно подчеркнуть, что фактические расходы на внедрение природоохранных мероприятий и технологий в производство редких и редкоземельных металлов зависит от общей экономической ситуации, налогового режима, доступности финансовых ресурсов, наличия льгот и субсидий, конкретного предприятия и конкретного оборудования.
6.2 Инвестиционные затраты
Ресурсы, которые предприятие может направить на модернизацию производства и реализацию природоохранных мероприятий, зависят в первую очередь от конъюнктуры рынка. На этом рынке отдельные предприятия не имеют возможности влиять на цену конечной продукции, чтобы хотя бы частично компенсировать затраты на внедрение эффективных технологий и реализацию природоохранных мероприятий. Они не могут также переложить часть своих издержек на поставщиков сырья за счет снижения ими цен на сырье.
Затраты на экологические мероприятия различного рода неизбежно приводят к увеличению эксплуатационных расходов, но, как правило, не дают такого повышения эффективности производственного процесса, которое может быть получено в результате внедрения мер, направленных на коренную модернизацию производственного процесса. Вместе с тем такой подход связан со значительными капитальными вложениями, остановкой производства и прочими негативными факторами.
Собственный экономический потенциал природоохранных мероприятий незначителен. Сюда можно отнести и внедрение малоотходных технологий, и производство побочной продукции, и полезное использование отходов, образующихся в основном производстве. К тому же производство побочных продуктов не имеет устойчивого спроса, потенциал выхода на внешние рынки практически бесперспективен с экономической точки зрения. Затраты же на такое производство неизбежны, поскольку существует необходимость поддержания оборудования в рабочем состоянии, выделения средств на материалы и энергию.
Таким образом, с точки зрения возмещения затрат наиболее целесообразны комплексные меры, предусматривающие экологическую модернизацию производства с перенастройкой производственного процесса в целом, оптимизацией отдельных его звеньев и расширением объемов производства.
6.3 Факторы, влияющие на данные по затратам
В настоящем разделе рассматриваются вопросы, связанные с оценкой затрат промышленных предприятий редкоментальной подотрасли на реализацию отдельных природоохранных мероприятий, включая приобретение, монтаж, наладку и эксплуатацию оборудования, обеспечивающего сокращение эмиссий загрязняющих веществ в окружающую среду.
Данные, приведенные в настоящем разделе, получены из различных источников, в том числе от предприятий, поставщиков технологий и оборудования, консультантов. Кроме того, для оценки затрат могут использоваться результаты исследований и иная опубликованная информация (корпоративные доклады и отчеты, журналы, открытые источники в сети Интернет, материалы конференций и др.). Однако информация из упомянутых источников не является универсальной и не может быть использована для хоть сколько-нибудь достоверной оценки необходимых будущих вложений конкретного предприятия в оборудование и технологии в целях сокращения эмиссий загрязняющих веществ в окружающую среду, а отражает лишь примерный масштаб затрат, которые могут возникать при реализации отдельных природоохранных проектов.
Зачастую имеющиеся данные агрегированы и не позволяют однозначно определить ключевые компоненты затрат и, тем самым провести разграничение между затратами на природоохранные мероприятия и затратами, связанными с общей модернизацией производственного процесса и пусконаладочными работами. Единственными "чистыми" затратами природоохранного характера являются затраты на оборудование и технологии "на конце трубы", которые, как правило, не имеют иных целей, кроме уменьшения или предотвращения эмиссий загрязняющих веществ в окружающую среду. Учитывая, что наиболее результативные природоохранные мероприятия оказываются интегрированными в производственный процесс, оценка фактического объема ресурсов, направленных на охрану окружающей среды, представляется крайне затруднительной.
Кроме того, в силу высокой специфичности производственных объектов, само по себе наличие более детальной информации не всегда гарантирует применимость имеющихся данных для оценки требующихся вложений российских металлургических предприятий в технологии и оборудование природоохранного назначения. Помимо масштаба предприятия и особенностей производственного процесса существенное влияние на потенциальные расходы, связанные с внедрением природоохранных методов и технологий, и оценку экологической результативности конкретного инвестиционного проекта оказывает целый ряд иных факторов, в том числе:
- логистика и развитость транспортной инфраструктуры, оказывающие прямое воздействие на затраты на поставку материалов и продукции;
- прямые операционные издержки, которые могут быть связаны с особенностями трудового законодательства и местного рынка труда, климатическими условиями, удаленностью отдельных цехов и подразделений, наличием (или стоимостью) энергии и инфраструктуры, специальными требованиями по охране окружающей среды;
- расходы, связанные со сбытом и доступом на рынок, влияние на масштаб которых также оказывают развитость транспортной инфраструктуры, климатические условия, структура рынка и ограничения, связанные с выходом на новые рынки;
- конъюнктура рынка, в том числе цена конечной продукции и ее динамика, стоимость сырья и иных используемых в производстве материалов, объем спроса и возможности для расширения производства;
- индивидуальные особенности конкретного инвестиционного проекта, в том числе график и протяженность инвестиций во времени, параметры поставки и различные сроки эксплуатации оборудования, доступность энергетической и иной инфраструктуры, процентная ставка и доступность кредитных ресурсов, корпоративная структура.
Приведенные выше факторы свидетельствуют, что получить надежные данные по расходам, связанным с внедрением природоохранных методов и технологий, которые могли бы быть использованы без опасности существенного искажения результатов, крайне затруднительно. Полные и достоверные экономические расчеты в любом случае будут возможны только с учетом всех местных условий и ключевых параметров, влияющих на финансовые результаты предприятия.
В российских условиях существенное влияние на достоверность и применимость сведений о затратах компаний отрасли производства РМ и РЗМ на природоохранные мероприятия оказывает высокая волатильность валютных и финансовых рынков. Вследствие этого необходима существенная корректировка имеющихся данных о затратах, поскольку годовая процентная ставка, расходы на ссудные выплаты, уровень инфляции и валютные курсы в текущем периоде окажутся несопоставимы с условиями, в которых компаниями ранее осуществлялись соответствующие вложения. Представленные в настоящем разделе сведения о прошлых инвестициях российских предприятий - производителей РМ и РЗМ в рублевом эквиваленте зачастую агрегированы и приводятся в виде общего объема вложений в модернизацию конкретного производства, приведшую в числе прочего к повышению его экологической результативности. Поэтому их непосредственное применение для прогнозирования будущих затрат во многих случаях может привести к получению недостоверных результатов и значительному занижению требуемого объема инвестиций.
Затраты на модернизацию предприятий, как правило, содержат значительный валютный компонент, связанный с приобретением, монтажом, наладкой и в некоторых случаях эксплуатацией импортного, в том числе природоохранного, оборудования/технологий, который в силу существенного изменения курсов валют в текущих условиях в рублевом эквиваленте может увеличиться почти кратно. В свою очередь, рублевый компонент, увязываемый со строительством, приобретением работ и услуг на местном рынке, административными расходами и т.д., подвергается воздействию инфляции, что также требует учета при оценке будущих затрат на модернизацию производства и повышение его экологической результативности. Это определяется рядом факторов. Например, многие природоохранные мероприятия связаны со строительством, которое может занимать годы с момента выделения средств в зависимости от размера предприятия и сложности технологических процессов; инфляция, воздействующая на заработную плату, административные расходы и стоимость материалов, может приводить к существенному увеличению объема необходимых затрат в сравнении с первоначально утвержденными.
Сообразный инфляции рост ключевой ставки Банка России и, как следствие, увеличение процентных ставок по розничным кредитам предприятиям обусловливают, по меньшей мере удлинение периода окупаемости инвестиционных проектов и тем самым влияют на оценку доступности вложений в природоохранные мероприятия, оборудование и технологии для конкретных производителей.
Описанные обстоятельства необходимо принимать во внимание при подготовке и принятии решений о реализации природоохранных мероприятий и внедрении методов и технологий, обеспечивающих сокращение эмиссий загрязняющих веществ в окружающую среду. Приведенные в настоящем разделе объемы затрат российских предприятий - производителей РМ и РЗМ позволяют получить лишь некоторое представление о потенциальных объемах требуемых инвестиций. Вместе с тем, фактические расходы, связанные с внедрением природоохранных технологий в производство, напрямую зависят от текущих условий, в том числе от общей экономической ситуации, налогового режима, доступности финансовых ресурсов, наличия льгот и субсидий, технических характеристик предприятия и конкретного оборудования.
6.4 Инвестиционные затраты по заводам по производству редких и редкоземельных металлов
Ресурсы, которые предприятия отрасли могут направить на модернизацию производств и реализацию природоохранных мероприятий, напрямую зависят от конъюнктуры рынка редких и редкоземельных металлов, являющейся глобальным биржевым товаром. На таком рынке компании - производители редких и редкоземельных металлов не обладают хоть сколько-нибудь существенной рыночной властью и не имеют возможности по отдельности воздействовать на цену конечной продукции, что позволило бы в той или иной степени переложить понесенные в связи с реализацией природоохранных мероприятий и внедрением экологически эффективных технологий затраты на потребителя. Также отсутствует и обратная возможность - перенесения части издержек на реализацию природоохранных мероприятий на поставщиков сырья за счет снижения последними цен на сырье - цены на концентраты.
Это означает, что возможности по компенсации любых существенных затрат, понесенных в связи с реализацией природоохранных мероприятий компаниями - производителями редких и редкоземельных металлов, в значительной мере ограничены и преимущественно могут быть реализованы одним способом - за счет увеличения объемов производства.
Усовершенствования "на конце трубы", которые изначально могут казаться относительно более дешевыми и не требовать существенных временных затрат на реализацию, в большинстве случаев приводят к увеличению эксплуатационных расходов и не дают такого повышения эффективности производственного процесса, которое может быть получено в результате внедрения мер, интегрированных в технологический процесс производства продукции. Это также свидетельствует в пользу выбора проектов коренной модернизации производственного процесса при определении мер, направленных на сокращение эмиссий загрязняющих веществ в окружающую среду. Вместе с тем такой подход связан со значительными капитальными вложениями и иными потерями ввиду необходимости временной остановки производства и перестройки производственного процесса в целом, что обусловливает снижение привлекательности полномасштабной модернизации производства при неблагоприятной рыночной конъюнктуре.
Собственный экономический потенциал природоохранных мероприятий, таких как, например, внедрение малоотходных технологий, производство побочной продукции и/или полезное использование образующихся в основном производственном процессе отходов в российских условиях следует признать скорее незначительным. С одной стороны, природоохранные технологии во многих случаях характеризуются высокой энергоемкостью, а поддержание оборудования в функциональном состоянии требует регулярных затрат на расходные материалы и комплектующие и иных эксплуатационных затрат; в некоторых случаях при производстве побочной продукции, такой, например, как серная кислота, значительные издержки могут возникать и в связи с необходимостью хранения и транспортировки агрессивного вещества. С другой стороны, низкая емкость российских рынков не обеспечивает достаточного спроса для вывода "побочных" производств на экономически эффективный уровень и не сможет гарантировать устойчивое потребление продукции вновь вводимых производственных мощностей, а потенциал выхода на внешние рынки ограничен и малоперспективен с экономической точки зрения.
Таким образом, наибольшим потенциалом с точки зрения возмещения затрат, понесенных в связи с внедрением на предприятии новых природоохранных методов и технологий, обладают комплексные меры, увязывающие экологическую модернизацию производства с перенастройкой производственного процесса в целом, оптимизацией отдельных его звеньев и расширением объемов производства. В этом случае высокие начальные затраты на внедрение интегрированных в производственный процесс природоохранных мер и технологий могут быть в конечном счете возмещены за счет увеличения объемов производимой продукции, повышения эффективности и снижения удельных эксплуатационных расходов. Однако на практике обособление "экологической составляющей" в рамках таких "встроенных" в технологический процесс мероприятий на фоне других капитальных и эксплуатационных расходов представляет собой достаточно сложную задачу.
В свою очередь потенциал прямой "монетизации" природоохранных мероприятий во многом определяется наличием или отсутствием соответствующих рынков сбыта и, как правило, в отраслях тяжелой промышленности, в том числе в цветной металлургии и производстве редких и редкоземельных металлов.
6.4.1 Инвестиционные затраты по переработке фосфогипса
В качестве примера приводим обоснование и затраты на создание производственного цикла переработки фосфогипса.
Фосфогипс - неизбежный крупнотоннажный отход производства минеральных удобрений, образующийся при переработке апатитового концентрата по сернокислотной технологии.
Разработана технология комплексной переработки фосфогипса, которая состоит из следующих технологических этапов:
1. очистка фосфогипса от остаточного содержания кислых солей (фосфатов, сульфатов и фторидов) и выделения РЗЭ методом кучного выщелачивания;
2. концентрирование РЗЭ на катионите;
3. экстракционное разделение РЗЭ с получением концентрата церия, оксидов лантана, неодима, а также концентратов легкой и средней группы.
Разработана безотходная комплексная технология переработки отвалов фосфогипса с попутным извлечением РЗМ, которая была проверена в лабораторных условиях на отвальном фосфогипсе ОАО "Гомельский химический завод" и на фосфогипсе, взятом из процесса производства экстракционной фосфорной кислоты ОАО "Воскресенские минеральные удобрения", в режиме полной циркуляции оборотной воды с получением опытных партий строительного (β- полугидрата сульфата кальция), высокопрочного гипса (α- полугидрата сульфата кальция) и редкоземельного концентрата.
Сущность технологии:
1. Отмывка фосфогипса осуществляется разбавленным раствором серной кислоты с получением:
- отмытого фосфогипса;
- сернокислого раствора, содержащего примеси фосфора, фтора и РЗЭ.
2. Переработка сернокислого раствора производится с получением:
- РЗК товарной чистоты;
- оборотного аммиака, направляемого на нейтрализацию сернокислого раствора;
- щелочной пульпы гипса.
3. Переработка отмытого фосфогипса производится нейтрализацией его щелочной пульпой гипса с последующим получением гипсового вяжущего, а также изделий из него.
4. Переработка РЗК (в перспективе) производится с получением групповых концентратов РЗО, индивидуальных соединений РЗЭ и изделий на их основе.
Комплексная технология переработки фосфогипса не имеет отходов и может работать в автономном режиме.
Блок-схема комплексной технологии переработки фосфогипса с получением высокопрочного гипсового вяжущего изделий на его основе и РЗК приведена на рисунках 6.1 и 6.2.
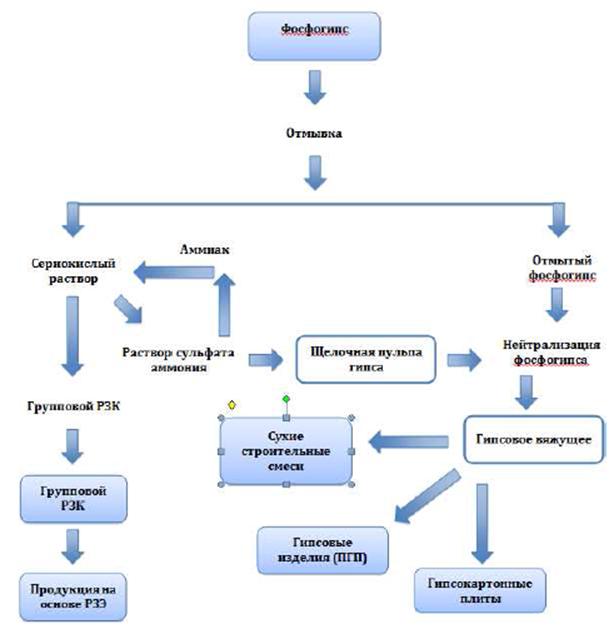
Рисунок 6.1 - комплексная технология переработки фосфогипса с получением высокопрочного гипсового вяжущего, изделий на его основе и РЗК
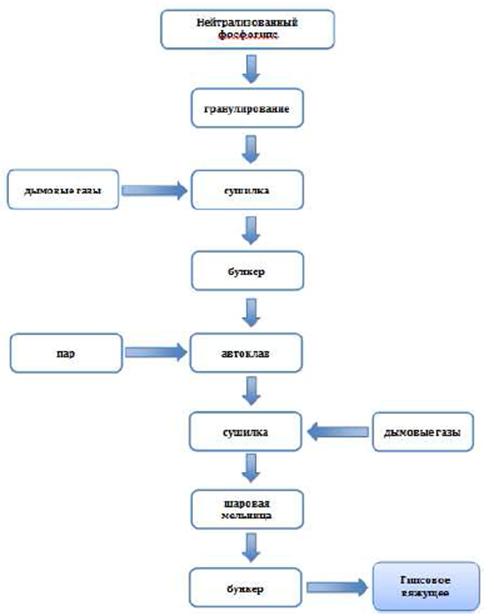
Рисунок 6.2 - производство высокопрочного гипсового вяжущего по ГОСТ 125-79
По результатам лабораторных испытаний гипсовое вяжущее, полученное из отмытого и нейтрализованного фосфогипса, соответствовало по всем показателям требованиям ГОСТ 23789-79
6.4.2. Оценка стоимости переработки фосфогипса
Организовано модульное производство по переработке отвального фосфогипса производительностью 60000 тонн фосфогипса/год с получением высокопрочного гипсового вяжущего и изделий на его основе:
пазогребневых плит - 60000 тонн (720 000 м2);
сухих строительных смесей - 12 000 тонн; концентрата РЗМ - 216 тонн.
Таблица 6.4 - Нормы расхода сырья и химреагентов на подготовку 1 т фосфогипса для производства гипсового вяжущего (с получением РЗК). Выход гипсового вяжущего - 1, 25 т/т фосфогипса
|
Наименование расходуемых видов сырья и энергоресурсов |
Ед. изм. |
Норма |
|
Фосфогипс |
т |
1 |
|
Серная кислота ГОСТ 2184-77 |
т |
0, 102 |
|
Гашеная известь ГОСТ 9179-77 |
т |
0, 108 |
|
Техническая вода |
м3 |
0, 42 |
|
Электроэнергия |
квт/ч |
25 |
|
Осадитель РЗК |
кг |
11, 3 |
|
Фильтроткань |
п.м. |
0, 042 |
Таблица 6.5 - Затраты на организацию производства
|
N п/п |
Статьи затрат |
Сумма (тыс. руб.) |
|
1 |
Цех первичной подготовки фосфогипса |
25 000, 00 |
|
2 |
Цех концентрата РЗМ |
20 000, 00 |
|
3 |
Цех подготовки фосфогипса |
20 000, 00 |
|
4 |
Цех производства высокопрочного гипсового вяжущего |
15 000, 00 |
|
5 |
Цех производства пазогребневых плит |
12 800, 00 |
|
6 |
Цех сухих смесей |
15 000, 00 |
|
7 |
Административный корпус |
15 000, 00 |
|
Итого |
122 800, 00 |
Таблица 6.6 - Годовые эксплуатационные расходы опытно-промышленного производства при выделении РЗ из фосфогипса
|
N п/п |
Статьи затрат |
Сумма (тыс. руб.) без НДС |
|
1 |
Пазогребневые плиты |
61 440 |
|
2 |
Гипсовое вяжущее |
151 260 |
|
3 |
Сухие строительные смеси |
27 600 |
|
4 |
Концентрат РЗМ |
62 |
|
Итого |
240 362 |
Таблица 6.7 - Выручка от реализации продукции, полученной в результате переработки фосфогипса
|
N п/п |
Статьи затрат |
Сумма (тыс. руб.) без НДС |
|
1 |
Пазогребневые плиты |
283980 |
|
2 |
Сухие строительные смеси |
50484 |
|
3 |
Концентрат РЗМ |
32004 |
|
Итого |
366 468 |
Таблица 6.8 - Расчет срока окупаемости капитальных вложений опытно-промышленного производства по переработке фосфогипса
|
Показатели |
Сумма (тыс. руб.) |
|
Поступления от продаж (с НДС) |
432 432 |
|
Расходы на выпуск продукции (с НДС) |
283 627 |
|
Выплата налога на прибыль |
24 939 |
|
Выплата НДС |
22 699 |
|
Итого операционные расходы |
331 266 |
|
ИТОГО по операционной деятельности |
101 167 |
|
Срок окупаемости капиталовложений |
1, 3 года |
Даже в условиях опытно-промышленного производства переработка фосфогипса становится выгодной с точки зрения экономических условий. Срок окупаемости капиталовложений составляет - больше года.
Раздел 7. Перспективные технологии
7.1 Фторидные технологии
Одним из наиболее перспективным методом переработки сырьевых источников и получения чистых металлов является фторидная технология.
Важное место занимает создание рентабельного способа переработки ильменитовых, лопаритовых, танталит-колумбитовых, вольфрамсодержащих и молибденитовых концентратов с комплексным извлечением редких, редкоземельных металлов, и их высокочистых соединений - оксидов, нитридов и карбидов.
Особое внимание следует уделить разработке фторидного способа вскрытия оксидных и сульфидных концентратов, способов разделения и электролитической переработки безводных фторидов титана, ниобия, тантала, молибдена, вольфрама, рения, редкоземельных элементов, кремния и бора с выделением элементного фтора, направляемого в качестве основного реагента в процесс фторирования исходных концентратов.
В качестве сырьевых источников могут быть выбраны титансодержащие шлаки восстановительной плавки ильменитовых концентратов Иршанского и Верхнеднепровского месторождений (Украина), лопаритовые концентраты Ловозерского месторождения (Россия, Кольский полуостров), молибденитовые концентраты Сорского ГОК (Россия, Хакасия) и др. В Томской области (Россия) возобновился интерес к разработке Туганского месторождения комплексного полиметаллического сырья с созданием производства с целью выпуска ильменитовых и цирконовых концентратов.
При создании фторидного способа переработки полиметаллических концентратов:
- предложены одно и двустадийные способы фторирования полиметаллических концентратов;
- для разделения фторидов металлов с незначительной разностью температур их кипения и отделения инертных газов, а также фторидов примесей предложен способ их разделения по молекулярным массам с использованием каскада газовых центрифуг, которые широко используются в промышленном масштабе в атомной промышленности при разделении изотопов урана;
- для переработки безводных фторидов обоснован электролитический способ получения редких металлов и элементного фтора из расплава эвтектики фторидных солей.
Фторидный способ переработки минерального сырья с использованием в качестве основного реагента рециклируемого элементного фтора может быть использован в производстве высокочистых порошков металлов, их оксидов, нитридов и карбидов практически всех редкометалльных химических элементов, образующих летучие фториды.
Фторирование с использованием в качестве основного реагента рециклируемого элементного фтора, разделение фторидов редких металлов, летучих фторидов примесей и инертных газов по их молекулярным массам в каскаде газовых центрифуг, применение электролитического извлечения редких металлов и элементного фтора из безводных фторидов в низкоплавком расплаве фторидных солей являются новым направлением развития производства редких высокочистых металлов и новых конструкционных керамических материалов на основе их карбидов, нитридов, силицидов, боридов, карбосилицидов и композиционных материалов на основе этих соединений.
Фторидная технология заключается в смешивании исходного сырья в виде порошка с твердым фторирующим реагентом и обработке во фторопластовых реакторах со стальным кожухом закрытого типа при температурах 140 °C - 190 °C при избыточном давлении. При этом в качестве фторирующего агента используют смесь бифторида (гидродифторида) аммония (NH4HF2) и фтористоводородной кислоты в количестве, достаточном для полного поглощения выделяющегося аммиака.
Перспективным методом переработки эвдиалитового концентрата может являться его разложение минеральной (соляной или азотной) кислотой при ее расходе 90 % - 110 % от стехиометрического количества с последующей термической обработкой и водным выщелачиванием получаемого геля в автоклавных условиях при температуре 175 °C - 250 °C в течение 1-4 ч. При этом в раствор переходят редкоземельные элементы, а в нерастворимый остаток - соединения циркония, которые выделяют из остатка путем мокрого гравитационного сепарирования. Извлечение ZrO2 данным методом составляет более 71 %.
Заслуживает внимания вариант технологии переработки эвдиалитового концентрата, предусматривающая совмещение процессов разложения с экстракцией циркония. ТБФ насыщенный азотной кислотой вводят на стадию разложения. Соотношение Т:Ж поддерживают 1:8-10 (Ж = О + В). Отношение водной и органической фаз при этом составляет 1:1-0, 5. Степень извлечения циркония за счет перевода его в органическую фазу повышалась до 95 % - 99 %. Реэкстракцию циркония из органической фазы проводят слабым (3 % - 4 %) раствором азотной кислоты. В дальнейшем из растворов аммиаком осаждали гидратированный оксид циркония.
Фториды РЗЭ получают обезвоживанием гидратированных солей, осажденных из растворов или действием фтористого водорода на оксиды РЗЭ.
Фториды РЗЭ осаждают из азотнокислых или солянокислых растворов плавиковой кислотой. Некоторые РЗЭ (лантан, церий и др.) выделяются в виде полугидратов LnO3•0, 5H2O, другие (празеодим, неодим) - без кристаллизационной воды. При нагревании раствора с осадком фторидов с помощью инфракрасной лампы гидратированные фториды превращаются в безводные. Отфильтрованные и промытые спиртом осадки затем сушат при 400 °С в атмосфере сухого аргона. Полученные этим способом фториды содержат примесь оксифторидов LnOF. Исключить их образование можно сушкой в токе HF. Более чистые фториды получают действием фтористого водорода на оксиды при 550 °C - 575 °С:
Ln2O3 + 6HF = 2LnF3 + 3Н2O
(7.1)
Фторирование таблеток оксидов проводят в трубе из никеля или сплава 70 % Ni + 30 % Сu, через которую навстречу потоку газа перемещаются лодочки с оксидами. Можно проводить фторирование оксидов в кипящем слое. Фториды, в отличие от хлоридов, малогигроскопичны, что облегчает работу с ними.
Также карбонаты, гидроксиды или активные оксиды РЗМ, полученные разложением оксалатов или карбонатов при температуре не выше 600 °С, гидрофторируют фтористым водородом при температуре 380 °C - 550 °С. Известен способ получения фторидов редкоземельных металлов взаимодействием с фтористоводородной кислотой или ее солями в кислой водной среде. Однако высокая коррозионная активность среды, содержащей плавиковую кислоту, создает значительные трудности при создании оборудования для получения фторидов редкоземельных элементов и требует применения дорогостоящих конструкционных материалов. Кроме того, фториды РЗМ, получаемые по так называемым "мокрым" способам, содержат значительное количество оксофторидов, если их при сушке и прокалке не обрабатывать безводным фтористым водородом, при этом также увеличивается их себестоимость.
Разработан способ получения фторидов РЗМ и иттрия из их оксидов длительной обработкой (в течение 8 ч) газообразным фтористым водородом при 600 °C - 700 °C. Недостатком данного способа является значительная коррозия аппаратуры вследствие высокой температуры обработки оксидов, что приводит к загрязнению фторидов РЗМ и длительности процесса фторирования, требующего большого расхода фтористого водорода, и, следовательно, ухудшает экономические показатели процесса.
Сущность рассматриваемого способа получения фторидов РЗМ и иттрия заключается в том, что в качестве исходных материалов используют оксалаты, гидроксиды, карбонаты и оксиды РЗМ и иттрия, которые обрабатывают безводным фтористым водородом при температуре от 350 °C до 550 °C. Причем отличие от прототипа, позволяющее снизить температуру обработки оксидов фтористым водородом и ее длительность, заключается в том, что предварительная прокалка солей РЗМ и иттрия производится при температуре не более 600 °С, что делает возможным получение активных оксидов, из которых при вышеуказанных температурах удается получить фториды, не содержащие кислородсодержащие соединения.
Данный способ позволяет получить более чистые фториды редкоземельных металлов и иттрия при меньшем расходе HF и меньшей температуре фторирования, что значительно снижает коррозию оборудования.
Выполнен большой объем научно-исследовательских работ по фторированию ильменитовых шлаков и лопаритовых концентратов с получением нелетучих фторидов. Разработаны и проведены испытания по разделению летучих фторидов титана, ниобия и тантала и технологии получения их из фторидов. В числе новых схем переработки сульфидных концентратов исследован процесс фторирования молибденитовых сульфидных концентратов. Значительные работы проведены по фторидной переработке оксидных концентратов редких металлов (рутиловые. Танталит-колумбитовые, вольфрамитовые и шеелитовые). Фторидные технологии являются перспективными и во многих случаях готовыми для промышленной реализации.
7.2 Инновационные технологии производства лития
В промышленной практике применяют пять методов обогащения литиевых руд: крупнокусковое обогащение, термическое обогащение (декрипитация), гравитационное и магнитное обогащение, флотация.
Нетрадиционными источниками литиевого сырья за рубежом рассматриваются гекторитовые глины, ядарит, геотермальные воды действующих электростанций, нефтепромысловые рассолы и морская вода.
Для переработки литиевых руд и концентратов традиционно используют четыре способа: сульфатный, известковый, хлорирующий обжиг и сернокислотный.
Хлорирующий обжиг был использован для переработки лепидолит и сподуменсодержащих концентратов. Обожженный при температуре 800 °С материал (лепидолит + NH4Cl + CaCO3) выщелачивали водой, из раствора при последующем упаривании кристаллизуется смесь хлоридов лития и кальция, которая может быть использована для электролиза или получения гидроксида лития методом каустификации. В промышленном масштабе способ был освоен в США для извлечения лития из сподуменового концентрата.
По гидрометаллургической технологии, названной процессом Sileach, тонкоизмельченный флюорит (CaF2) смешивают со слюдой и выщелачивают в серной кислоте при температуре 95 °C - 115 °С в течение 4 ч при атмосферном давлении. Процесс предусматривает регенерацию серной кислоты. В лабораторных тестах Sileach при проведении процесса в течение 4 ч извлечение лития из альфа-сподумена достигало 92 %.
Для извлечения ценных компонентов из рассолов предложены различные методы, из которых можно выделить следующие схемы: классическую галургическую схему переработки рассолов с многостадийной упаркой и смешанную, в которой используются осадительные методы, сорбция, экстракция и другие.
К наиболее простым для промышленного освоения относятся литиеносные рассолы хлоридного натриевого типа (оз. Сильвер-Пик, США), в которых содержание солей магния и кальция невелико. В мировой практике освоены технологии их переработки, основной принцип которых - предварительное концентрирование рассолов по литию в испарительных бассейнах до получения литиевого концентрата, пригодного для осаждения из него карбоната лития раствором соды.
Особое место в ряду исходного сырья для получения металлов (лития, рубидия, цезия, стронция, калия, магния), а также бора, брома и йода занимают рассолы хлоридного кальциево-магниевого типа (рапа Большого Соленого озера, США). Для рассолов хлоридно-магниевого типа характерны минимальные концентрации хлорида кальция (рассолы Китая).
Во всех случаях конечным продуктом будет соль лития. Наиболее распространенный конечный продукт - карбонат лития, который служит исходным материалом для получения других соединений, в частности, хлорида лития, из которого производится металлический литий. Одни из способов получения лития является металлотермическое восстановление его соли. Ниже приводим инновационную технологическую схему по получению металлического лития совмещенным процессом "диссоциация - восстановление" карбоната лития алюминием (см. рисунок 7.1).
1. Диссоциация карбоната лития:
- температура - от 700 °C до 740 °С;
- время синтеза - 3-3, 5 ч;
- остаточное давление - 15-20 Па;
- контрвакуум печного пространства - нет
2. Алюминотермическое восстановление оксида лития: 23
- температура - 940 °C - 950 °С;
- время восстановления - 2-2, 5 ч;
- остаточное давление - 10-15 Па;
- контрвакуум печного пространства - 13, 3 кПа;
3. Алюминотермическое восстановление смеси алюминатов лития:
- температура - 1200 °C - 1250 °С;
- время восстановления - 3 - 3, 5 ч;
- остаточное давление - 1, 3 - 10 Па;
- контрвакуум печного пространства - 10 кПа.
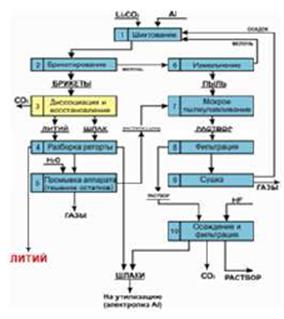
Рисунок 7.1 - Технологическая схема получения лития совмещенным процессом "диссоциация-восстановление" карбоната лития
Для получения лития алюминотермическим восстановлением оксида лития в вакууме в качестве аппарата - аналога может быть применена вакуумная шахтная ретортная печь для дистилляции кальция из медно-кальциевого сплава.
7.3 Комбинированная сорбционно-экстракционная технология переработки суммарных концентратов РЗМ с получением высокочистых соединений (на примере легкой группы РЗМ)
Огромное разнообразие сырья РЗМ - природного и техногенного - определяет необходимость создания комбинированной схемы, основные элементы которой могли быть положены в основу локальных технологий. Была разработана промышленная технология современного уровня, которая позволит получать высокочистые индивидуальные соединения РЗМ из бедных руд и техногенных отходов и повысить экологический уровень предприятий. Основные приемы для достижения этой цели - максимальное использование экологически чистых сорбционных методов разделения и очистки РЗМ при рациональном применении экстракционных приемов разделения близких по свойствам металлов. При разработке промышленной технологии применительно к РЗМ-сырью в значительной степени учитывался весь огромный опыт урановой и золотодобывающей отраслей промышленности, включая как технологические, так и аппаратурные решения. Еще одним основанием для развития сорбционных процессов в сфере РЗМ являются блестящие достижения последних лет в области синтеза высокоселективных сорбентов мировыми разработчиками смол, в том числе ионитов с регулируемой на стадии синтеза пористостью, сорбентов, импрегнированных высокоселективными экстрагентами целевого назначения, хелатных и модифицированных смол. Расширение ассортимента смол позволяет существенно облегчить создание принципиально новой промышленной технологии с применением промышленно выпускаемых сорбентов.
Разработанная инновационная комбинированная сорбционно-экстракционная технология переработки любого вида сырья, содержащего РЗМ, с получением высокочистых (99, 99 %) соединений РЗМ легкой группы состоит из трех основных составляющих - головной сорбционной операции, экстракционного разделения внутри схемы и тонкой очистки от примесей на завершающих стадиях разработанной технологии. Головная операция - это использование сильнокислотного пористого сульфокатионита в голове процесса для отделения РЗМ от основных примесей. Новизна процесса состоит в том, что для десорбции суммы РЗМ с катионита Lewatit MonoPlus SP112 использован раствор четырехвалентного церия, что позволяет практически полностью вытеснить сумму РЗМ с ионита, но при этом поддерживать "сбросную" (менее 0, 0005 г/л) концентрацию церия (IV) в растворе после колонны. Этот процесс фронтально-градиентного вытеснения РЗМ легкой группы из фазы смолы обеспечивает количественное отделение церия (IV) от остальных элементов. Сорбированный церий (IV) снимается с катионита раствором азотной кислоты в элюат, который подвергается экстракционной обработке, а реэкстракт направляется на получение соединения высокочистого церия путем тонкой очистки от примесей нередкоземельных металлов. В качестве экстрагента использован реагент из класса четвертичного аммониевого основания. Показано также, что применение вместо экстрагента Aliquat 336 сильноосновного анионита пористой структуры снижает показатели очистки, что обусловлено восстановительными свойствами углеводородной матрицы анионита.
Следующая технологическая новизна состоит в использовании комплексона типа трилон-Б для избирательного связывания суммы празеодима и неодима в комплексные соединения с последующим пропусканием водно-органической системы через слабокислотный катионит. Лантан при этом полностью сорбируется, а связанные в комплекс два металла проходят в фильтрат сорбции. Далее элюат лантана подвергается тонкой очистке от нередкоземельных металлов, а закомплексованные катионы празеодима и неодима после регенерации ЭДТА (этилендиаминтетрауксусной кислоты) подвергаются экстракционному, ставшему уже традиционным, процессу разделения. Реэкстракты этих двух металлов для получения высокочистых соединений также подвергаются тонкой очистке от примесей нередкоземельных металлов.
В конечном итоге третья технологическая новизна разработанного процесса получения высокочистых соединений РЗМ из любого сырья состоит в использовании для заключительной очистки импрегнированных и хелатных смол. Так, применение сорбента, импрегнированного экстрагентом бис-(2, 4, 4-триметилпентил)фосфиновой кислотой и маркированного как Lewatit TP272, для тонкой очистки от примесей индивидуальных элюатов и реэкстрактов РЗМ легкой группы позволило стабильно получать высокочистые соединения (99, 99 %) легкой группы. Эта технология прошла проверку в масштабе пилотных испытаний, в результате чего данные лабораторных исследований были полностью подтверждены в балансовых опытах. Разработанная технология получения высокочистых соединений РЗМ использует стандартное оборудование - сорбционные колонны ПИК с плотным слоем сорбента, реакторное оборудование и т.п. Причем процессы тонкой очистки проводятся в реакторном статическом варианте в аппаратах с перемешиванием ионообменных фаз и последующим отделением смол на сетках.
Таким образом, разработанная технология обладает элементами новизны и по сравнению с традиционной экстракционной схемой в ней повышена экологическая составляющая. Более того, предложенная схема эффективна как при переработке суммарных концентратов РЗМ с целью получения высокочистых соединений, так и для переработки техногенного сырья, в том числе с низким содержанием суммы РЗМ в этом сырье, например, для переработки отходов или промпродуктов, получаемых в производстве минеральных удобрений.
7.4 Извлечение редкоземельных металлов из золошлаков ТЭЦ
Золошлаковые отвалы (ЗШО) являются источником загрязнения окружающей среды, в то же время они содержат целый ряд ценных компонентов (германий, галлий, скандий, РЗМ).
Разработана технология извлечения скандия и редких земель из ЗШО методом кучного выщелачивания (КВ). Из-за низкого содержания ценных компонентов в исходном материале другие методы извлечения представляются априори нерентабельными, так как требуют больших затрат.
Основное отличие разработанного метода от традиционного КВ состоит в предварительной подготовке ЗШО к кучному выщелачиванию. Как известно, ЗШО - это дисперсный продукт, который в естественном виде непригоден для КВ из-за проблем плохой фильтрации и кольматации. Для извлечения РЗМ и скандия и обеспечения дренажа штабеля ЗШО гранулировали с серной кислотой, которая выполняла функции связующего и вскрывающего реагента. В результате исследований получены прочные и устойчивые к разрушению гранулы, пригодные для дальнейшей переработки методом КВ. Редкие земли извлекали из продуктивных растворов КВ сорбцией в колонке на ионитах в динамическом режиме. Десорбцию ценных компонентов со смолы проводили в две стадии: растворами нитрата аммония для очистки от примесей и сульфата аммония для десорбции РЗЭ. Первичный концентрат редких земель осаждали из десорбатов щавелевой кислотой.
Определены оптимальные параметры процессов грануляции ЗШО, обеспечивающих получение гранул, пригодных для укладки в штабель и выщелачивания в режиме КВ, сорбции РЗМ на ионообменной смоле, десорбции и осаждения чернового концентрата. Извлечение РЗМ на стадии КВ составило 55 %, на стадиях сорбции и десорбции - 90 %. Извлечение скандия на стадиях сорбции и десорбции составило 99, 6 %.
На основании проведенных исследований в лабораторном и укрупненном масштабах совместно с МГТУ им. Н.Э. Баумана на Дорогобужской ТЭЦ создана опытная установка по переработке ЗШО.
7.5 Переработка гидроксидного кека, получаемого при щелочном вскрытии монацитового концентрата
Гидроксиды редкоземельных и радиоактивных элементов (РЗЭ(OH)3, РЭ(OH)3, являются промежуточными продуктами при щелочной переработке монацита и ксенотима. Для дальнейшей переработки полученный гидроксидный кек, содержащий РЗЭ(OH)3 и РЭ(OH)3 растворяют в азотной или соляной кислоте. При нейтрализации полученных кислотных растворов накапливается большое количество растворов хлорида или нитрата натрия. И поэтому вопрос о сокращении большого количества отходов, а также уменьшение затрат на реагенты остается открытым.
В данном способе предложены кислоты, используемые для вскрытия гидроксидного кека, заменить хлоридом аммония (NH4Cl) и переводить его в водорастворимые хлориды твердофазным методом при нагревании. NH4Cl является нетоксичным, удобным и безопасным реагентом при хранении. При относительно низких температурах NH4Cl химически активен и позволяет осуществить процесс хлорирования во всем объеме реакционной массы, а его избыток может быть легко регенерирован и повторно использован.
Предварительно было изучено взаимодействие РЗЭ(OH)3 и РЭ(OH)3 с NH4Cl при нагревании. Для исследования взаимодействия La(ОН)3 с NH4Cl применяли термогравиметрический анализ. Продукты взаимодействия определяли с использованием рентгенофазового анализа.
При нагревании смеси РЗЭ(OH)3 и NH4Cl на кривых ДТА имеются три эндотермических эффекта. Вне зависимости от соотношения компонентов всегда присутствует обратимый эффект полиморфного превращения NH4Cl, второй эндоэффект является результатом реакции хлорирования, а третий эндоэффект результатом разложения комплексных соединений с образованием безводных хлоридов РЗЭ. Соединения урана ведут себя подобно РЗЭ(OH)3, а соединение тория не вступает в реакцию хлорирования. Таким образом, при спекании гидроксидного кека с NH4Cl будут образовываться водорастворимые хлориды РЗЭ, что может быть использовано для отделения их от тория.
На основании полученных экспериментальных результатов предложена принципиальная пооперационная схема процесса получения концентрата РЗЭ из гидроксидного кека, образующегося при щелочной переработке монацитового концентрата.
Твердофазное спекание гидроксидного кека с NH4Cl, взятого в массовом соотношении 1:3, проводили при температуре 300 °C. Далее полученный хлоридный спек нагревали до 350 °C для перевода в газообразное состояние и удаления из системы избыточного NH4Cl. Газовая фаза направляется на десублимацию для регенерации NH4Cl. Спек хлоридов редкоземельных и радиоактивных элементов является конечным продуктом и может использоваться для последующего разделения на компоненты известными методами. По разработанной технологической схеме проведены укрупненные лабораторные и полупромышленные испытания.
7.6 Автоклавная переработка монацитовых концентратов
Широко распространенными способами переработки монацитовых концентратов являются щелочной и сернокислотный методы. Одним из наиболее исследованных методов выделения и очистки РЗЭ из растворов выщелачивания является жидкостная экстракция с трибутилфосфатом (ТБФ). Разложение азотной кислотой при атмосферном давлении малоэффективно, поэтому в работе приведены результаты исследований процесса вскрытия монацитового концентрата при повышенных давлениях.
В качестве исходного продукта использовали монацитовый концентрат техногенного месторождения в г. Красноуфимске, Россия.
Основным параметром, характеризующим эффективность протекания процесса, приняли степень вскрытия (α, %) по РЗЭ.
Процесс автоклавного выщелачивания тория и суммы РЗЭ из монацитового концентрата (проба 1) был исследован при различных температурах в автоклаве (453, 473 и 493) K и постоянной концентрации азотной кислоты 6 М и продолжительности процесса 120 мин. Увеличение температуры процесса мало влияет на извлечение тория из монацита и незначительно повышает извлечение суммы РЗЭ. При увеличении времени реагирования извлечение РЗЭ растет нелинейно, а извлечение тория практически не зависит от времени реагирования.
Исследования по влиянию концентрации азотной кислоты проводили при концентрациях (3, 6, 9) М и постоянных: температуре в автоклаве 473 К и продолжительности процесса 120 мин. Увеличение концентрации HNO3 с 6 до 9 М повышает извлечение суммы РЗЭ с 24 % до 47 %, а тория лишь с 7 % до 11 %, соответственно.
Результаты исследований азотнокислотного автоклавного способа вскрытия монацитового концентрата с использованием перемешивания на укрупненной установке были изложены в статье. При условиях: 9 М HNO3, 473 К, 150 мин, была достигнута степень извлечения РЗЭ на уровне 55 % - 60 %.
Для исследования возможности интенсификации исследуемого процесса были проведены эксперименты с применением микроволнового метода нагрева. Условия растворения следующие: 473 К, соотношение Т:Ж = 1:10, концентрированная азотная кислота, время проведения процесса - 60 мин. Избыточное давление при этих условиях поднималось до 1, 5-1, 6 МПа.
В целом образец 2 оказался более легковскрываемым азотной кислотой, чем образец 1. Степени вскрытия легких РЗЭ незначительно отличаются от степеней вскрытия тяжелых РЗЭ, т.е. РЗЭ вскрываются достаточно равномерно. Степени вскрытия балластных компонентов либо отличаются в большую сторону для пробы 2, либо отличаются незначительно. При этом степень вскрытия радиоактивных компонентов для тория составила 48 % для пробы 1 и 62 % для пробы 2. Степени вскрытия урана составили 58 % для пробы 1 и 61 % для пробы 2.
Проведенные исследования показывают, что, несмотря на недостаточно высокие степени вскрытия монацита, при применении ряда методов интенсификации процесса азотнокислотного автоклавного выщелачивания монацита степень извлечения РЗЭ значительно увеличивается (с ~ 20 % до 60 %). Дальнейший поиск способов увеличения показателей эффективности процесса (химической активации, механоактивации и т.д.) делает рассматриваемый метод перспективным.
7.7 Экстракционное разделение редкоземельных элементов, выделенных из апатитового концентрата
Промышленно освоены две технологии переработки апатита - сернокислотная и азотнокислотная технологии. В зависимости от принятой технологии переработки присутствующие в апатите РЗЭ концентрируются в азотно-фосфорнокислом растворе (АФР) при азотнокислотной технологии или в фосфогипсе при сернокислотной. При этом для извлечения РЗЭ наиболее перспективна азотнокислотная технология, так как по этой схеме РЗЭ в основном движутся одним потоком без значительного перераспределения.
По стандартной технологии азотно-фосфорнокислый раствор, содержащий до 7 г/л РЗЭ, охлаждают, кристаллизуют и выделяют нитрат кальция, аммонизируют, упаривают и направляют на получение удобрений. Большая часть РЗЭ остается в составе удобрений. Для выделения РЗЭ после вымораживания нитрата кальция и отделения фтора проводят селективное выделение гидратно-фосфатных осадков РЗЭ при рН = 1, 1-2, 0.
Для извлечения РЗЭ из апатитовых концентратов предложены различные методы. Опубликованы результаты исследований по извлечению РЗЭ осаждением в форме оксалатов с последующим переводом оксалатов в гидроксиды, обработкой осадка серной кислотой с выделением сульфатов РЗЭ или экстракцией нейтральными фосфорорганическими соединениями. Для дальнейшего разделения РЗЭ широко применяют метод экстракции, в частности наибольшее применение нашел ТБФ.
Известны методы разделения РЗЭ экстракцией ТБФ из азотнокислых растворов, содержащих 8 М азотной кислоты, из растворов нитратов РЗЭ, содержащих 0, 2-0, 3 М азотной кислоты и 5 N нитрата алюминия, а также разделение нитратов РЗЭ экстракцией ТБФ в присутствии нитрата аммония. В последнем случае противоточный процесс состоит из стадий экстракции, промывки и реэкстракции. В качестве промывного раствора используют упаренный реэкстракт, что связано с необходимостью упаривания значительного количества растворов.
В связи с этим были проведены исследования, направленные на снижение количества упариваемого реэкстракта. Для этого проводили экстракцию РЗЭ, выделенных из апатита, в присутствии нитрата аммония. Исходный раствор содержал 300 г/л РЗЭ, в качестве экстрагента использовали 100 % ТБФ. Далее проводили промывку и реэкстракцию подкисленной водой в две стадии последовательно двумя потоками реэкстрагирующего раствора. Каждый реэкстракт выводили из системы. Первый реэкстракт упаривали до концентрации 280-320 г/л и направляли в качестве промывного раствора на промывку органической фазы. Второй реэкстракт обрабатывали гидроксидом аммония или аммиаком и отделяли фильтрацией гидроксиды РЗЭ. Гидроксиды РЗЭ выводили как готовую продукцию, а нитрат аммония направляли на приготовление исходного раствора.
Также разработана универсальная технология разделения концентратов РЗМ с получением индивидуальных РЗЭ высокой степени чистоты.
Существенным отличием от реализуемых как в России, так и в Китае и США технологий является то, что процесс экстракционного разделения РЗК предложено проводить в центробежных экстракторах. Технологии и оборудование позволяет создать компактное производство по разделению редкоземельных концентратов с минимальными загрузками реагентов и потоками рабочих растворов и экстрагентов. Расчет числа ступеней разделения и режим работы каскада экстракторов производится по разработанным специальным программам, а управление каскадами осуществляется от компьютера. По предварительным оценкам площадь разделительного производства с использованием центробежных экстракторов с программным обеспечением будет в 7-10 раз меньше аналогичных по объему переработки производств, использующих стандартное экстракционное оборудование - смесительно отстойные экстрактора ящичного типа. Также существенно снизится объем загружаемого в разделительные каскады пожароопасного экстрагента и объем незавершенного производства. Упрощается перезагрузка каскадов при переходе на другое сырье-концентрат РЗМ.
7.8 Универсальная экстракционная технология разделения ниобия и тантала при переработке колумбито-танталитовых концентратов различного состава
Вовлечение в производство новых источников ниобий-танталового сырья потребовало разработать эффективные технологий получения продукции на основе ниобия и тантала.
В рамках выполнения работы в качестве исходного сырья привлечен колумбитовый концентрат; соотношение Nb2O5 : Та2O5 в данном сырье близко (10 ÷ 15) : 1; а также природный колумбито-танталит, в котором указанное соотношение близко к 1:1. Следует отметить, что колумбито-танталиты различного происхождения и химического состава широко распространены на мировом рынке ниобий- и танталсодержащего сырья.
Промышленной переработки собственных колумбито-танталитовых концентратов в нашей стране не было, а опыт переработки лопарита к колумбито-танталитам малоприменим из-за существенного отличия минералогического и химического составов.
Эксперименты проводили с колумбитовым концентратом состава, масс. %: Nb2O5 - 50, 5; Та2O5 - 4, 1; Fe - 12, 6; Mn - 1, 9; W - 0, 5; Si - 3, 6; Al - 0, 35; Са - 0, 07; Ti - 1, 7; Zr - 0, 6; Sn - < 0, 2; и колумбито-танталитом состава, масс. %: Nb2O5 - 41, 0; Та2O5 - 24, 7; Fe - 14, 1; Mn - 2, 9; W - 1, 3; Si - 0, 47; Al - 0, 2; Са - 0, 4; Ti - 0, 6; Zr - 0, 09; Sn < 2, 5. Как видно из данных химического состава, содержание Nb2O5 в обоих материалах близко (50, 5 % и 41, 0 % (масс.) соответственно), однако значительно различается содержание Та2O5 (4, 1 и 24, 7 % (масс.)).
Технологическая схема предлагаемой технологии включает следующие основные стадии: сульфатно-фторидное вскрытие сырья → экстракционное разделение ниобия и тантала с очисткой их от примесей → получение Nb2O5 и Ta2O5.
Показано, что определяющим условием для успешной организации экстракционного передела при переработке редкометальных материалов, содержащих Nb2O5 и Та2O5 в соотношении от 10:1 (например, колумбитовый концентрат Зашихинского месторождения) до 1:1 (природный колумбито-танталит), является процесс вскрытия исходного сырья. Предварительными испытаниями установлены параметры сульфатно-фторидного вскрытия обоих материалов: температура, концентрация и расход фтористоводородной кислоты, а также содержание в смеси до 350-400 г/л серной кислоты положительно влияет на степень извлечения Nb2O5 и Та2O5 как из колумбитового концентрата, так и из колумбито-танталита. При использовании фтористоводородной кислоты в избытке 30 % - 34 % от стехиометрически необходимого через 6 ч в раствор переходит не менее 93 % - 95 % Nb2O5 и Та2O5. В итоге при вскрытии необходимо выдержать такие условия, чтобы в исходном растворе на экстракционное разделение концентрация Nb2O5 находилась на уровне не менее 100-120 г/л, H2SO4 ~ 300-320 г/л, F- - 220-240 г/л, Та2O5 - фактическая концентрация. Задачей последующей стадии гибкого экстракционного процесса является создание таких условий, при которых осуществляется разделение Nb2O5 и Та2O5 на одном технологическом оборудовании с целью снижения капитальных и эксплуатационных затрат при организации переработки колумбито-танталитовых концентратов различного состава.
В связи с этим для переработки ниобий- и танталсодержащих растворов после вскрытия колумбитового концентрата и/или колумбито-танталита, содержащих Nb2O5 и Та2O5 в соотношении от 10:1 до 1:1 (масс. %), была выбрана схема с коллективной экстракцией ниобия и тантала, промывкой насыщенного экстракта и последующим разделением элементов на стадии селективной реэкстракции и экстракционным разделением Nb2O5 и H2SO4 из образующегося реэкстракта ниобия; в качестве экстрагента использовался октанол-1.
Далее были проведены укрупненные непрерывные испытания предлагаемой технологии на многоступенчатом экстракционном каскаде, содержащем экстракторы типа смеситель-отстойник, на котором отработаны режимы экстракции, промывки, реэкстракции ниобия и тантала, экстракционного разделения Nb2O5 и H2SO4 с получением реэкстрактов ниобия и тантала требуемого для получения оксида ниобия (содержание основного вещества - не менее 99, 8 %) и оксида тантала (содержание основного вещества - не менее 99, 5 %) качества. Изучено распределение Nb2O5 и Та2O5 в органической и водной фазах по камерам экстракционного каскада. Анализ полученных экспериментальных данных показывает, что процесс экстракции идет эффективно на 10-12 ступенях. Для стадии промывки насыщенного экстракта достаточно 5-6 ступеней, для селективной реэкстрации ниобия - 20 ступеней; для реэкстракции тантала - 6-8 ступеней, для экстракционного разделения Nb2O5 и H2SO4 из образующегося реэкстракта ниобия - 15 ступеней. Установлено, что в оптимальных условиях экстракционного процесса содержание целевых компонентов в реэкстракте ниобия: Nb2O5 - 130-150 г/л, Та2O5 - < 0, 05 г/л; в реэкстракте тантала: Та2O5 - 15-80 г/л, Nb2O5 - < 0, 05 г/л. Потери целевых компонентов с рафинатом не превышают 0, 1 %. После осаждения, промывки, просушки и прокалки получены экспериментальные образцы оксида ниобия чистотой не менее 99, 8 % и оксида тантала чистотой не менее 99, 5 %, торгующиеся на российском и мировом рынках редких металлов.
Исследованиями показано, что количество степеней в экстракционном каскаде и конструкция отдельной ступени не отличаются как при переработке колумбитового концентрата, так и при использовании богатого колумбито-танталита, отличаются только режимы проведения экстракционного процесса. Используются одинаковые рабочие растворы. При этом изменяется только соотношение потоков органической и водной фаз О:В в контурах экстракционного каскада. Например, в растворе после вскрытия колумбитового концентрата содержится больше ниобия, таким образом, соотношение О:В при реэкстракции ниобия будет другим (больше реэкстрагирующего раствора).
Таким образом, предложенный способ вскрытия и экстракционного разделения ниобия и тантала позволяет реализовать гибкий технологический процесс, позволяющий перерабатывать редкометальные концентраты, содержащие Nb2O5 и Та2O5 в соотношении от 10:1 до 1:1 (масс. %).
Однако следует отметить, что объем готовой продукции при переработке редкометальных концентратов, содержащих ниобий и тантал в соотношениях 10:1 и 1:1, будет различным и, таким образом, технико-экономические показатели будут отличаться и требовать дополнительного уточнения для каждого вида исходного сырья.
7.9 Разделение РЗЭ средней группы смесями экстрагентов ALIQUAT®336-ТБФ и CYANEX®572-ТБФ из нитратных сред
В экспериментах использовали концентрат средней группы РЗЭ, выделенный из концентрата среднетяжелых РЗЭ производства ОАО "СМЗ" состава, %: Sm2O3 - 78, 26, Eu2O3 - 9, 88, Gd2O3 - 11, 86. Концентрация ∑TR2O3 в исходных растворах, обеспечивающая достижение максимального насыщения экстрагентов, была выбрана на основании ранее проведенных экспериментов и составила 160 г/л для смесей Cyanex®572-ТБФ и 240 г/л для смесей Aliquat®336-ТБФ. В качестве экстрагентов для приготовления смесей использовали ТБФ, Cyanex®572 (Cytes Industries B.V., США), Aliquat®336 (BASF, Германия), который предварительно переводили в нитратную форму.
Установлено, что при экстракции из растворов с pH 1 изомолярными смесями Aliquat®336-ТБФ наибольшие значения βEu/Gd (1, 91) наблюдаются при использовании смеси состава 0, 6:0, 4 (3:2).
Максимальные значения βSm/Eu незначительно варьируются (1, 30-1, 43) при изменении состава изомолярной смеси Aliquat®336-ТБФ от 1, 0:0 до 0, 2:0, 8 (1:4).
При экстракции из растворов с рН 2 сохраняется та же тенденция в изменении β соответствующих пар РЗЭ от состава смеси, что и при экстракции из растворов с pH 1. Значения β для смеси Aliquat®336-ТБФ состава 0:1, 0 близки к значениям β для системы с pH 1. При экстракции из растворов с pH 3 наблюдается четко выраженный максимум коэффициентов разделения: βEu/Gd (1, 57) и βSm/Eu (1, 43), но он смещен в сторону составов с доминированием в них ТБФ (Aliquat®336:ТБФ = 0, 35:0, 65). Кроме того, при экстракции из растворов с меньшей кислотностью наблюдается заметное уменьшение значений β.
Анализ зависимостей βGd/Eu и βEu/Sm от величины рН исходного раствора для изомолярных смесей Cyanex®572-ТБФ показал, что наибольшие значения β получены при экстракции смесью состава 1, 0:0 из растворов с рН 1 и 3. Максимальные значения βGd/Eu - 1, 39 и βEu/Sm - 1, 67. Увеличение в составе смеси мольной доли ТБФ до 0, 8-1, 0 способствует снижению значений β до 1, 1-1, 2.
Установлено, что емкость изомолярных смесей Aliquat®336-ТБФ повышается с ростом величины рН исходного раствора по мере увеличения доли ТБФ в смеси, достигая максимального значения ~ 100 г/л ∑TR2O3 (pH 3) для состава 0:1, 0. Емкости изомолярных смесей Cyanex®572-ТБФ незначительно возрастают в интервале составов 1:0 ÷ 0, 5:0, 5 при всех значениях кислотности растворов, после чего практически не изменяются (26 - 34 г/л).
По результатам исследования смеси Aliquat-336-ТБФ рекомендуется использовать для разделения средней группы РЗЭ с получением высокочистого оксида гадолиния, а смеси Cyanex®572-ТБФ - высокочистого оксида самария.
7.10 Экстракционное разделение тория и скандия
Одним из перспективных источников добычи скандия является попутное его извлечение из маточных растворов сорбции урана.
Об отечественной технологии извлечения Sc при переработке урановых руд впервые было упомянуто в докладе сотрудников ВНИИХТ на конференции в Сан-Пауло в 1970 г. Скандий извлекали в процессе экстракционной переработки глинисто-пиритных руд, содержащих уран, фосфор, РЗЭ.
При решении задачи комплексной переработки урановых руд неизбежно возникает вопрос очистки получаемой сопутствующей урану продукции от радиоактивности. Необходимо учитывать, что в технологических растворах присутствуют не только уран и торий, но и продукты их радиационного распада, концентрация которых изменяется в соответствии с их периодами полураспада.
Попутное извлечение скандия при добыче урана методом подземного скважинного выщелачивания предусматривает переработку возвратных растворов после сорбции урана и включает в себя следующие основные операции: сорбционное концентрирование скандия на ионообменных смолах, последующую отмывку ионообменных смол от примесей, десорбцию скандия, осаждение радиоактивных примесей, экстракционную очистку и дезактивацию полупродуктов, осаждение товарных концентратов.
Были проведены исследования экстракционного разделения скандия и тория в рамках разработки промышленной технологии попутного извлечения скандия при добыче урана методом подземного скважинного выщелачивания с получением оксида скандия.
Образцы чернового концентрата (ЧК) скандия для изучения экстракционного разделения скандия и тория были получены из фильтратов сорбции урана на АО "Далур" при проведении стендовых комплексных испытаний.
Известно, что азотнокислотное растворение является традиционным в схемах получения оксида скандия. Выбор способа вскрытия (использование серной или азотной кислот, концентрация) определяется, также условиями последующего экстракционного извлечения урана и тория.
Проведено исследование процесса выделения тория из раствора после азотнокислотного растворения первичного концентрата скандия. Установлено, что основной вклад в радиоактивную составляющую вносит изотоп уранового ряда Th-230. Объемная радиоактивность раствора по изотопу Th-230 составляет 1200 Бк/см3. Доля изотопов Ra-226, Ra-228, Th-228 составляет, %: 0, 001; 0, 001; 0, 2. После растворения чернового концентрата получен раствор с концентрациями ~ 5 г/дм3 Sc и ~ 4 г/дм3 Th.
Для выделения тория методом жидкостной экстракции из азотнокислых сред после растворения ЧК скандия в лабораторных условиях изучена возможность применения систем экстрагентов, включающих реагенты из класса нейтральных фосфорорганических соединений на основе Cyanex 923 и ТБФ в керосине.
Для системы Cyanex 923 установлены условия наиболее эффективного избирательного извлечения тория - концентрация азотной кислоты 250-270 г/дм3, соотношение фаз О:В = 1:4 ÷ 5. Коэффициент разделения Th и Sc составил от 34 до 312 в зависимости от концентрации тория и скандия в растворе. Для увеличения степени извлечения тория и снижения потерь скандия рекомендовано увеличить соотношение фаз и количество ступеней экстракции.
Показана принципиальная возможность применения 40 %-ного раствора ТБФ в керосине для снижения радиоактивности скандийсодержащего раствора. При концентрации азотной кислоты 120 г/дм3 удалось снизить активность на 98, 5 %, однако потери Sc при этом составили 26, 5 %. Для снижения потерь скандия и повышения степени очистки от тория рекомендовано повысить концентрацию азотной кислоты в исходном растворе до значения 230-270 г/дм3.
Выполненные исследования по влиянию концентрации HNO3, NH4NO3 на извлечение Th, Sc и Y показали преимущественное извлечение тория 50 %-ным раствором ТБФ в широком диапазоне изменения кислотности и солевого фона исходного раствора. Наиболее благоприятными условиями извлечения тория являются интервал концентраций азотной кислоты 220-290 г/дм3 и нитратов более 4 моль/дм3.
Для дополнительной очистки от тория растворов промежуточных скандийсодержащих продуктов возможно использование смеси 7, 5 % Cyanex 923 + 7, 5 % ТБФ, а также 40 %-ный раствор ТБФ в керосине. В обоих случаях обеспечивается необходимый уровень активности образцов оксида скандия (≤ 1 Бк/г). При этом первый экстрагент обеспечивает процесс разделения Sc и Th при меньшем количестве стадий экстракции (5 стадий) по сравнению со вторым, но при большей степени соэкстракции скандия - до 30 %. Экстрагент 40 % ТБФ обеспечивает очистку от тория при 8 стадиях экстракции, но при меньшем соизвлечении Sc - 14, 2 %.
Полученные результаты очистки скандия от радиоактивных примесей подтвердили эффективность экстракции радионуклидов в системе 40-50 % ТБФ в керосине. Достигнуто остаточное содержание тория в рафинатах экстракции - С(Th) = 5 мг/л без существенных потерь скандия. При этом соотношение Sc и Th в рафинате экстракции радионуклидов увеличилось относительно исходного раствора выщелачивания чернового скандиевого концентрата с 2, 1 до 1500.
Из очищенного от тория раствора были получены образцы оксида скандия соответствующие требованиям ТУ 95.148-77 на оксид скандия с содержанием Sc2О3 99, 0 %.
Химический состав образца оксида скандия приведен в таблице 7.1.
Таблица 7.1 - Химический состав образца оксида скандия (ОС-1)
|
Содержание примесей, в пересчете на оксиды, %, не более | ||
|
ТУ 95.148-77 |
По результатам испытаний | |
|
Железо |
0, 05 |
0, 04 |
|
Алюминий |
0, 01 |
0, 01 |
|
Кальций |
0, 05 |
0, 05 |
|
Медь |
0, 01 |
0, 01 |
|
Кремний |
0, 05 |
0, 05 |
|
Марганец |
0, 01 |
0, 01 |
|
Магний |
0, 01 |
0, 01 |
|
Иттрий |
0, 05 |
0, 05 |
|
Иттербий |
0, 05 |
0, 05 |
|
Цирконий |
0, 1 |
0, 05 |
|
Титан |
0, 05 |
0, 05 |
|
Фосфор |
0, 02 |
0, 01 |
7.11 Разработка инновационной промышленной технологии переработки руд месторождения Томтор
Важная роль в восстановлении отечественной редкоземельной промышленности принадлежит уникальному по запасам Томторскому месторождению.
Разработка инновационной технологии вскрытия руды месторождения Томтор осуществлялась на технологической пробе весом 150 кг. По химическому составу руда пробы ПРТ-3 алюмофосфатная (∑Al2O3 + P2O5 = 25, 97 %). Сумма редкоземельных оксидов вместе с оксидом иттрия составляет 16, 331 %. Содержание Nb2O5 - 8, 51 %, Sc2O3 - 0, 04 %.
Проба представляет собой полиминеральную смесь пирохлора, монацита и минералов группы крандаллита. Рудные минералы образуют тонкодисперсные, тесно сросшиеся агрегаты (размеры индивидов - микроны). Отмечается повышенное содержание пирохлора и монацита. Опыты проводили с использованием оптимальной крупности руды - 0, 044 мм.
Был рекомендован двухстадийный режим щелочного вскрытия рудного материала: при температуре на первой стадии 80 °С, на второй - 110 °С, при этом переходит в раствор ~ 90 % - 91 % фосфора и 98 % - 99 % алюминия. Выход гидратного осадка составляет ~ 60 % от исходного сырья.
Проведены испытания процесса сгущения рудной пульпы перед первой стадией процесса выщелачивания. При добавке флокулянта Praestol 2500 с расходом 5 г/т твердого достигнута удельная производительность 1, 85 т/м2•сут. Установлено, что после первой стадии выщелачивания исходная пульпа с применением флокулянта Alclar 600 с расходом 42 г/т твердого сгущается с удельной производительностью 1, 0 т/м2•сут, а сгущенная пульпа фильтруется под давлением с производительностью до 20 т/м2•цикл.
Для разделения пульпы и промывки осадка, получаемого после второй стадии выщелачивания, рекомендована система трехступенчатой противоточной декантационной промывки с использованием сгустителей и репульпаторов. Достигнута удельная производительность процесса фильтрования под давлением 16, 6 т/м2•цикл.
При переработке щелочных растворов, полученных после двухстадийного выщелачивания, получены следующие продукты:
на первой стадии (в пересчете на 1 т исходной руды):
- фосфат кальция, содержащий 38, 2 % - 38, 5 % Са, 21, 5 % - 21, 9 % Р2О5 в количестве 71, 5 кг/т;
- гидроксид алюминия, (в расчете на сухое вещество) содержит 95, 0 % - 95, 2 % Al(OH)3, 0, 4 % - 0, 6 % SiO2, 0, 05 % - 0, 1 % SO4, полупродукт в количестве 149 кг/т;
- сульфат натрия безводный содержит 30, 4 % Na или 94 % основного вещества, полупродукт в количестве 495 кг/т;
после второй стадии выщелачивания:
- тринатрийфосфат, соответствующий ГОСТ 201-76, в количестве 543 кг/т.
Установлено, что уменьшение помола до - 0, 044 мм положительно сказывается на эффективности последующего процесса растворения гидроксидного кека азотной кислотой и приводит к повышению степени извлечения РЗЭ на 3 % - 4 % и тория на ~8 % - 10 %.
Показано, что по сравнению с процессом при атмосферном давлении, автоклавное выщелачивание позволяет полнее вскрывать гидратный осадок, что приводит к увеличению степени извлечения в раствор как РЗЭ на 8 % - 10 %, так и тория на 14 % - 15 %.
Полученный твердый продукт - черновой Nb-концентрат - имеет следующий состав (%): Nb2O5 - 36, 2 - 36, 4; TiO2 - 15, 4 - 15, 9; Fe - 5, 6 - 6, 0; РЗО - 1, 8 - 2, 0; Al - 0, 17 - 0, 18; P - 1, 4 - 1, 6, в количестве 210-220 кг/т;
Предложена экстракционная технология позволяющая получать:
- концентрат скандия в виде оксида, с содержанием основного вещества 15, 29 % Sc2O3 в количестве 1, 615 кг/т.
- концентрат тория в виде карбонатных солей, полупродукт (подлежащий длительному хранению) с содержанием основного вещества 94, 52 % ThO2 в количестве 2, 040 кг/т;
Разработана технология получения дезактивированного и очищенного от нередкоземельных примесей суммарного концентрата РЗО чистотой не менее 99, 5 % из рафината экстракции Sc и Th. Извлечение РЗО в концентрат на этом переделе составило 99 % - 139, 55 кг/т.
Отходами производства являются сульфатно-гидроксидный осадок (38, 54 кг/т), подлежащий цементации и последующему захоронению и пульпа (дезактивированный раствор + фосфатный осадок), поступающая на хвостохранилище, в количестве 7832, 8 кг/т.
Предложена полная технологическая сема получения вышеуказанных продуктов.
При выборе номенклатуры РМ-продукции наряду с экономическими (стоимостными) соображениями следует руководствоваться и необходимостью обеспечить страну импортируемыми ныне материалами. Разработанная схема предусматривает получение следующей, продукции:
- оксиды элементов легкой группы чистотой не менее 99, 5 % по редкоземельным примесям: CeO2, Pr6O11, Nd2O3;
- оксиды элементов среднетяжелой группы:- чистотой не менее 99, 5 % по редкоземельным примесям - Sm2O3, Eu2O3, Gd2O3, Tb4O7, Dy2O3, Er2O3;
- чистотой не менее 99, 95 % по редкоземельным примесям - Y2O3.
Для получения 10 перечисленных выше оксидов индивидуальных РЗЭ потребуется экстракционное разделение не менее чем по 12 - 13 линиям: La/Ce, Ce/Pr, Pr/Nd, Nd/Sm, Sm/Eu, Eu/Gd, Gd/Tb, Tb/Dy, Dy/Ho, Ho/Er, Er/Tm, Y/RE (RE/Y). Промышленная реализация каждой из линий деления требует экстрагент, обеспечивающий оптимальные условия (параметры) разделения. Ими прежде всего (но не только) являются:
1 - максимальная концентрация РЗЭ в водной фазе;
2 - максимальная емкость экстрагента по РЗЭ;
3 - максимальный коэффициент разделения;
4 - минимальная вязкость экстрагента;
5 - минимальный расход реагентов.
Первое и второе требования направлены на увеличение производительности (снижение объема) экстракционного оборудования. Выполнение третьего условия уменьшает число ступеней (экстракторов) в разделительной части каскада, выполнение четвертого - снижает время отстоя фаз и облегчает их транспортировку от ступени к ступени. Пятое требование направлено на снижение себестоимости переделов.
Перечисленные параметры определяются природой экстрагента и зависят от состава равновесной ему водной фазы. Ни одна из известных экстракционных систем не может обеспечить оптимальные параметры разделения для всех перечисленных выше линий деления.
Выбор экстрагентов для разрабатываемой схемы был сделан на основании результатов выполненных ранее укрупненных исследований и испытаний:
|
Экстрагент |
Линии деления |
|
ТБФ (100 %) |
La/Ce, Ce/Pr, Pr/Nd, Nd/Sm, Er/Y |
|
ИДДФК (1, 0-1, 2 М раствор в УВР) |
Sm/Eu, Gd/Tb, Tb/Dy, Dy/Ho, Y/Er |
|
ТБФ (30 %) - ТАМАН (30 %) - УВР (40 %) |
Eu/Gd |
|
Versatic-10 (1, 8 М раствор в УВР) |
Y/Er |
На рисунке 7.2 представлена блок-схема разделения концентрата РЗМ Томторского месторождения с получением оксидов индивидуальных РЗЭ.
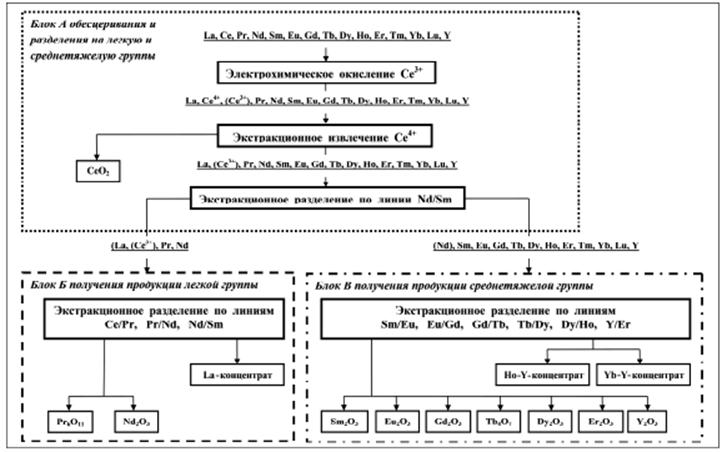
Рисунок 7.2 - Блок-схема разделения концентрата РЗМ Томторского месторождения
Первый передел - выделение Се (45, 8 % масс. в РЗО). Осуществляется электрохимическим окислением Се3+ с последующим экстракционным извлечением Се4+. Наряду с получением товарного цериевого продукта достигается существенное (на ~ 44 %) снижение нагрузки на последующие переделы экстракционного разделения. В рафинате извлечения Се, соответственно, увеличивается содержание остальных РЗЭ, в частности содержание СТР возрастает до ~ 23 %.
Преимущества первоначального выделения церия очевидны. Однако практика многолетней промышленной эксплуатации на заводе Силмет в Эстонии чисто экстракционной схемы выделения церия на 100 % ТБФ с последовательным получением концентратов лантана, церия, неодима и концентрата СТР говорит о том, что такая технология вполне логична. Преимущества одной из этих схем будет определять экономика.
Второй передел - групповое экстракционное разделение обесцеренного суммарного концентрата по линии Nd/Sm на легкую (ЛР, La - Ce) и среднетяжелую (СТР, Sm - Lu + Y) группы. Разделение обеспечивает чистоту получаемого в дальнейшем Nd по элементам среднетяжелой группы (см. рисунок 7.3).
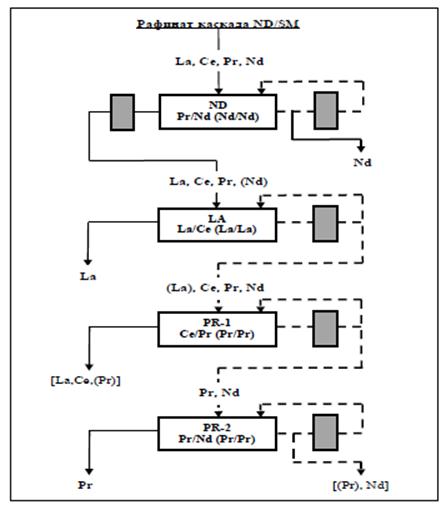
Рисунок 7.3 - Принципиальная экстракционная технологическая схема блока получения продукции легкой группы
Для получения индивидуальных элементов легкой группы (La, Ce, Pr и Nd) необходимо провести экстракционное разделение по четырем линиям - La/Ce, Ce/Pr, Pr/Nd и Nd/Sm (см. рисунок 7.2).
Данные по влиянию составов водных фаз на равновесное распределение индивидуальных РЗЭ между ними и 100 %-ным ТБФ показывают, что порядок экстрагируемости элементов легкой группы и самария не зависит от состава водной фазы и увеличивается в ряду: La < Ce < Pr < Nd < Sm. Коэффициенты разделения βCe/La, βPr/Ce, βNd/Pr и βSm/Nd увеличиваются с ростом концентрации РЗЭ, азотной кислоты и высаливателя (нитрата аммония). Характеристикой суммарной концентрации РЗЭ, азотной кислоты и нитрата аммония может служить концентрация нитрат-аниона: при концентрации NO3-аниона в водной фазе, превышающей 7 M, величины коэффициентов разделения принимают значения:
βCe/La > 2, 0; βPr/Ce > 1, 5; βNd/Pr > 1, 37; βSm/Nd > 1, 8.
На рисунке 7.3 приведена принципиальная экстракционная технологическая схема получения индивидуальных РЗЭ среднетяжелой группы с использованием указанных выше четырех экстрагентов.
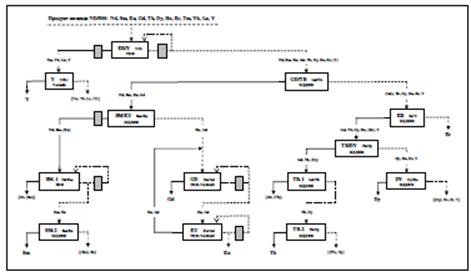
Рисунок 7.3 - Принципиальная технологическая схема блока В разделения РЗЭ среднетяжелой группы
Заключительные положения и рекомендации
В целях разработки настоящего справочника НДТ приказом Росстандарта от 30 декабря 2016 г. N 2060 была сформирована техническая рабочая группа "Производство редких и редкоземельных металлов".
|
Авраамова Елена Арслановна |
ОАО "Уралэлектромедь" |
|
Акимова Нина Петровна |
ОАО "Институт "ГИНЦВЕТМЕТ" |
|
Ануфриева Светлана Ивановна |
ФГБУ "ВИМС" |
|
Барановская Василиса Борисовна |
ИОНХ РАН |
|
Буслаева Татьяна Максимовна |
МИТХТ |
|
Вадуева Лариса Шарпудиевна |
АО "ПитеГОРпроект" |
|
Вардиков Арсен Генрихович |
Росприроднадзор |
|
Воронина Зинаида Николаевна |
ОАО "Институт "ГИНЦВЕТМЕТ" |
|
Галиева Жанетта Николаевна |
ГК "Скайград" |
|
Головин Андрей Валерьевич |
ПАО "Корпорация ВСМПО-АВИСМА" |
|
Гришаев Сергей Иванович |
Минпромторг России |
|
Донецкий Евгений Николаевич |
ГК "Скайград" |
|
Ефремовцев Никита Николаевич |
ИПКОН РАН |
|
Заболотный Владимир Трофимович |
Ростехнадзор |
|
Иванов Владимир Константинович |
ИОНХ РАН |
|
Икрянников Валентин Олегович |
Минпромторг России |
|
Кардаполов Александр Викторович |
АО "ЧМЗ" |
|
Карпов Юрий Александрович |
ИОНХ РАН |
|
Карцев Валентин Ефимович |
АО "Гиредмет" |
|
Комков Алексей Александрович |
АО "ОХК Уралхим" |
|
Комков Виктор Владимирович |
ОАО "СМЗ" |
|
Курошев Илья Сергеевич |
ФГАУ "НИИ "ЦЭПП" |
|
Левченко Елена Николаевна |
ФГУП "ИМГРЭ" |
|
Лиске Антон Александрович |
ФГАУ "НИИ "ЦЭПП" |
|
Лихникевич Елена Германовна |
ФГБУ "ВИМС" |
|
Мельников Сергей Александрович |
АО "ВНИИХТ" |
|
Михеева Екатерина Дмитриевна |
ФГУП "ИМГРЭ" |
|
Сарычев Геннадий Александрович |
АО "Наука и инновации" |
|
Сидоренко Александр Юрьевич |
ЗАО "Кыштымский медеэлектролитный завод" |
|
Синегубова Елена Николаевна |
ФГБУ "ЦУРЭН" |
|
Спиридонов Игорь Геннадиевич |
ФГУП "ИМГРЭ" |
|
Становова Александра Владиславовна |
ФГБНУ "ВНИРО" |
|
Тарасов Андрей Владимирович |
ОАО "Институт "ГИНЦВЕТМЕТ" |
|
Темнов Александр Викторович |
Минприроды России |
|
Тимофеев Константин Леонидович |
ОАО "Уралэлектромедь" |
|
Трубаков Юрий Михайлович |
АО "ВНИИХТ" |
|
Трубин Алексей Геннадьевич |
АО "ТВЭЛ" |
|
Хан Сергей Иванович |
Минпромторг России |
|
Шабалин Антон Валерьевич |
ЗАО "Кыштымский медеэлектролитный завод" |
|
Юков Сергей Анатольевич |
ОАО "Соликамский магниевый завод" |
Для определения условий нормирования отечественных предприятий необходима оценка достигнутых отраслью показателей ресурсо- и энергоэффективности и экологической результативности. В целях сбора информации о применяемых на промышленных предприятиях технологических процессах, оборудовании, об источниках загрязнения окружающей среды, технологических, технических и организационных мероприятиях, направленных на снижение загрязнения окружающей среды и повышение энергоэффективности и ресурсосбережения, были подготовлены анкеты для предприятий, которые были направлены в адреса всех предприятий по производству редких и редкоземельных металлов. В качестве основы для формирования анкеты была использована унифицированная анкета, утвержденная Бюро НДТ.
В связи с тем что обмен информацией был проведен в чрезвычайно сжатые сроки, по ряду показателей при написании справочника НДТ были использованы также зарубежные материалы: справочник Европейского союза по наилучшим доступным технологиям для предприятий цветной металлургии, статистические сборники, результаты научно-исследовательских и диссертационных работ, иные источники, а также информация, полученная в ходе консультаций с экспертами в области производства редких и редкоземельных металлов.
Общее заключение, которое можно сделать в результате подготовки данного справочника, состоит в том, что ведущие отечественные компании активно занимаются внедрением современных технологических процессов и оборудования, разрабатывают программы повышения энергоэффективности и экологической результативности. Однако цели, задачи и ожидаемые результаты перехода к технологическому нормированию на основе НДТ руководители предприятий понимают и оценивают по-разному.
Поэтому важным шагом вперед по пути достижения комплексного предотвращения и контроля загрязнения окружающей среды в промышленности должен стать позитивный обмен информацией.
Для продвижения идеи перехода к НДТ необходимо организовать масштабную информационно-просветительскую кампанию и систему подготовки (повышения квалификации, дополнительного профессионального образования) кадров. Обсуждение сути перемен призвано подготовить к ним предприятия и разъяснить основные мотивы и стимулы экологической модернизации отечественной экономики.
Приложение А
(обязательное)
Сфера распространения справочника НДТ
|
ОКПД 2 |
Наименование продукции по ОК 034-2014 (ОКПД) |
Наименование вида деятельности по ОКВЭД 2 |
ОКВЭД 2 |
|
24.45.30.110 |
Вольфрам и изделия из него, сплавы на основе вольфрама, порошки |
Производство вольфрама |
24.45.4 |
|
24.45.30.111 |
Вольфрам необработанный, включая прутки, изготовленные простым спеканием | ||
|
24.45.30.120 |
Молибден и изделия из него, сплавы на основе молибдена, порошки |
Производство молибдена |
24.45.5 |
|
24.45.30.121 |
Молибден необработанный, включая прутки, изготовленные простым спеканием | ||
|
24.45.30.180 |
Титан и изделия из него, сплавы на основе титана, порошки |
Производство титана |
24.45.2 |
|
24.45.30.181 |
Титан необработанный | ||
|
24.45.30.183 |
Проволока, прутки, профили титановые | ||
|
24.45.30.184 |
Плиты, листы, полосы и ленты титановые | ||
|
24.45.30.186 |
Трубы и трубки титановые | ||
|
24.45.30.188 |
Поковки, штамповки, кольца титановые | ||
|
24.45.30.270 |
Ванадий и изделия из него, порошок |
Производство редких (тантал, ниобий, галлий, германий, иридий) и редкоземельных металлов |
24.45.9 |
|
24.45.30.271 |
Ванадий необработанный | ||
|
24.45.30.230 |
Цирконий и изделия из него, сплавы на основе циркония, порошки | ||
|
24.45.30.231 |
Цирконий необработанный | ||
|
24.45.30.320 |
Ниобий и изделия из него, сплавы на основе ниобия, порошки | ||
|
24.45.30.321 |
Ниобий необработанный | ||
|
24.45.30.130 |
Тантал и изделия из него, сплавы на основе тантала, порошки | ||
|
24.45.30.131 |
Тантал необработанный, необработанный, включая прутки, изготовленные простым спеканием | ||
|
24.45.30.210 |
Бериллий и изделия из него, сплавы на основе бериллия, порошки |
Производство редких (тантал, ниобий, галлий, германий, иридий) и редкоземельных металлов |
24.45.9 |
|
24.45.30.211 |
Бериллий необработанный | ||
|
24.45.30.260 |
Германий и изделия из него, порошки | ||
|
24.45.30.261 |
Германий необработанный | ||
|
24.45.30.280 |
Галлий и изделия из него, сплавы на основе галлия, порошки | ||
|
24.45.30.281 |
Галлий необработанный | ||
|
Индий и изделия из него, порошки | |||
|
Индий необработанный | |||
|
24.45.30.330 |
Рений и изделия из него, порошки | ||
|
24.45.30.331 |
Рений необработанный | ||
|
24.45.30.340 |
Таллий и изделия из него, порошки | ||
|
24.45.30.341 |
Таллий необработанный | ||
|
24.45.30.350 |
Гафний и изделия из него, порошки | ||
|
24.45.30.351 |
Гафний необработанный | ||
|
20.13 |
Вещества химические неорганические основные прочие | ||
|
20.13.21.170 |
Теллур | ||
|
20.13.21.229 |
Селен | ||
|
20.13.23.120 |
Металлы редкоземельные в чистом виде, в смесях, сплавах | ||
|
20.13.23.139 |
Сплавы и лигатуры на основе редкоземельных металлов прочие |
Приложение Б
(обязательное)
Перечень маркерных веществ и технологических показателей
Б.1 Перечень маркерных веществ
Таблица Б.1
|
Для атмосферного воздуха |
Для водных объектов |
|
NO, NO2 (суммарно) |
Алюминий |
|
Аммиак |
Никель |
|
Хлор |
Диоксид титана |
|
Пыль |
Цинк |
Б.2 Перечень технологических показателей при производстве редких и редкоземельных металлов
Таблица Б.2
|
Технологический показатель |
Единица измерения |
Средний уровень выбросов для НДТ* |
|
Выбросы NO, NO2
| ||
|
NO, NO2 (суммарно) |
мг/нм3 |
≤ 60 |
Средний уровень концентраций загрязняющих веществ в прямых сбросах, образующихся при производстве редких и редкоземельных металлов, в принимающие водные объекты (НДТ 10) | ||
|
Алюминий |
мг/л |
0, 3 |
|
Никель |
мг/л |
0, 3 |
|
Диоксид титана |
мг/л |
0, 1 |
|
Цинк |
мг/л |
0, 08 |
Выбросы в воздух пыли (взвешенных веществ) и металлов от подготовки сырья в производстве редких и редкоземельных элементов (НДТ 14) | ||
|
Пыль |
мг/нм3 |
40 |
Выбросы в воздух загрязняющих веществ от загрузки обжига, плавки и получения огарков и спеков в производстве редких и редкоземельных металлов (НДТ 15) | ||
|
NO, NO (суммарно) |
мг/нм3 |
60 |
|
Аммиак |
мг/нм3 |
100 |
|
Пыль |
мг/нм3 |
50 |
|
Хлор |
мг/нм3 |
10-30 |
Выбросы пыли металлосодержащей, образующиеся при выщелачивании, очистке и электролизе (НДТ 27) | ||
|
Пыль |
мг/нм3 |
40 |
Выбросы пыли металлосодержащей, образующиеся при гранулировании и переработке пылевидного сырья (НДТ 32) | ||
|
Пыль |
мг/нм3 |
50 |
Приложение В
(обязательное)
Перечень НДТ
В.1 Общие НДТ для производства редких и редкоземельных металлов
НДТ 1. Повышение общей результативности природоохранной деятельности
НДТ 2. Повышение эффективности использования энергии
НДТ 3. Обеспечение стабильности производственного процесса
НДТ 4. Уменьшение неорганизованных выбросов, образующихся при хранении сырья
НДТ 5. Уменьшение неорганизованных эмиссий, образующихся при обработке и транспортировке сырья
НДТ 6. Предупреждение или сокращение неорганизованных выбросов
НДТ 7. Предотвращение выбросов NO, NO2 от пирометаллургических процессов
НДТ 8. Предотвращение образования сточных вод
НДТ 9. Предотвращение загрязнения незагрязненных вод и сокращение сбросов загрязняющих веществ в водные объекты
НДТ 10. Сокращение сбросов загрязняющих веществ со сточными водами
В.2 НДТ для отдельных этапов производства редких и редкоземельных металлов
НДТ 11. Предотвращение или уменьшение неорганизованных выбросов от подготовки
НДТ 12. Предотвращение или уменьшение неорганизованных выбросов от предварительной обработки материалов при производстве редких и редкоземельных элементов
НДТ 13. Предотвращение или уменьшение неорганизованных выбросов от загрузки сырья редких и редкоземельных металлов до получения огарка или спека
НДТ 14. Сокращение выбросов в воздух пыли (взвешенных веществ) и металлов от подготовки сырья в производстве редких и редкоземельных элементов
НДТ 15. Для сокращения выбросов в воздух пыли (взвешенных веществ) и окислов металлов, за исключением тех, которые направляются на производство серной кислоты или жидкого SO2 от загрузки обжига, плавки и получения огарков и спеков в производстве редких и редкоземельных металлов
НДТ 16. Уменьшение выбросов органических соединений в атмосферу из сушки исходного материала и процесса обжига, спекания и плавки при производстве металлопродуктов редких и редкоземельных металлов
НДТ 17. Сокращение выбросов ПХДД/Ф и ЛОС в воздухе при комбинированных технологиях переработки нетрадиционного сырья редких и редкоземельных элементов
НДТ 18. Предотвращение загрязнения почвы и грунтовых вод, дробления, просеивания и операций классификации
НДТ 19. Предотвращение образования сточных вод при щелочном выщелачивании
НДТ 20. Уменьшение количества отходов, направляемых на захоронение от производства редких и редкоземельных металлов
НДТ 21. Повторное использование или восстановление серной кислоты, полученной от процесса обжига сульфидных концентратов
НДТ 22. Уменьшение количества отходов производства редких и редкоземельных металлов, отправляемых на захоронение
НДТ 23. Уменьшение неорганизованных выбросов пыли, образующихся в процессе подготовки сырья для обжиговой печи и при загрузке в нее этого сырья
НДТ 24. Уменьшение неорганизованных выбросов пыли, образующихся при обработке огарка
НДТ 25. Уменьшение неорганизованных выбросов, образующихся при промывке, разделении твердых и жидких фракций и очистке
НДТ 26. Уменьшение неорганизованных выбросов паров, образующихся при электроизвлечении: использование в электролизерах добавок, особенно пенообразующих агентов.
НДТ 27. Уменьшение выбросов аэрозоля металлосоединений, образующихся при производстве оксидов РЗМ
НДТ 28. Предотвращение загрязнения почвы и грунтовых вод
НДТ 29. Сокращение потребления воды и предотвращения образования сточных вод
НДТ 30. Сокращение объемов образования отходов, предназначенных для конечной утилизации
НДТ 31. Обработка отходов выщелачивания с целью обеспечения их пригодности для конечной утилизации
НДТ 32. Уменьшение выбросов пыли и металлов, образующихся при гранулировании и переработке пылевидного
Приложение В
(обязательное)
Энергоэффективность
Г.1 Краткая характеристика отрасли с точки зрения ресурсо- и энергопотребления
Вопросы использования энергии при оценке НДТ в цветной металлургии в целом и при производстве РМ и РЗМ в частности имеют существенное значение. Так, например, существенная доля в общем производстве РМ и РЗМ обеспечивается за счет вторичных ресурсов. Поскольку удельные прямые выбросы плавильных заводов, перерабатывающих лом, в 3 раза ниже, чем выбросы плавильных заводов, работающих на первичном сырье, изготовление РМ и РЗМ из вторичных материалов исключает выбросы десятки тысяч тонн загрязняющих веществ и CO2.
Основным методом повышения энергоэффективности является использование систем энергоменеджмента, описанных в международном стандарте ISO 50001 или национальном стандарте ГОСТ Р ИСО 50001.
Г.2 Основные технологические процессы, связанные с использованием энергии
Утилизация энергии и тепла широко применяется при производстве РМ и РЗМ. Пирометаллургические процессы обжига, агломерации плавки обычно сопровождаются интенсивным выделением тепла, содержащегося, в частности, в отходящих газах. Поэтому для утилизации тепла используются регенеративные и рекуперативные горелки, теплообменники и котлы. Пар или электроэнергия могут вырабатываться на заводе как для собственного использования, так и для внешних потребителей, например для муниципальных систем отопления, и для подогрева материалов или газообразного топлива. Технологии, применяемые для рекуперации тепла на различных объектах, могут существенно различаться. Их характеристики зависят от целого ряда факторов, таких как эксергетический КПД, возможные направления использования тепла и электроэнергии на промплощадке или рядом с ней, масштаба производства и способности газов или содержащихся в них компонентов откладываться или осаждаться в теплообменниках.
Ниже приведены примеры методов, которые могут быть использованы для применяемых технологических процессов производства РМ и РЗМ.
Горячие газы, образующиеся при плавке или обжиге сульфидных руд, почти всегда проходят через паровые котлы. Получаемый пар может использоваться для производства электроэнергии или для отопления. Помимо генерации электроэнергии, пар используется в процессе сушки материалов, а остаточное тепло используется для предварительного подогрева воздуха, поступающего для поддержания горения в процессах спекания и плавки.
Использование в горелках обогащенного кислородом воздуха или кислорода сокращает потребление энергии за счет возможности энергоемких процессов обжига и плавки. Объемы отходящих газов существенно сокращаются, что позволяет применять вентиляторы меньших размеров и т.п.
Материал футеровки печи может также влиять на энергетический баланс плавки. Имеются данные о положительном эффекте применения легких огнеупорных материалов, снижающих теплопроводность и нагрев производственного помещения. При этом необходимо сбалансировать получаемые от этого выгоды со сроком службы футеровки, инфильтрацией металлов в футеровку.
Производство серной кислоты из диоксида серы, образующегося на стадиях обжига и плавки, - экзотермический процесс, включающий несколько стадий охлаждения газа.
Важным методом является охлаждение отходящих газов перед подачей в рукавный фильтр, поскольку оно обеспечивает температурную защиту фильтра и допускает более широкий выбор материалов для его изготовления. В некоторых случаях на этой стадии возможна утилизация тепла.
Часто практикуется использование тепла газов или пара для увеличения температуры выщелачивающих растворов. В некоторых случаях часть газового потока может отводиться на скруббер для отдачи тепла в воду, которая затем используется для целей выщелачивания. Охлажденный газ затем возвращается в основной поток для дальнейшей очистки.
Преимущества предварительного нагрева воздуха, подаваемого для поддержания горения, подтверждены многими документами. Если воздух подогревается на 400 °C, рост температуры пламени составляет 200 °C, а если предварительный подогрев составляет 500 °C, температура пламени растет на 300 °C. Такое увеличение температуры пламени обеспечивает более высокую эффективность плавки и сокращение потребления энергии. Имеются сведения о регенеративных горелках, подогревающих подаваемый воздух до 900 °C, что сокращает потребление энергии на 70 %. Этот метод хорошо освоен, и достигнутый срок окупаемости составляет менее одного года.
Во многих обстоятельствах предварительная сушка сырья обеспечивает энергосбережение, потому что скрытое тепло, аккумулируемое в образующемся паре, не теряется, кроме того, уменьшается объем газов, следовательно, вентиляторы и газоочистки тоже могут быть меньшими по размеру и потреблять меньше энергии. Горячие газы, улавливаемые над литейными желобами, могут использоваться для поддержания горения.
Поскольку эти методы экономии являются примерами экономии на отдельных компонентах установок, их применение и экономическая эффективность зависят от специфических условий конкретной промышленной площадки и технологического процесса.
Г.3 Уровни потребления
Информация об уровнях потребления сырья, материалов и энергоресурсов при производстве РМ и РЗМ приведена в разделе 3.1.1 справочника (см. таблицы 3.1 - 3.8).
Информация об уровнях потребления сырья, материалов и энергоресурсов при производстве РМ и РЗМ приведена в разделах 3.2 и 3.2.1 справочника (см. таблицы 3.9 - 3.16).
Г.4 Наилучшие доступные технологии, направленные на повышение энергоэффективности и оптимизацию и сокращение ресурсопотребления
Наилучшие доступные технологии для производства РМ и РЗМ, направленные на повышение энергоэффективности и оптимизацию и сокращение ресурсопотребления, приведены в разделе 5: НДТ 2, НДТ 30, НДТ 31, НДТ 32, НДТ 33, НДТ 34.
Г.5 Экономические аспекты реализации НДТ, направленные на повышение энергоэффективности и оптимизацию и сокращение ресурсопотребления
Собственный экономический потенциал природоохранных мероприятий, таких как, например, внедрение малоотходных технологий, производство побочной продукции и (или) полезное использование образующихся в основном производственном процессе отходов в российских условиях следует признать скорее незначительным. С одной стороны, природоохранные технологии во многих случаях характеризуются высокой энергоемкостью, а поддержание оборудования в функциональном состоянии требует регулярных затрат на расходные материалы и комплектующие и иных эксплуатационных затрат; в некоторых случаях при производстве побочной продукции, например, такой как серная кислота, значительные издержки могут возникать и в связи с необходимостью хранения и транспортировки агрессивного вещества. С другой стороны, низкая емкость российских рынков не обеспечивает достаточного спроса для вывода "побочных" производств на экономически эффективный уровень и не сможет гарантировать устойчивое потребление продукции вновь вводимых производственных мощностей, а потенциал выхода на внешние рынки ограничен и малоперспективен с экономической точки зрения.
Таким образом, наибольшим потенциалом с точки зрения возмещения затрат, понесенных в связи с внедрением на предприятии новых природоохранных методов и технологий, обладают комплексные меры, увязывающие экологическую модернизацию производства с перенастройкой производственного процесса в целом, оптимизацией отдельных его звеньев и расширением объемов производства. В этом случае высокие начальные затраты на внедрение интегрированных в производственный процесс природоохранных мер и технологий могут быть в конечном счете возмещены за счет увеличения объемов производимой продукции, повышения эффективности и снижения удельных эксплуатационных расходов. Однако на практике обособление "экологической составляющей" в рамках таких "встроенных" в технологический процесс мероприятий на фоне других капитальных и эксплуатационных расходов представляет собой достаточно сложную задачу.
Библиография
[1] Федеральный закон от 10.01.2002 N 7-ФЗ "Об охране окружающей среды" (в ред. от 03.07.2016 с изм. и доп., вступ. в силу с 01.03.2017).
[2] ГОСТ Р 56828.14-2016 Наилучшие доступные технологии. Структура информационно-технического справочника. - М., 2016.
[3] ГОСТ Р 56828.13-2016 Наилучшие доступные технологии. Формат описания технологий. - М., 2016.
[4] ГОСТ Р 56828.15-2016 Наилучшие доступные технологии. Термины и определения. - М., 2016.
[5] Правила определения технологии в качестве наилучшей доступной технологии, а также разработки, актуализации и опубликования информационно-технических справочников по наилучшим доступным технологиям. Утверждены постановлением Правительства Российской Федерации от 23 декабря 2014 г. N 1458.
[6] Методические рекомендации по определению технологии в качестве наилучшей доступной технологии. Утверждены приказом Министерства промышленности и торговли Российской Федерации от 31 марта 2015 г. N 665.
[7] Распоряжение Правительства Российской Федерации от 31 октября 2014 г. N 2178-р "О поэтапном графике создания в 2015-2017 гг. справочников наилучших доступных технологий".
[8] Рубидий. Свойства химических элементов (интернет-ресурс http://chem100.ru/elem.php?n=37).
[9] О цезии на сайте Российского нефтяного союза (http://www.centrrns.ru/cvetmet/caesium).
[10] Месторождение титана http://www.cmmarket.ru/markets/tiworld.htm.
[11] Месторождение титана http://miningmedia.ru/ru/article/ekonomic/559-perspektivy-osvoeniya-titan ovogo-syrya-v-rossii.
[12] Редкий ниобий на редкоземельном рынке//Металлургический бюллетень.
[13] Audi G., Bersillon O., Blachot J., Wapstra A.H. The NUBASE evaluation of nuclear and decay properties//Nuclear Physics A. - 2003.
[16] Химическая энциклопедия: в 5 т. - М.: Советская энциклопедия, 1995. - Т. 4.
[19] Мохосоев, М.В., Базарова, Ж.Г. Сложные оксиды молибдена и вольфрама с элементами I-IV групп. - М., 1990.
[20] Глинка, Н.Л. Общая химия. - М.: "Химия", 1977.
[21] Кременецкий, А. Завод на вулкане//Белоконева О. Журнал "Наука и жизнь". - Наука и жизнь, 2000. - N 11.
[22] Коровин, С.С., Букин, В.И., Федоров, П.И., Резник, А.М. Редкие и рассеянные элементы/Под общ. ред. Коровина С.С. - Химия и технология. - М.: МИСИС, 2003.
[23] Редкол.: Зефиров, Н.С. (гл. ред.). Химическая энциклопедия: в 5 т. - М.: Советская энциклопедия, 1995.
[24] Карелин В.А., Карелин А.И. Фторидная технология переработки концентратов редких металлов: Монография - 221 c: Изд-во НТЛ, 2004.
[25] Редкол.: Кнунянц И.Л. (гл. ред.). Химическая энциклопедия: в 5 т. - М.: Советская энциклопедия, 1988.
[26] Тарасов А.В. Производство цветных металлов и сплавов: Справочник в 3 т. Производство легких, редких цветных и драгоценных металлов. - М.: ИКЦ "Академкнига", 2007.
[27] Тарасов А.В. Минеральное сырье, новые технологии и развитие производства тугоплавких редких металлов в России и странах СНГ//Цветные металлы - 2011. - N 6.
[28] Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O'Connor, Thomas Walczyk, Shige Yoneda, Xiang-Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.)//Pure and Applied Chemistry. - 2013.
[29] Hakobyan K.Y., Tarasov A.V., Kovgan P.A New technology for the treatment of molybdenum sulfide concentrates//Vanced processing of metals and materials - 2006.
[30] Larry D. Cunningham. USGS Minerals Information: Niobium (Columbium) and Tantalum. - 2012.
[31] Гедгагов Э.И., Тарасов А.В., Гиганов В.Г., Лунькова М.А. Разработка инновационной сорбционно-экстракционной технологии получения высокочистых (99, 99 %) соединений редкоземельных металлов при переработке суммарных концентратов (на примере легкой группы)//Цветные металлы. - 2017. - N 8.
[32] Окунев А.И., Кирр Л.Д., Скопов Г.В. Извлечение германия и других элементов-спутников из пыли медеплавильного производства (к 50-летию со дня внедрения технологии).
(Нет голосов) |
-
12.04.2024
Названы города России с самым доступным жильем
 Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
-
12.04.2024
Россиянам назвали лучшее время для продажи дачи
 Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
-
12.04.2024
Предсказано будущее рынка жилья в России
 «МК»: в России не отменят льготную ипотеку
«МК»: в России не отменят льготную ипотеку
-
12.04.2024
В Москве подешевела аренда квартир
 Аренда квартир в Москве подешевела на 10 %
Аренда квартир в Москве подешевела на 10 %
-
22.03.2024
Хуснуллин назвал необходимый размер ставки по ипотеке
 Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов