Утв. и введен в действие постановлением Государственного комитета стандартов Совета Министров СССР от 25 октября 1972 г. N 1967
Государственный стандарт СССР ГОСТ 18190-72
"ВОДА ПИТЬЕВАЯ. МЕТОДЫ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ОСТАТОЧНОГО АКТИВНОГО ХЛОРА"
Drinking water. Methods for determination of chlorine residual content
Дата введения 1 января 1974 г.
Введен впервые
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания остаточного активного хлора.
1. Методы отбора проб
1.1. Пробы воды отбирают по ГОСТ 4979-49 и ГОСТ 2874-82.
1.2. Объем пробы воды для определения содержания активного хлора не должен быть менее 500 мл.
1.3. Пробы воды не консервируют. Определение следует проводить немедленно после отбора пробы.
2. Йодометрическии метод
2.1. Сущность метода
Метод основан на окислении йодида активным хлором до йода, который титруют тиосульфатом натрия. Озон, нитриты, окись железа и другие соединения в кислом растворе выделяют йод из йодистого калия, поэтому пробы воды подкисляют буферным раствором с рН 4, 5.
Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0, 3 мг/л при объеме пробы 250 мл. Метод может быть рекомендован также для окрашенных и мутных вод.
2.2. Аппаратура, материалы и реактивы
Посуда мерная лабораторная стеклянная по ГОСТ 1770-74 и ГОСТ 20292-74 вместимостью: колбы мерные 100 и 1000 мл; пипетки без делений 5, 10, 25 мл; бюретка с краном 25, 50 мл; микробюретка 5 мл.
Колбы конические с пришлифованными пробками вместимостью 250 мл по ГОСТ 25336-82.
Калий йодистый по ГОСТ 4232-74, х.ч. в кристаллах.
Вода дистиллированная по ГОСТ 6709-72.
Хлороформ (трихлорметан).
Кислота салициловая.
Кислота уксусная ледяная по ГОСТ 61-75.
Калий двухромовокислый по ГОСТ 4220-75.
Кислота серная по ГОСТ 4204-77.
Крахмал растворимый по ГОСТ 10163-76.
Натрий углекислый кристаллический по ГОСТ 84-76.
Натрий серноватисто-кислый (тиосульфат натрия) по нормативно-технической документации.
Все реактивы, используемые в анализе, должны быть квалификации чистые для анализа (ч.д.а.).
2.3. Подготовка к анализу
2.3.1. Приготовление 0, 1 н раствора серноватисто-кислого натрия
25 г тиосульфата натрия Na2S2O3·5H2O растворяют в свежепрокипяченной и охлажденной дистиллированной воде, добавляют 0, 2 г углекислого натрия (Na2CO3) и доводят объем до 1 л.
2.3.2. Приготовление 0, 01 н раствора серноватисто-кислого натрия
100 мл 0, 1 н раствора тиосульфата натрия разбавляют свежепрокипяченной и охлажденной дистиллированной водой, добавляют 0, 2 г углекислого натрия и доводят раствор до 1 л. Раствор применяют при содержании активного хлора в пробе более 1 мг/л.
2.3.3. Приготовление 0, 005 н раствора серноватисто-кислого натрия
50 мл 0, 1 н раствора тиосульфата натрия разбавляют свежепрокипяченной и охлажденной дистиллированной водой, добавляют 0, 2 г углекислого натрия и доводят раствор до 1 л. Раствор применяют при содержании активного хлора в пробе менее 1 мг/л.
2.3.4. Приготовление 0, 01 н раствора двухромовокислого калия
0, 4904 г двухромовокислого калия K2Cr2O7, взвешенного с точностью до ±0, 0002 г, перекристаллизованного и высушенного при 180°С до постоянной массы, растворяют в дистиллированной воде и доводят объем до 1 л.
2.3.5. Приготовление 0, 5%-ного раствора крахмала
0, 5 г растворимого крахмала смешивают с небольшим объемом дистиллированной воды, приливают к 100 мл кипящей дистиллированной воды и кипятят несколько минут. После охлаждения консервируют, добавляя хлороформ или 0, 1 г салициловой кислоты.
2.3.6. Приготовление буферного раствора рН 4, 5
102 мл 1 М уксусной кислоты (60 г ледяной уксусной кислоты в 1 л воды) и 98 мл 1 М раствора уксусно-кислого натрия (136, 1 г уксусно-кислого натрия CH3COONa·3H2O в 1 л воды) наливают в мерную колбу вместимостью 1 л и доводят до метки дистиллированной водой (предварительно прокипяченной и охлажденной до 20°С, свободной от двуокиси углерода).
2.3.7. Поправочный коэффициент 0, 01 н раствора серноватисто-кислого натрия определяют по 0, 01 н раствору двухромовокислого калия следующим образом: в коническую колбу с пришлифованной пробкой помещают 0, 5 г йодистого калия, проверенного на отсутствие йода, растворяют в 2 мл дистиллированной воды, прибавляют 5 мл серной кислоты (1:4), затем 10 мл 0, 01 н раствора двухромовокислого калия, добавляют 80 мл дистиллированной воды, закрывают колбу пробкой, перемешивают и ставят в темное место на 5 мин. Выделившийся йод титруют тиосульфатом натрия в присутствии 1 мл крахмала, прибавленного в конце титрования.
2.3.8. Поправочный коэффициент (К) (0, 01; 0, 005 н растворов серноватисто-кислого натрия) вычисляют по формуле
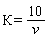
,
где v - количество серноватисто-кислого натрия, израсходованное на титрование, мл.
2.4. Проведение анализа
В коническую колбу насыпают 0, 5 г йодистого калия, растворяют его в 1-2 мл дистиллированной воды, затем добавляют буферный раствор в количестве, приблизительно равном полуторному значению щелочности анализируемой воды, после чего добавляют 250-500 мл анализирумой воды. Выделившийся йод оттитровывают 0, 005 н раствором тиосульфата натрия из микробюретки до появления светло-желтой окраски, после чего прибавляют 1 мл 0, 5%-ного раствора крахмала и раствор титруют до исчезновения синей окраски. При определении щелочности воду предварительно дехлорируют с помощью тиосульфата натиря в отдельной пробе.
При концентрации активного хлора менее 0, 3 мг отбирают для титрования большие объемы воды.
2.5. Обработка результатов
Содержание суммарного остаточного хлора (X), мг/л, вычисляют по формуле
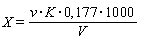
,
где v - количество 0, 005 н раствора тиосульфата натрия, израсходованное на титрование, мл;
K - поправочный коэффициент нормальности раствора тиосульфата натрия;
0, 177 - содержание активного хлора, соответствующее 1 мл 0, 005 н раствора тиосульфата натрия;
V - объем пробы воды, взятый для анализа, мл.
3. Метод определения свободного остаточного хлора титрованием метиловым оранжевым
3.1. Сущность метода
Метод основан на окислении свободным хлором метилового оранжевого, в отличие от хлораминов, окислительный потенциал которых недостаточен для разрушения метилового оранжевого.
3.2. Аппаратура, материалы, реактивы
Посуда мерная лабораторная стеклянная по ГОСТ 1770-74 и ГОСТ 20292-74 вместимостью: колбы мерные 100 и 1000 мл; микробюретка с краном 5 мл.
Капельница по ГОСТ 25336-82.
Чашки фарфоровые выпарительные по ГОСТ 9147-80.
Кислота соляная по ГОСТ 3118-77, плотностью 1, 19 г/см3.
Метиловый оранжевый (пара-диметиламино-азобензолсульфокислый натрий) по ТУ 6-09-5171-84.
Вода дистиллированная по ГОСТ 6709-72.
Все реактивы, применяемые для анализа, должны быть квалификации чистые для анализа (ч.д.а.).
3.3. Подготовка к анализу
3.3.1. Приготовление 0, 005-ного раствора метилового оранжевого
50 мг метилового оранжевого растворяют в дистиллированной воде в мерной колбе и доводят дистиллированной водой до 1 л, 1 мл этого раствора соответствует 0, 0217 мг свободного хлора.
3.3.2. Приготовление 5 н раствора соляной кислоты
В мерную колбу наливают дистиллированную воду, затем медленно добавляют 400 мл соляной кислоты HCI и доводят дистиллированной водой до 1 л.
3.4. Проведение анализа
100 мл анализируемой воды помещают в фарфоровую чашку, добавляют 2-3 капли 5 н раствора соляной кислоты и, помешивая, быстро титруют раствором метилового оранжевого до появления неисчезающей розовой окраски.
3.5. Обработка результатов
Содержание свободного остаточного хлора (X1), мг/л, вычисляют по формуле
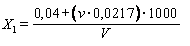
,
где v - количество 0, 005%-ного раствора метилового оранжевого, израсходованное на титрование, мл;
0, 0217 - титр раствора метилового оранжевого;
0, 04 - эмпирический коэффициент;
V - объем воды, взятый для анализа, мл.
По разности между содержанием суммарного остаточного хлора, определенного йодометрическим методом, и содержанием свободного остаточного хлора, определенного методом титрования метиловым оранжевым, находят содержание хлораминового хлора (X2)
X2=X-X1.
4. Метод раздельного определения свободного хлора, связанного монохлорамина и дихлорамина по методу Пейлина
4.1. Сущность метода
Метод основан на способности разных видов хлора превращать в определенных условиях восстановленную бесцветную форму диэтилпарафенилендиамина в полуокисленную окрашенную форму, которую восстанавливают опять до бесцветной ионами двухвалентного железа. Используются серия титрований раствором соли Мора для определения свободного хлора, монохлорамина и дихлорамина в присутствии диэтилпарафенилендиамина как индикатора. Свободный хлор образует окраску индикатора в отсутствии йодистого калия, монохлорамин дает окраску в присутствии очень маленьких количеств йодистого калия (2-3 мг), а дихлорамин образует окраску лишь в присутствии больших количеств KI (около 1 г) и при стоянии раствора в течение 2 мин. По количеству раствора соли Мора, израсходованному на титрование, определяют содержание того вида активного хлора, за счет которого образуется окрашенная форма индикатора.
4.2. Аппаратура, материалы, реактивы
Посуда мерная, стеклянная лабораторная по ГОСТ 1770-74 и ГОСТ 20292-74 вместимостью: колбы мерные 100 и 1000 мл; цилиндры мерные 5 и 100 мл; микробюретки 1 и 2 мл.
Колбы конические вместимостью 250 мл; склянки из темного стекла вместимостью 100 - 200 мл.
Двойная серно-кислая соль закиси железа и аммония (соль Мора) по ГОСТ 4208-72.
Калий йодистый по ГОСТ 4232-74.
Калий фосфорно-кислый однозамещенный по ГОСТ 4198-75, x. ч.
Кислота серная по ГОСТ 4204-77.
Натрий фосфорно-кислый двузамещенный безводный по ГОСТ 11773-76.
Трилон Б (комплексен III, двунатриевая соль этилендиаминтетрауксусной кислоты) по ГОСТ 10652-73.
Вода дистиллированная по ГОСТ 6709-72.
Диэтилпарафенилендиамин оксалат или сульфат.
Все реактивы, применяемые для анализа, должны быть квалификации чистые для анализа (ч.д.а.).
4.3. Подготовка к анализу
4.3.1. Приготовление стандартного раствора соли Мора
1, 106 г соли Мора Fe(NH4)2(SO4)2·6H2O растворяют в дистиллированной воде, подкисляют 1 мл 25%-ного раствора серной кислоты H2SO4 и доводят свежепрокипяченной и охлажденной дистиллированной водой до 1 л. 1 мл раствора соответствует 0, 1 мг активного хлора. Если определение проводится в 100 мл воды, то количество миллилитров соли Мора, израсходованное на титрование, соответствует мг/л хлора, или монохлорамина или дихлорамина. Раствор устойчив в течение месяца. Хранить его следует в темном месте.
4.3.2. Приготовление фосфатного буферного раствора
К 2, 4 г фосфорно-кислого натрия двузамещенного Na2HPO4 и 4, 6 г фосфорно-кислого калия однозамещенного KH2PO4 приливают 10 мл 0, 8%-ного раствора трилона Б и доводят дистиллированной водой до 100 мл.
4.3.3. Приготовление индикатора диэтилпарафенилендиамин (оксалат или сульфат) 0, 1-ного раствора
0, 1 г диэтилпарафенилендиамина оксалата (или 0, 15 г сульфата) растворяют в 100 мл дистиллированной воды с добавлением 2 мл 10%-ного раствора серной кислоты. Раствор индикатора следует хранить в склянке из темного стекла.
4.4. Проведение анализа
4.4.1. Определение содержания свободного хлора
В коническую колбу для титрования помещают 5 мл фосфатного буферного раствора, 5 мл раствора диэтилпарафенилендиамина оксалата или сульфата и приливают 100 мл анализируемой воды, раствор перемешивают. В присутствии свободного хлора раствор окрашивается в розовый цвет, его быстро титруют из микробюретки стандартным раствором соли Мора до исчезновения окраски, энергично перемешивая. Расход соли Мора на титрование (А, мл) соответствует содержанию свободного хлора, мг/л.
При наличии в анализируемой воде значительных количеств свободного хлора (более 4 мг/л) для анализа следует брать менее 100 мл воды, так как большие количества активного хлора могут полностью разрушить индикатор.
4.4.2. Определение содержания монохлорамина
В колбу с оттитрованным раствором добавляют кристаллик (2-3 мг) йодистого калия, раствор перемешивают. В присутствии монохлорамина мгновенно появляется розовая окраска, которую тотчас же оттитровывают стандартным раствором соли Мора. Количество миллилитров соли Мора, пошедших на титрование (В, мл), соответствует содержанию монохлорамина, мг/л.
4.4.3. Определение содержания дихлорамина
К оттитрованному раствору после определения содержания монохлорамина вновь добавляют около 1 г йодистого калия, перемешивают до растворения соли и оставляют раствор стоять в течение 2 мин. Появление розовой окраски свидетельствует о наличии в воде дихлорамина. Раствор титруют стандартным раствором соли Мора до исчезновения окраски. Расход соли Мора (С, мл) соответствует содержанию дихлорамина, мг/л.
4.5. Обработка результатов
Содержание суммарного остаточного активного хлора (X3), мг/л, вычисляют по формуле
X3=A+B+C,
где А - содержание свободного хлора, мг/л;
В - содержание монохлорамина, мг/л;
С - содержание дихлорамина, мг/л.
![]() — Все документы — ГОСТы — ГОСТ 18190-72 ВОДА ПИТЬЕВАЯ. МЕТОДЫ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ОСТАТОЧНОГО АКТИВНОГО ХЛОРА
— Все документы — ГОСТы — ГОСТ 18190-72 ВОДА ПИТЬЕВАЯ. МЕТОДЫ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ОСТАТОЧНОГО АКТИВНОГО ХЛОРА Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
Банкир Хотимский объяснил слухи о заморозке вкладов в России идеей застройщиков
 Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
Эксперт по ЖКХ Бондарь: За нескошенную траву дачникам грозит штраф до 50 тысяч
 Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
Экс-глава ЦБ Дубинин: В России никогда не откажутся от наличных рублей
 Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
Комитет ГД поддержал продление на три года эксперимента по исламскому банкингу
 Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии
Депутат Бессараб: Россияне с зарплатой в конвертах могут остаться без пенсии