РД 52.24.530-2016 МАССОВАЯ КОНЦЕНТРАЦИЯ АММОНИЙНОГО АЗОТА В ВОДАХ. МЕТОДИКА ИЗМЕРЕНИЙ ФОТОМЕТРИЧЕСКИМ МЕТОДОМ В ВИДЕ ПРОИЗВОДНЫХ ИНДОФЕНОЛА С САЛИЦИЛАТНЫМ РЕАГЕНТОМ
 Администратор
Администратор
 24.01.2020
24.01.2020
Дата введения - 10 июля 2017 г.
Введен впервые
Введение
Аммонийный азот в водах находится, главным образом, в растворенном состоянии в виде ионов аммония и недиссоциированных молекул NH3·H2O, количественное соотношение которых имеет важное экологическое значение и определяется величиной рН и температурой воды. В то же время некоторая часть аммонийного азота может мигрировать в сорбированном состоянии на минеральных и органических взвесях, а также в виде различных комплексных соединений.
Присутствие в незагрязненных поверхностных водах ионов аммония связано, главным образом, с процессами биохимического разложения белковых веществ, мочевины, дезаминирования аминокислот. Естественными источниками аммиака служат прижизненные выделения гидробионтов. Кроме того, ионы аммония могут образовываться в результате анаэробных процессов восстановления нитратов и нитритов.
Источником антропогенного загрязнения водных объектов ионами аммония являются сточные воды многих отраслей промышленности, бытовые сточные воды, стоки с сельскохозяйственных угодий.
Сезонные колебания концентрации ионов аммония характеризуются обычно понижением весной и в начале лета, в период интенсивной фотосинтетической деятельности фитопланктона, и повышением в конце лета - начале осени при усилении процессов бактериального разложения органического вещества в периоды отмирания водных организмов, особенно в зонах их скопления: в придонном слое водоема, в слоях повышенной плотности фито- и бактериопланктона. В осенне-зимний период повышенное содержание ионов аммония связано с продолжающейся минерализацией органических веществ в условиях слабого потребления фитопланктоном и уменьшения скорости биохимического окисления из-за низких температур.
Ионы аммония в водной среде неустойчивы. В присутствии кислорода они легко подвергаются биохимическому и фотохимическому окислению до нитритов, затем до нитратов. По этой причине в малозагрязненных водных объектах обычно содержание аммонийного азота не превышает тысячных долей мг/дм3, иногда повышаясь до сотых долей в осенне-зимний период. В некоторых водных объектах, содержащих значительное количество органического вещества, в конце длительного подледного периода при дефиците кислорода содержание аммонийного азота может возрастать до десятых долей мг/дм3. Повышенное содержание ионов аммония указывает на ухудшение санитарного состояния водного объекта, причем, поскольку аммиак более токсичен, чем ионы аммония, опасность аммонийного азота для гидробионтов возрастает с повышением рН воды.
Увеличение концентрации аммонийного азота в весенне-летний период, как правило, является показателем свежего загрязнения.
Для водных объектов рыбохозяйственного значения предельно допустимая концентрация (ПДК) ионов аммония 0,4 мг/дм3, аммиака - 0,04 мг/дм3 по азоту; для объектов хозяйственно-питьевого и культурно-бытового назначения ПДК в пересчете на азот равна 1,5 мг/дм3.
1.1 Настоящий руководящий документ устанавливает методику измерений (далее - методика) массовой концентрации аммонийного азота в пробах природных и очищенных сточных вод любой минерализации в диапазоне от 0,020 до 1,00 мг/дм3 фотометрическим методом в виде производных индофенола с салицилатным реагентом.
1.2 Допускается выполнение измерений в пробах с массовой концентрацией аммонийного азота, превышающей 1,00 мг/дм3, при разбавлении пробы безаммиачной водой таким образом, чтобы его концентрация в разбавленной пробе находилась в пределах диапазона, указанного в 1.1.
1.3 Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы:
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 31861-2012 Вода. Общие требования к отбору проб
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
МИ 2881-2004 Рекомендация. Государственная система обеспечения единства измерений. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа.
Примечания
1 Ссылки на остальные нормативные документы приведены в разделах 4, В.3 и В.4.
2 При пользовании настоящим руководящим документом рекомендациями целесообразно проверять действие ссылочных нормативных документов:
- национальных стандартов - в информационной системе общего пользования - на официальном сайте национального органа Российской Федерации по стандартизации в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году;
- нормативных документов Росгидромета и типовых нормативных документов - по РД 52.18.5 и дополнений к нему - ежегодно издаваемым информационным указателям нормативных документов.
3 Если ссылочный нормативный документ заменен (изменен), то при пользовании настоящим руководящим документом следует руководствоваться замененным (измененным) нормативным документом. Если ссылочный нормативный документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
|
Диапазон измерения массовых концентраций аммонийного азота X, мг/дм3 |
Показатель повторяемости (среднеквадратическое отклонение повторяемости) σr, мг/дм3 |
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости) σR, мг/дм3 |
Показатель правильности (границы систематической погрешности) ±Δc, мг/дм3 |
Показатель точности (границы погрешности) ±Δ, мг/дм3 |
|
От 0,020 до 0,100 включ. |
0,001+0,003·X |
0,002 |
0,002 |
0,007 |
|
Св. 0,100 до 1,00 включ. |
0,019·X |
0,023·X |
0,043·X |
При выполнении измерений в пробах с массовой концентрацией аммонийного азота свыше 1,00 мг/дм3 после соответствующего разбавления границы погрешности измерения массовой концентрации аммонийного азота в исходной пробе находят по формуле
±Δ=(±Δ1)·η, (1)
где ±Δ1 - показатель точности измерения массовой концентрации аммонийного азота в разбавленной пробе, рассчитанной по зависимости, приведенной в таблице 1;
η - степень разбавления.
Предел обнаружения аммонийного азота 0,006 мг/дм3.
3.2 Значения показателя точности методики используют при:
- оформлении результатов измерений, выдаваемых лабораторией;
- оценке деятельности лабораторий на качество проведения измерений;
- оценке возможности использования результатов измерений при реализации методики измерений в конкретной лаборатории.
4.1.1 Фотометр или спектрофотометр любого типа (КФК-3, КФК-2, КФК-3-01, СФ-46, СФ-56, ПЭ-5400, Unico 1200 и др.)
4.1.2 Весы лабораторные высокого (II) класса точности по ГОСТ Р 53228-2008, максимальная нагрузка не более 200 г, дискретность отсчета не более 0,0002 г.
4.1.3 Весы лабораторные среднего (III) класса точности по ГОСТ Р 53228-2008, максимальная нагрузка не более 500 г, дискретность отсчета 0,001 г, максимальная нагрузка не более 1500 г, дискретность отсчета 0,01 г.
4.1.4 рН-метр или иономер любого типа (рН-150, рН-155, Экотест-2000, Анион-410 и др.) с электродами для измерения рН.
4.1.5 Государственный стандартный образец состава водных растворов ионов аммония ГСО 7259-96 (далее - ГСО).
4.1.6 Колбы мерные 2-го класса точности исполнения 2, 2а по ГОСТ 1770-74 вместимостью: 100 см3 - 13 шт., 250 см3 - 1 шт., 500 см3 - 1 шт., 1000 см3 - 1 шт.
4.1.7 Пипетки градуированные 2-го класса точности исполнения 1, 2 по ГОСТ 29227-91 вместимостью: 1 см3 - 6 шт., 2 см3 - 3 шт., 5 см3 - 4 шт.
4.1.8 Пипетки с одной отметкой 2 класса точности исполнения 2 по ГОСТ 29169-91 вместимостью: 5 см3 - 1 шт., 10 см3 - 3 шт., 20 см3 - 1 шт.
4.1.9 Дозатор пипеточный ДПОФц - 100-1000 по ТУ 9452-002-3318998-2002 - 2 шт. и дозатор пипеточный ДПОФц - 1000-5000 по ТУ 9452-002-3318998-2002 - 1 шт.
4.1.10 Бюретка 2-го класса точности исполнения 3 по ГОСТ 29251-91 вместимостью 25 см3 - 1 шт.
4.1.11 Цилиндры мерные исполнения 1, 3 по ГОСТ 1770-74 вместимостью: 10 см3 - 2 шт., 25 см3 - 3 шт., 100 см3 - 3 шт., 250 см3 - 1 шт., 1000 см3 - 1 шт.
4.1.12 Мензурка по ГОСТ 1770-74 вместимостью 250 см3 - 1 шт.
4.1.13 Колбы конические Кн исполнения 2 по ГОСТ 25336-82 с притертыми стеклянными или пластиковыми пробками вместимостью: 50 см3 - 50 шт., 250 см3 - 2 шт.
4.1.14 Воронка лабораторная типа В по ГОСТ 25336-86 диаметром 56 мм.
4.1.15 Стаканы В-1, ТХС, по ГОСТ 25336-82 вместимостью: 50 см3 - 3 шт., 100 см3 - 1 шт., 250 см3 - 2 шт., 1000 см3 - 2 шт., 2 дм3 - 1 шт.
4.1.16 Стаканчики для взвешивания (бюксы) СВ-19/9 и СВ-24/10 по ГОСТ 25336-82 - 6 шт.
4.1.17 Воронка капельная ВК по ГОСТ 25336-82 вместимостью 50 см3.
4.1.18 Колба круглодонная с отводом типа КП или КРП исполнения 2 по ГОСТ 25336-82 вместимостью 250 см3.
4.1.19 Склянки для промывания газов типа СН исполнения 1, 2 по ГОСТ 25336-82 вместимостью: 100 см3 - 2 шт., 200 см3 - 1 шт.
4.1.20 Колонка стеклянная с краном и пористой пластиной высотой 50-60 см, диаметром 2-4 см (см. рисунок 1) или бюретка с прямым кра ном вместимостью 50 см3 с прокладкой из стеклоткани или стекловаты исполнения 1 по ГОСТ 29251-91 - 1 шт.
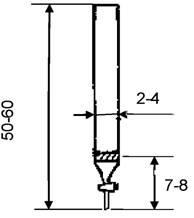
Размеры даны в сантиметрах
Рисунок 1 - Колонка
4.1.21 Пестик N 1 по ГОСТ 9147-80 диаметром 22 мм и высотой 90 мм.
4.1.22 Эксикатор исполнения 2 с диаметром корпуса 190 мм по ГОСТ 25336-82.
4.1.23 Устройство для фильтрования проб с использованием мембранных или бумажных фильтров.
4.1.24 Шкаф сушильный общелабораторного назначения.
4.1.25 Плитка электрическая с закрытой спиралью и регулируемой мощностью нагрева по ГОСТ 14919-83.
Примечание - Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в 4.1.
4.2.1 Аммоний хлористый (хлорид аммония), х.ч. по ГОСТ 3773-72, (при отсутствии ГСО).
4.2.2 Натрий салициловокислый (салицилат натрия) NaC7H5O3, ч. по ГОСТ 17628-72, или салициловокислый калий KC7H5O3, ч. по ТУ 6-09-05-77-74, или салициловая кислота C7H6O3, ч.д.а., фармацевтическая или импортная.
4.2.3 Натрий пентацианонитрозилферрат (II) 2-водный (нитропруссид натрия) Na2[Fe(CN)5NO]·2H2O, ч.д.а. по ТУ 6-094224-76.
4.2.4 Натрий лимоннокислый 5,5-водный (цитрат натрия) Na3C6H5O7·5H2O, ч.д.а. по ГОСТ 22280-76.
4.2.5 Дихлоризоцианурат натрия, имп. или таблетки "Жавель Солид" фирмы "JASOL" или таблетки "Хлоритэкс" фирмы "Маркопул кемиклс" или таблетки "Жавельон/НовелтиХлор" фирмы "Етс. Линосье" или калий марганцовокислый (перманганат калия), ч.д.а. по ГОСТ 20490-75.
4.2.6 Калий йодистый (йодид калия), ч.д.а. по ГОСТ 4232-74.
4.2.7 Калий двухромовокислый (дихромат калия), х.ч. по ГОСТ 4220-75, или калий двухромовокислый, стандарт-титр 0,1 моль/дм3 количества вещества эквивалента (далее - КВЭ) по ТУ 6-09-2540-72.
4.2.8 Натрий серноватистокислый (тиосульфат натрия) 5-водный, ч.д.а. по ГОСТ 27068-86 или натрий серноватистокислый, стандарт-титр 0,1 моль/дм3 КВЭ по ТУ 6-09-2540-72.
4.2.9 Хлорид кальция безводный, ч. по ТУ 6-09-4711-81, (для эксикатора).
4.2.10 Натрия гидроокись (гидроксид натрия), ч.д.а. по ГОСТ 4328-77.
4.2.11 Натрий хлористый (хлорид натрия), х.ч. по ГОСТ 4233-77.
4.2.12 Кислота соляная, ч.д.а. по ГОСТ 3118-77.
4.2.13 Кислота серная, ч.д.а. по ГОСТ 4204-77.
4.2.14 Кислота уксусная, ч.д.а. по ГОСТ 61-75.
4.2.15 Крахмал растворимый, ч.д.а. по ГОСТ 10163-76.
4.2.16 Хлороформ по ГОСТ 20015-88, очищенный.
4.2.17 Катионит сильнокислотный КУ-2-8-чС по ГОСТ 20298-74 или другой, равноценный по характеристикам.
4.2.18 Вода дистиллированная по ГОСТ 6709-72.
4.2.19 Фильтры бумажные обеззоленные "синяя лента" по ТУ 6-09-1678-86.
4.2.20 Фильтры мембранные "Владипор МФАС-ОС-2", 0,45 мкм, по ТУ 6-55-221-1-29-89 или другого типа, равноценные по характеристикам.
4.2.21 Универсальная индикаторная бумага (рН 0-12) по ТУ 2642-054-23050963-2008.
Примечание - Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже указанной в 4.2.
Выполнение измерения массовой концентрации аммонийного азота фотометрическим методом основано на образовании синего красителя при взаимодействии аммиака и ионов аммония в щелочной среде с хлором и салицилат-ионом в присутствии нитропруссида натрия и фотометрическом измерении оптической плотности окрашенных растворов при 680 нм. Оптимальное значение рН в фотометрируемой пробе должно быть 11,8±0,2. В отсутствие аммонийного азота проба приобретает соломенно-желтый цвет. В присутствии аммонийного азота в зависимости от его концентрации за счет наложения окрасок визуально цвет растворов изменяется от зеленовато-желтого до сине-зеленого.
При выполнении измерений массовой концентрации аммонийного азота соблюдают следующие требования:
- соблюдают требования безопасности, установленные в государственных стандартах и соответствующих нормативных документах;
- по степени воздействия на организм вредные вещества, используемые при выполнении измерений, относятся ко 2-му, 3-му и 4-му классам опасности по ГОСТ 12.1.007;
- содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных ПДК в соответствии с ГОСТ 12.1.005;
- получение гипохлорита, а также концентрированного раствора активного хлора из препаратов на основе дихлоризоцианурата натрия необходимо проводить в вытяжном шкафу;
- особых требований по экологической безопасности не предъявляется.
К выполнению измерений и обработке их результатов допускают лиц с высшим или средним профессиональным образованием, имеющих стаж работы в лаборатории не менее полугода, и освоивших методику анализа.
8.1 При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
|
- температура окружающего воздуха, °С |
22±5; |
|
- атмосферное давление, кПа (мм рт. ст.) |
от 84,0 до 106,7 (от 630 до 800); |
|
- влажность воздуха при температуре 25°С, %, не более |
80; |
|
- напряжение в сети, В |
220±22; |
|
- частота переменного тока в сети питания, Гц |
50±1. |
8.2 В помещении, где выполняют измерения массовой концентрации аммонийного азота, запрещается проводить работы, связанные с применением аммиака и щелочных растворов солей аммония.
Отбор проб для определения аммонийного азота производят в соответствии с ГОСТ 17.1.5.05 и ГОСТ 31861. Оборудование для отбора проб должно соответствовать ГОСТ 17.1.5.04 и ГОСТ 31861. Пробы помещают в стеклянную или полиэтиленовую (полипропиленовую) посуду с плотно закрывающейся пробкой. Объем отбираемой пробы не менее 100 см3.
Если анализ пробы не может быть произведен в день отбора, ее консервируют раствором серной кислоты 1:1 из расчета 0,1 см3 на 100 см3 воды и хранят в холодильнике не более 4 сут. Часть этого же раствора серной кислоты, используемой для консервации, должна возвращаться в лабораторию для выполнения холостого опыта. Для более длительного хранения необходимо замораживание пробы.
Перед определением (консервацией) пробы фильтруют через мембранный фильтр 0,45 мкм, очищенный двукратным кипячением в безаммиачной воде. Чистые фильтры хранят в плотно закрытом бюксе. Фильтрование проб следует проводить под давлением (продавливанием пробы через фильтр), поскольку при фильтровании под вакуумом возможны потери аммиака за счет улетучивания, особенно если рН пробы выше 7,5. При отсутствии мембранных фильтров или установок для фильтрования под давлением, допустимо использовать бумажные фильтры "синяя лента", промытые 1%-ным раствором соляной кислоты, а затем безаммиачной водой. При фильтровании через любой фильтр первые порции фильтрата следует отбросить.
9.2.1 Салицилатный реагент
9.2.1.1 Взвешивают (119,0±0,5) г цитрата натрия, (26,7±0,1) г салицилата натрия и 0,48 г нитропруссида натрия, помещают их в мерную колбу вместимостью 500 см3, приливают 300 см3 безаммиачной воды, растворяют в течение 3 мин тщательно перемешивая круговыми движениями. Допустимо вместо салицилата натрия использовать (29,4±0,1) г салицилата калия или (23,0±0,1) г салициловой кислоты. Если для приготовления реагента использовали салициловую кислоту, добавляют в колбу дополнительно 6,7 г гидроксида натрия и перемешивают. Затем порциями трижды приливают около 50 см3 безаммиачной воды, перемешивают и дают постоять около 10 мин после добавления каждой порции. После этого доводят раствор до метки, закрывают пробкой и перемешивают, переворачивая колбу вверх-вниз, до полного растворения (чем ниже температура, тем медленнее происходит растворение). Получают прозрачный раствор светло-коричневого цвета с рН 8,0±0,2.
Раствор хранят в темной склянке в холодильнике, не более 2 нед.
9.2.1.2 Салицилатный реагент для компенсации мутности готовится аналогично, но без добавления нитропруссида натрия.
9.2.2 Раствор дихромата калия с молярной концентрацией количества вещества эквивалента 0,1000 моль/дм3
При использовании стандарт-титра последний растворяют в дистиллированной воде в мерной колбе вместимостью 1000 см3 согласно инструкции по применению, доводят объем дистиллированной водой до метки и перемешивают.
Для приготовления раствора из навески на весах высокого класса точности взвешивают с точностью до четвертого знака после запятой 4,904 г дихромата калия (K2Cr2O7), предварительно высушенного в сушильном шкафу при 105°С не менее 2 ч. Количественно переносят навеску в мерную колбу вместимостью 1000 см3, растворяют в дистиллированной воде, доводят объем раствора до метки и перемешивают.
Хранят раствор дихромата калия в склянке с притертой пробкой в темном месте не более 6 мес.
9.2.3 Раствор тиосульфата натрия с молярной концентрацией количества вещества эквивалента 0,1 моль/дм3
Растворяют 25 г Na2S2O3·5H2O в 1 дм3 дистиллированной воды, которую предварительно кипятят в течение 30 мин и охлаждают до комнатной температуры. При использовании стандарт-титра последний растворяют в дистиллированной воде в мерной колбе вместимостью 1000 см3 согласно инструкции по применению, доводят объем дистиллированной водой до метки и перемешивают.
Для консервации добавляют 3 см3 хлороформа. Раствор используют не ранее, чем через 5 сут после приготовления. Хранят раствор в склянке из темного стекла. Точную концентрацию раствора тиосульфата натрия устанавливают в соответствии с 9.2.7 не реже одного раза в месяц.
9.2.4 Раствор йодида калия, 10%-ный
Растворяют 10 г йодида калия в 90 см3 дистиллированной воды. Раствор хранят в темной склянке до появления желтоватой окраски, но не более месяца.
9.2.5 Раствор соляной кислоты, 2:1
Две части (по объему) концентрированной соляной кислоты смешивают с одной частью дистиллированной воды. Срок годности раствора не ограничен.
9.2.6 Раствор крахмала, 0,5%-ный
Перемешивают 0,25 г растворимого (рисового, пшеничного) крахмала с 50 см3 дистиллированной воды, нагревают до кипения и кипятят в течение 5 мин. После того как раствор охладится, добавляют в качестве консерванта около 5 мг салициловой кислоты (на кончике скальпеля). Срок годности раствора не ограничен, его используют до помутнения.
9.2.7 Установление точной концентрации раствора тиосульфата натрия
В коническую колбу вместимостью 250 см3 приливают около 70 см3 дистиллированной воды, добавляют с помощью пипетки с одной отметкой 10,0 см3 раствора дихромата калия, приливают мерным цилиндром 10 см3 раствора йодида калия и 10 см3раствора соляной кислоты (2:1). Закрывают колбу пробкой, перемешивают и выдерживают в течение 5 мин в темном месте. Затем титруют пробу раствором тиосульфата натрия до слабо-желтой окраски, добавляют 1 см3 раствора крахмала и продолжают титровать до исчезновения синей окраски. Одновременно выполняют титрование холостой пробы.
Титрование повторяют и при расхождении в объемах титранта менее 0,1 см3 за результат принимают среднее арифметическое. Рассчитывают молярную концентрацию раствора тиосульфата натрия CT, моль/дм3 по формуле
![]() , (2)
, (2)
где 10,0 - объем раствора дихромата калия, см3;
0,1000 - молярная концентрация раствора дихромата калия, моль/дм3;
Vx - объем раствора тиосульфата, пошедший на титрование раствора дихромата калия, см3;
Vo - объем раствора тиосульфата, пошедший на титрование холостой пробы, см3.
9.2.8 Раствор уксусной кислоты, 2 моль/дм3
Растворяют 60 см3 уксусной кислоты в 440 см3 дистиллированной воды. Срок годности раствора не ограничен.
9.2.9 Концентрированный раствор активного хлора
Получение концентрированного раствора активного хлора приведено в приложении А. Определение массовой концентрации активного хлора в концентрированном растворе приведено в 9.2.10.
9.2.10 Определение массовой концентрации активного хлора в концентрированном растворе
В коническую колбу вместимостью 250 см3 добавляют 80-90 см3 дистиллированной воды, приливают пипеткой 2,0 см3 концентрированного раствора активного хлора, 5 см3 раствора иодида калия и 10 см3 раствора уксусной кислоты.
Выделившийся йод титруют раствором тиосульфата натрия, 0,1 моль/дм3 количества вещества эквивалента, до бледно-желтой окраски, затем добавляют 1 см3 раствора крахмала и продолжают титрование до обесцвечивания раствора. Одновременно выполняют титрование холостой пробы.
Если на титрование полученного раствора требуется объем тиосульфата, превышающий объем бюретки, проводят повторное определение, отбирая для титрования 1,0 см3 концентрированного раствора активного хлора.
Определение повторяют и при отсутствии расхождения в объемах титранта более 0,1 см3 за результат принимают среднее арифметическое. В противном случае повторяют титрование до получения результатов, расхождение между которыми не превышает 0,1 см3. Массовую концентрацию активного хлора в растворе Cax, мг/см3, вычисляют по формуле
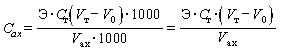 , (3)
, (3)
где Э - молярная масса количества вещества эквивалента активного хлора, равная 35,45 г/моль;
Cт - молярная концентрация раствора тиосульфата натрия, моль/дм3 КВЭ;
Vт - объем раствора тиосульфата натрия, пошедший на титрование раствора активного хлора, см3;
V0 - объем раствора тиосульфата натрия, пошедший на титрование холостой пробы, см3;
Vax - объем аликвоты раствора активного хлора, взятый для титрования, см3;
1000 - множитель для перевода грамма в миллиграммы и дециметра кубического в сантиметры кубические.
9.2.11 Рабочий раствор активного хлора
Объем концентрированного раствора активного хлора Vpax, необходимый для приготовления 50 см3 рабочего раствора активного хлора с массовой концентрацией 2,0 мг/см3, рассчитывают по формуле
![]() , (4)
, (4)
Для приготовления раствора в склянку темного стекла приливают цилиндром вместимостью 50 см3 раствор гидроксида натрия, 0,40 моль/дм3, объем которого равен (50-Vpax) см3, добавляют градуированной пипеткой рассчитанный объем концентрированного раствора активного хлора Vpax и тщательно перемешивают.
Раствор используют в течение рабочего дня.
9.2.12 Раствор соляной кислоты, 1 моль/дм3
Растворяют 84 см3 концентрированной соляной кислоты в 920 см3 дистиллированной воды. Срок годности раствора не ограничен.
9.2.13 Раствор соляной кислоты, 1%-ный
Растворяют 3 см3 концентрированной соляной кислоты в 100 см3 дистиллированной воды. Срок годности раствора не ограничен.
9.2.14 Раствор серной кислоты, 1:1
В термостойком стакане к 50 см3 дистиллированной воды осторожно приливают 50 см3 концентрированной серной кислоты. Срок годности раствора не ограничен.
9.2.15 Раствор гидроксида натрия, 0,40 моль/дм3
Растворяют 3,2 г гидроксида натрия в 200 см3 безаммиачной воды. Раствор устойчив не более 3 мес. при хранении в плотно закрытой полиэтиленовой посуде.
9.2.16 Раствор гидроксида натрия, 1 моль/дм3
Растворяют 40 г гидроксида натрия в 1 дм3 дистиллированной воды. Раствор устойчив не более 6 мес. при хранении в плотно закрытой полиэтиленовой посуде.
9.2.17 Раствор гидроксида натрия, 2 моль/дм3
Растворяют 8 г гидроксида натрия в 100 см3 безаммиачной воды. Раствор используют в течение 1 нед. при хранении в плотно закрытой полиэтиленовой посуде.
9.2.18 Раствор гидроксида натрия, 6 моль/дм3
Растворяют 48 г гидроксида натрия в 200 см3 безаммиачной воды. При хранении в плотно закрытой полиэтиленовой посуде срок годности не ограничен.
9.2.19 Подготовка колонки с катионитом в H+ - форме
Подготовку и регенерацию колонки с катионитом производят в соответствии с приложением Б.
9.2.20 Получение безаммиачной воды
Дистиллированную воду пропускают через колонку, заполненную сильнокислотным катионитом в H+ - форме, со скоростью 1-2 капли в секунду. Отбрасывают первую аликвоту воды, прошедшей через колонку, объемом 150 см3. Хранят безаммиачную воду в плотно закрытой стеклянной посуде не более 3 сут.
Посуду, используемую для приготовления растворов, перед применением дважды ополаскивают безаммиачной водой. Колбы вместимостью 50 см3, используемые для выполнения измерений перед применением тщательно ополаскивают 3 раза безаммиачной водой или прогревают в течение 1,5 ч в сушильном шкафу при температуре от 105°С до 110°С. Прогревание является наиболее эффективным способом удаления следов аммиака с поверхности посуды.
9.4.1 Градуировочные растворы готовят из ГСО с содержанием ионов аммония 1,00 мг/см3 (0,7765 мг/см3 аммонийного азота).
Вскрывают ампулу и ее содержимое переносят в сухую чистую пробирку. Отбирают 2,60 см3 образца с помощью чистой сухой градуированной пипетки вместимостью 5 см3 и переносят в мерную колбу вместимостью 100 см3. Доводят объем в колбе до метки безаммиачной водой и перемешивают. Массовая концентрация аммонийного азота в градуировочном растворе N 1 составляет 20,2 мг/дм3 (если концентрация ионов аммония в ГСО не равна точно 1,00 мг/см3, рассчитывают массовую концентрацию аммонийного азота в градуировочном растворе N 1 соответственно концентрации конкретного образца). Раствор хранят не более 5 сут при комнатной температуре и до 10 сут в холодильнике.
Для приготовления градуировочного раствора N 2 пипеткой с одной отметкой отбирают 20 см3 градуировочного раствора N 1, помещают его в мерную колбу вместимостью 100 см3 и доводят до метки безаммиачной водой. Массовая концентрация аммонийного азота в градуировочном растворе N 2 составляет 4,04 мг/дм3. Раствор хранят не более суток.
9.4.2 При отсутствии ГСО допускается в качестве градуировочных растворов использовать аттестованные растворы аммонийного азота, приготовленные из хлорида аммония. Методика приготовления аттестованных растворов приведена в приложении В.
9.5.1 Для установления градуировочной зависимости в диапазоне массовых концентраций аммонийного азота от 0,020 до 0,200 мг/дм3 в мерные колбы вместимостью 100 см3 градуированными пипетками вместимостью 1,0; 2,0; 5,0 см3 приливают 0; 0,5; 1,0; 2,0; 3,0; 4,0; 5,0 см3 градуировочного раствора N 2, затем доводят растворы до метки безаммиачной водой и перемешивают. Массовая концентрация аммонийного азота в полученных образцах составит соответственно 0; 0,020; 0,040; 0,081; 0,121; 0,162; 0,202 мг/дм3. Отбирают цилиндром вместимостью 25 см3 дважды по 25 см3 каждого из полученных образцов, помещают их в конические колбы вместимостью 50 см3 с притертой стеклянной или пластиковой пробкой и проводят определение аммонийного азота в соответствии с разделом 10. Оптическую плотность измеряют в кюветах с толщиной поглощающего слоя 50 мм относительно дистиллированной воды.
9.5.2 Для установления градуировочной зависимости в диапазоне массовых концентраций аммонийного азота от 0,200 до 1,00 мг/дм3 в мерные колбы вместимостью 100 см3 приливают градуированной пипеткой 0; 1,0; 2,0; 3,0; 4,0; 5,0 см3 градуировочного раствора N 1, доводят растворы до метки безаммиачной водой и перемешивают. Массовая концентрация аммонийного азота в полученных образцах составит соответственно 0; 0,202; 0,404; 0,606; 0,808; 1,01 мг/дм3. Отбирают цилиндром вместимостью 25 см3 дважды по 25 см3 каждого из полученных образцов, помещают их в конические колбы вместимостью 50 см3 с притертой стеклянной или пластиковой пробкой и проводят определение аммонийного азота в соответствии с разделом 10. Оптическую плотность измеряют в кюветах с толщиной поглощающего слоя 10 мм относительно дистиллированной воды.
9.5.3 Среднее значение оптической плотности холостого опыта вычитают из усредненной оптической плотности растворов, содержащих добавки аммонийного азота. Градуировочные зависимости оптической плотности образцов от массовой концентрации аммонийного азота для каждого из диапазонов измерений рассчитывают методом наименьших квадратов.
Градуировочные зависимости устанавливают при использовании новых партий салицилата натрия или калия (или салициловой кислоты) и цитрата натрия, а также при замене измерительного прибора, но не реже 1 раза в год.
9.6.1 Контроль стабильности градуировочной характеристики проводят при приготовлении нового салицилатного реагента. Средствами контроля являются образцы, используемые для установления градуировочной зависимости по 9.5 (не менее 3 для каждой градуировочной зависимости).
Допускается проводить контроль стабильности одной градуировочной зависимости, если другая зависимость не будет использована для расчета результатов измерений концентрации аммонийного азота в течение контролируемого периода. Градуировочная характеристика считается стабильной при выполнении условия
|ХГ-СГ|≤σR, (5)
где ХГ - результат контрольного измерения массовой концентрации аммонийного азота в образце, мг/дм3;
СГ - приписанное образцу значение массовой концентрации аммонийного азота, мг/дм3;
σR - показатель воспроизводимости для концентрации С, мг/дм3 (см. таблицу 1).
Если условие стабильности не выполняется для одного градуировочного образца, необходимо выполнить повторное измерение этого образца для исключения результата, содержащего грубую погрешность. При повторном невыполнении условия, выясняют причины нестабильности, устраняют их и повторяют измерение с использованием других образцов, предусмотренных методикой. Если градуировочная характеристика вновь не будет удовлетворять условию (5), устанавливают новую градуировочную зависимость.
9.6.2 При выполнении условия (5) учитывают знак разности между измеренными и приписанными значениями массовой концентрации аммонийного азота в образцах. Эта разность должна иметь как положительное, так и отрицательное значение, если же все значения имеют один знак, это говорит о наличии систематического отклонения. В таком случае требуется установить новую градуировочную зависимость.
10.1. Цилиндром вместимостью 25 см3 отбирают дважды по 25 см3 отфильтрованной пробы воды и помещают ее в две колбы с притертыми стеклянными или пластиковыми пробками вместимостью 50 см3. В вытяжном шкафу к каждой аликвоте воды последовательно прибавляют 3,0 см3 салицилатного реагента, 0,5 см3 раствора активного хлора с массовой концентрацией 2,0 мг/см3, перемешивают 4-5 раз круговыми движениями, добавляют 0,4 см3 раствора гидроксида натрия, 2 моль/дм3, и вновь перемешивают. Прибавление растворов следует проводить быстро, закрывая колбу пробкой после добавления очередного раствора. Предпочтительно добавлять реактивы пипеточными дозаторами, особенно раствор активного хлора. Закрытую пробкой колбу оставляют в темноте на 40 мин. В зависимости от интенсивности окраски оптическую плотность каждого из полученных растворов измеряют в кюветах с толщиной поглощающего слоя 50 или 10 мм на спектрофотометре или фотометре с непрерывной разверткой спектра при длине волны 680 нм (на фотометре, снабженном светофильтрами - при 670 нм) относительно дистиллированной воды. Оптическая плотность раствора (относительно одновременно приготовленного холостого опыта) стабильна в течение суток.
10.2 Одновременно с серией проб воды выполняют анализ холостой пробы, в качестве которой берут две пробы по 25 см3 свежей безаммиачной воды. Оптическая плотность холостой пробы в кюветах длиной 5 см при длине волны 680 нм не должна превышать 0,1. Большее значение указывает на загрязнение безаммиачной воды ионами аммония. Если получить достаточно чистую безаммиачную воду не удается, допускается выполнять холостой опыт с использованием 5 см3 безаммиачной воды без изменения объема добавляемых реактивов, но непосредственно перед измерением оптической плотности в колбу следует добавить еще 20 см3 безаммиачной воды и перемешать.
10.3 Если проба была законсервирована серной кислотой, перед анализом ее следует нейтрализовать по универсальной индикаторной бумаге, добавляя строго по каплям раствор гидроксида натрия, 6 моль/дм3. Холостой опыт для таких проб выполняют, используя безаммиачную воду, законсервированную тем же раствором кислоты, что и пробы и нейтрализованную тем же раствором щелочи.
10.4 В том случае, когда оптическая плотность пробы, измеренная в кювете с толщиной поглощающего слоя 1 см, выходит за пределы градуировочной зависимости, повторяют измерения после разбавления пробы воды. Для разбавления отбирают пипеткой с одной отметкой аликвоту пробы воды Vал, помещают ее в мерную колбу вместимостью 100 см3, доводят до метки безаммиачной водой и перемешивают. Аликвоту для разбавления следует выбирать таким образом, чтобы массовая концентрация аммонийного азота в пробе после разбавления находилась в пределах от 0,5 до 1,0 мг/дм3.
10.5 Мешающее влияние на определение аммонийного азота может оказывать жесткость, обусловленная присутствием магния с содержанием свыше 100 мг/дм3. Мешающее влияние магния проявляется в помутнении проб воды после добавления реагентов. При содержании магния до 200 мг/дм3 возможно устранение его влияния путем компенсации мутности. Для этого к 25 см3 анализируемой воды добавляют 3,0 см3 салицилатного реагента, не содержащего нитропруссида натрия (см. 9.2.1.2), 0,5 см3 раствора активного хлора с массовой концентрацией 2,0 мг/см3, и 0,4 см3 раствора гидроксида натрия, 2 моль/дм3, хорошо перемешивают и через 40 мин измеряют оптическую плотность полученного раствора.
11.1 Обработку результатов измерений выполняют способом:
- вычисляют значение оптической плотности Ах, соответствующее концентрации аммонийного азота в пробе воды по формуле
Ах=А-А1-А2, (6)
где А - значение оптической плотности анализируемой пробы, в которую добавлены все реактивы;
А1 - значение оптической плотности пробы для компенсации мутности (если она присутствует);
А2 - среднее арифметическое значение оптической плотности холостой пробы.
11.2 По соответствующей градуировочной зависимости находят массовую концентрацию аммонийного азота в анализируемой пробе воды X, мг/дм3, соответствующую полученному значению оптической плотности Ах.
Если измерение проводилось после разбавления, массовую концентрацию аммонийного азота в исходной пробе воды X, мг/дм3, рассчитывают по формуле
X=Xp·η, (7)
где Xp - массовая концентрация аммонийного азота в разбавленной пробе, найденная по градуировочной зависимости, мг/дм3;
η - степень разбавления исходной пробы воды (согласно 10.4 100/Vал).
12.1 Результат измерения в документах, предусматривающих его использование, представляют в виде:
X̅±Δ, мг/дм3 (Р = 0,95), (8)
где X̅ - среднее арифметическое значение двух результатов, разность между которыми не превышает предела повторяемости r (2,77·σr); при превышении предела повторяемости следует поступать в соответствии с 13.2;
±Δ - границы характеристик погрешности измерения для данной массовой концентрации аммонийного азота (см. таблицу 1).
Численное значение результата измерения должно оканчиваться цифрой того же разряда, что и значение характеристики погрешности; последняя не должна содержать более двух значащих цифр.
12.2 Допустимо представлять результат в виде
X̅±Δл (Р = 0,95) при условии Δл<Δ, (9)
где ±Δл - границы характеристик погрешности результатов анализа, установленные при реализации методики в лаборатории и обеспечиваемые контролем стабильности результатов измерений.
12.3 Массовую концентрацию аммиака (в пересчете на азот) рассчитывают, исходя из массовой концентрации аммонийного азота и мольной доли азота аммиака Д (см. таблицу 2) в зависимости от температуры и рН воды. Для промежуточных значений рН и температуры мольную долю азота аммиака находят методом линейной интерполяции. Приведенные в таблице 2 значения используют для расчета концентрации азота аммиака в диапазоне минерализации от 0 до 1,0 г/дм3. Если минерализация анализируемой пробы воды превышает 1,0 г/дм3, полученное значение массовой концентрации азота аммиака следует умножить на коэффициент 0,9.
|
pН |
Мольная доля азота аммиака при температуре | ||||||
|
0°С |
5°С |
10°С |
15°С |
20°С |
25°С |
30°С | |
|
6,0 |
0 |
0 |
0 |
0 |
0 |
0 |
0,001 |
|
6,5 |
0 |
0,001 |
0,001 |
0,001 |
0,001 |
0,002 |
0,002 |
|
7,0 |
0,001 |
0,002 |
0,002 |
0,003 |
0,004 |
0,005 |
0,006 |
|
7,5 |
0,004 |
0,006 |
0,008 |
0,010 |
0,013 |
0,016 |
0,020 |
|
8,0 |
0,013 |
0,018 |
0,023 |
0,030 |
0,039 |
0,049 |
0,060 |
|
8,2 |
0,020 |
0,028 |
0,036 |
0,047 |
0,060 |
0,075 |
0,093 |
|
8,4 |
0,032 |
0,043 |
0,056 |
0,073 |
0,092 |
0,114 |
0,139 |
|
8,6 |
0,050 |
0,066 |
0,087 |
0,111 |
0,138 |
0,170 |
0,204 |
|
8,8 |
0,077 |
0,102 |
0,131 |
0,165 |
0,203 |
0,245 |
0,289 |
|
9,0 |
0,116 |
0,152 |
0,193 |
0,238 |
0,287 |
0,339 |
0,392 |
|
9,2 |
0,172 |
0,221 |
0,274 |
0,331 |
0,390 |
0,448 |
0,505 |
|
9,4 |
0,248 |
0,310 |
0,375 |
0,440 |
0,503 |
0,563 |
0,618 |
|
9,6 |
0,344 |
0,416 |
0,487 |
0,544 |
0,616 |
0,671 |
0,719 |
|
9,8 |
0,454 |
0,531 |
0,602 |
0,664 |
0,718 |
0,764 |
0,803 |
|
10,0 |
0,568 |
0,641 |
0,705 |
0,758 |
0,801 |
0,837 |
0,866 |
|
10,5 |
0,806 |
0,850 |
0,883 |
0,908 |
0,927 |
0,942 |
0,953 |
|
11,0 |
0,929 |
0,947 |
0,960 |
0,969 |
0,976 |
0,981 |
0,985 |
12.4 Массовую концентрацию азота аммиака ![]() , мг/дм3, рассчитывают по формуле
, мг/дм3, рассчитывают по формуле
![]() , (10)
, (10)
где X - массовая концентрация аммонийного азота, мг/дм3;
Д - мольная доля азота аммиака в общем содержании аммонийного азота (см. таблицу 2).
12.5 Результат расчета массовой концентрации свободного аммиака в документах, предусматривающих его использование, представляют в виде
![]() , мг/дм3 (Р = 0,95), (11)
, мг/дм3 (Р = 0,95), (11)
где ![]() - рассчитанное по формуле (10) значение массовой концентрации азота аммиака, мг/дм3;
- рассчитанное по формуле (10) значение массовой концентрации азота аммиака, мг/дм3;
![]() - границы характеристик погрешности расчета массовой концентрации азота аммиака, мг/дм3.
- границы характеристик погрешности расчета массовой концентрации азота аммиака, мг/дм3.
12.6 Погрешность расчета массовой концентрации азота аммиака ![]() , мг/дм3, находят по формуле
, мг/дм3, находят по формуле
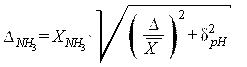 , (12)
, (12)
где ![]() - рассчитанное значение массовой концентрации азота аммиака, мг/дм3;
- рассчитанное значение массовой концентрации азота аммиака, мг/дм3;
δpH - погрешность расчета массовой концентрации азота аммиака, обусловленная погрешностью измерения рН.
δpH принимает значения:
- 0,21 при рН от 6,0 до 8,2 включ.;
- (1,1-0,11·pH) при рН от 8,3 до 10,0 включ.;
- 0,03 при рН свыше 10,0.
12.7 Результаты измерения оформляют протоколом или записью в журнале по формам, приведенным в Руководстве по качеству лаборатории.
13.1.1 Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
- оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости и погрешности при реализации отдельно взятой контрольной процедуры);
- контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости, внутрилабораторной прецизионности, погрешности).
13.1.2 Периодичность оперативного контроля исполнителем процедуры выполнения измерений, а также реализуемые процедуры контроля стабильности результатов выполняемых измерений регламентируются в Руководстве по качеству лаборатории.
13.2.1 Контроль повторяемости осуществляют для каждого из результатов контрольных измерений, полученных в соответствии с методикой. Для этого отобранную пробу воды делят на две части, и выполняют анализ в соответствии с разделом 10.
13.2.2 Результат контрольной процедуры rк, мг/дм3, рассчитывают по формуле
rк=Xmax-Xmin, (13)
где Xmax, Xmin - результаты параллельных измерений массовой концентрации аммонийного азота в пробе, мг/дм3.
13.2.3 Предел повторяемости rn, мг/дм3, рассчитывают по формуле
rn=2,77·σr, (14)
где σr - показатель повторяемости для массовой концентрации, равной X̅, мг/дм3 (см. таблицу 1).
13.2.4 Результат контрольной процедуры должен удовлетворять условию
rк≤rn. (15)
13.2.5 При несоблюдении условия (15) выполняют еще два измерения и сравнивают разницу между максимальным и минимальным результатами с нормативом контроля. В случае превышения предела повторяемости, поступают в соответствии с ГОСТ Р ИСО 5725-6 (раздел 5).
13.3.1 Оперативный контроль процедуры выполнения измерений проводят путем сравнения результатов отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.3.2 Результат контрольной процедуры Кк, мг/дм3, рассчитывают по формуле
Кк=|X'-X-C|, (16)
где X' - результат контрольного измерения массовой концентрации аммонийного азота в пробе с известной добавкой, мг/дм3;
X - результат контрольного измерения массовой концентрации аммонийного азота в рабочей пробе, мг/дм3;
С - концентрация добавки, мг/дм3.
13.3.3 Норматив контроля погрешности К, мг/дм3, рассчитывают по формуле
![]() , (17)
, (17)
где ΔX' - значение погрешности методики анализа, соответствующее массовой концентрации аммонийного азота в пробе с добавкой, мг/дм3;
ΔX - значение погрешности методики анализа соответствующее массовой концентрации аммонийного азота в рабочей пробе, мг/дм3.
13.3.4 Если результат контрольной процедуры удовлетворяет условию
|Кк|≤К, (18)
процедуру признают удовлетворительной.
При невыполнении условия (18) контрольную процедуру повторяют. При повторном невыполнении условия (18), выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
14.1 Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата измерений и в качестве окончательного может быть использовано их общее среднее значение. Значение предела воспроизводимости R, мг/дм3, рассчитывают по формуле
R=2,77·σR, (19)
где σR - показатель воспроизводимости методики, мг/дм3 (см. таблицу 1).
14.2 При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно ГОСТ Р ИСО 5725-6 (раздел 5) или МИ 2881.
14.3 Проверка приемлемости проводится при необходимости сравнения результатов измерений, полученных двумя лабораториями.
Приложение А
(обязательное)
А.1.1 К препаратам, содержащим дихлоризоцианурат натрия, относятся собственно реактив дихлоризоцианурат натрия, а также препараты-антисептики. К препаратам-антисептикам, содержащим дихлоризоцианурат натрия, относятся "Жавель Солид" фирмы "Жазол", "Жавельон/НовелтиХлор" фирмы "Етс.Линосье", "Хлоритэкс" фирмы "Маркопул кемиклс" или аналогичные препараты других фирм, выпускаемые в виде растворимых в воде таблеток.
Дихлоризоцианурат в воде гидролизуется с выделением активного хлора.
А.1.2 Для приготовления раствора из дихлоризоцианурата натрия в стакане вместимостью 100 см3 взвешивают 4,0 г реактива и растворяют его в 50 см3 безаммиачной воды. Массовая концентрация активного хлора в полученном растворе составляет около 40 мг/см3.
А.1.3 Для приготовления раствора из таблеток массой от 3 до 4 г ("Жавель Солид", "Жавельон/НовелтиХлор" или их аналоги) в стакане вместимостью 100 см3 растворяют таблетку препарата в 50 см3 безаммиачной воды. Если после растворения образовался осадок, раствор осторожно декантируют. Содержание активного хлора в полученном растворе составляет около 30 мг/см3.
Для приготовления раствора из таблеток большей массы (например, "Хлоритэкс"), следует пропорционально увеличить объем безаммиачной воды, либо использовать для растворения часть таблетки массой от 4 до 5 г.
А.1.4 Приготовление концентрированных растворов активного хлора из препаратов дихлоризоцианурата натрия проводят в вытяжном шкафу. Точную концентрацию активного хлора устанавливают йодометрическим титрованием согласно 9.2.10 перед использованием. Хранят растворы в холодильнике в темных склянках, помещенных в полиэтиленовый пакет, до уменьшения концентрации активного хлора до 20 мг/см3.
Для получения раствора гипохлорита натрия собирают установку, изображенную на рисунке А.1.
Получение гипохлорита необходимо проводить в вытяжном шкафу. В колбу с отводом без шлифа поз. 2 помещают 10 г перманганата калия и закрывают ее резиновой пробкой поз. 3, в которую вставлена капельная воронка поз. 4 с 50 см3 концентрированной соляной кислоты. Колба с отводом без шлифа поз. 2 с помощью соединительных резиновых (не силиконовых!) трубок поз. 5 соединяется с промывными склянками.
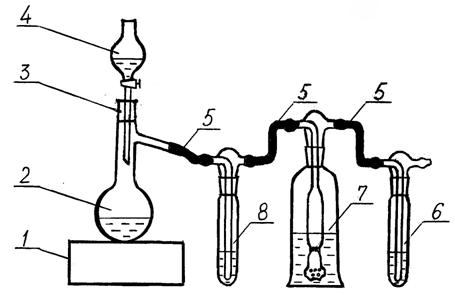
1 - электроплитка; 2 - колба с отводом без шлифа; 3 -резиновая пробка; 4 - капельная воронка; 5 - соединительные резиновые трубки; 6 - склянка с разбавленным раствором гидроксида натрия; 7 - склянка-приемник; 8 - склянка с безаммиачной водой.
Рисунок А.1 - Схема установки для получения гипохлорита натрия
Первая склянка заполняется от 25 до 30 см3 безаммиачной воды поз. 8; во вторую склянку-приемник, поз. 7 помещают от 100 до 120 см3 безаммиачной воды, содержащей около 8 г гидроксида натрия; в третью склянку добавляют от 50 до 100 см3 раствора гидроксида натрия поз. 6 безаммиачной воде с концентрацией 1 моль/дм3 для улавливания хлора, не поглощенного в склянке-приемнике поз. 7. Соединения должны быть выполнены так, чтобы длина резиновых трубок была минимальна. Последнюю склянку присоединяют к водоструйному насосу, по каплям добавляют концентрированную соляную кислоту и регулируют процесс скоростью подачи воды.
При добавлении соляной кислоты к перманганату калия выделяется газообразный хлор, который, в основном, поглощается в склянке-приемнике поз. 7. Чтобы избежать значительных потерь хлора следует обеспечить герметичность соединений элементов установки.
При достаточно полном протекании реакции и поглощении хлора в склянке-приемнике поз. 7 можно получить раствор с массовой концентрацией активного хлора около 40 мг/см3. Пропускание хлора ведут до практически полного прекращения его выделения (от 2 до 3 ч). При эффективном поглощении раствор в склянке постепенно становится зеленовато-желтым.
Примечание - Если соединения стеклянных и резиновых трубок, а также резиновой пробки с колбой, окажутся недостаточно герметичными, можно стыки замазать обычным детским пластилином.
По окончании реакции отсоединяют насос и склянку-приемник поз. 7, добавляют в последнюю небольшими порциями сухой гидроксид натрия до исчезновения явной желтой окраски, затем добавляют еще 2 г гидроксида натрия и перемешивают. Приготовленный раствор гипохлорита хранят в темной склянке, упакованной в полиэтиленовый пакет, в холодильнике в течение года или более (до уменьшения концентрации активного хлора до 5 мг/см3), периодически (1-2 раза в месяц) проверяя концентрацию активного хлора согласно 9.2.10.
Аналогично можно поступить с раствором гипохлорита, получающимся в склянке поз. 6, если массовая концентрация активного хлора в нем более 5 мг/см3, однако этот раствор будет менее устойчивым.
Приложение Б
(обязательное)
Замачивают 60 г сухого катионита на 1-2 сут в насыщенном растворе хлорида натрия в дистиллированной воде (70 г хлорида натрия растворяют в 200 см3 воды). Через 1-2 сут сливают раствор хлорида натрия, промывают катионит 3 раза дистиллированной водой.
Катионит переносят в стеклянную колонку (см. 4.1.20) вместе с водой так, чтобы не образовалось воздушных пузырьков. Вместо колонки можно использовать бюретку с прямым краном с прокладкой из стеклоткани или стекловаты. Предварительно колонку с открытым краном помещают в стакан с дистиллированной водой и с помощью груши заполняют колонку снизу вверх на одну треть водой, далее колонку быстро поднимают и закрывают кран. В воде между пористой пластиной и краном не должно оставаться воздушного пузыря! Избыток воды при заполнении колонки периодически сливают через кран.
После заполнения пропускают через колонку с катионитом последовательно по 100 см3 раствора соляной кислоты, 1 моль/дм3, дистиллированной воды и раствора гидроксида натрия, 1 моль/дм3, со скоростью 1-2 капли в секунду, повторяя процедуру от 8 до 10 раз. Заканчивают обработку смолы пропусканием 100 см3 раствора соляной кислоты. Промывают колонку дистиллированной водой до рН дистиллированной воды, пропуская воду с максимально возможной скоростью.
Колонка с катионитом пригодна к работе длительное время. В перерыве между использованием колонку хранят герметично закрытой. Катионит должен постоянно находиться под слоем воды.
При ухудшении качества безаммиачной воды колонку регенерируют, пропуская 100 см3 раствора соляной кислоты, 1 моль/дм3, и промывая дистиллированной водой.
Катионит (как сухой, так и влажный) со временем стареет и теряет ионообменные свойства. Для проверки пригодности катионита готовят раствор хлорида натрия с молярной концентрацией 0,010 моль/дм3, для чего взвешивают на аналитических весах 0,0585 г хлорида натрия и растворяют его в дистиллированной воде в мерной колбе вместимостью 100 см3.
После первоначальной подготовки или после регенерации через колонку пропускают 100 см3 дистиллированной воды со скоростью 1-2 капли в секунду. Отбрасывают первую часть жидкости объемом 60 см3, прошедшей через колонку, отбирают следующую часть объемом 40 см3 в стакан вместимостью 50 см3 и измеряют рН катионированной воды.
Далее пропускают с той же скоростью приготовленный раствор хлорида натрия, отбрасывают первую часть раствора объемом 60 см3, прошедшего через колонку, отбирают следующую часть раствора объемом 40 см3 в стакан вместимостью 50 см3 и также измеряют рН полученного раствора.
За счет замещения ионов натрия в растворе при пропускании через катионит на ионы водорода, рН раствора понижается по сравнению с катионированной дистиллированной водой. Если качество катионита удовлетворительное, разница в величине рН должна составлять от 2,5 до 3,0 единиц.
Приложение В
(рекомендуемое)
Настоящая методика регламентирует процедуру приготовления аттестованных растворов хлорида аммония, предназначенных для установления градуировочных зависимостей и контроля точности результатов измерений массовой концентрации аммонийного азота в природных и очищенных сточных водах фотометрическим методом.
Метрологические характеристики аттестованных растворов приведены в таблице В.1.
Таблица В.1 - Метрологические характеристики аттестованных растворов
|
Наименование характеристики |
Значения характеристик для аттестованного раствора | ||
|
AP1-N-NH4+ |
AP2-N-NH4+ |
AP3-N-NH4+ | |
|
Аттестованное значение массовой концентрации аммонийного азота, мг/дм3 |
500,0 |
20,00 |
4,00 |
|
Границы погрешности установления аттестованного значения массовой концентрации аммонийного азота (Р = 0,95), мг/дм3 |
2,6 |
0,13 |
0,03 |
В.3.1 Весы высокого (II) класса точности по ГОСТ Р 53228-2008, максимальная нагрузка не более 200 г, дискретность отсчета не более 0,0002 г.
В.3.2 Колбы мерные 2-го класса точности исполнения 2, 2а по ГОСТ 1770-74 вместимостью: 500 см3 - 1 шт., 250 см3 - 1 шт., 100 см3 - 1 шт.
В.3.3 Пипетки с одной отметкой 2-го класса точности исполнения 2 по ГОСТ 29169-91 вместимостью: 10 см3 - 1 шт., 20 см3 - 1 шт.
В.3.4 Стаканчик для взвешивания (бюкс) СВ-19/9 и СВ-24/10 по ГОСТ 25336-82.
В.3.5 Воронка лабораторная типа В по ГОСТ 25336-86 диаметром 56 мм.
В.3.6 Шпатель пластмассовый.
В.3.7 Промывалка.
В.3.8 Эксикатор с безводным хлоридом кальция.
В.3.9 Шкаф сушильный общелабораторного назначения.
В.3.10 Вода дистиллированная по ГОСТ 6709-72.
В.4.1 Хлорид аммония NH4Cl по ГОСТ 3773-72, х.ч., содержание основного вещества ≥99,5%.
В.4.2 Вода безаммиачная (вода дистиллированная, пропущенная через колонку с катионитом по 9.2.20).
В.5.1 Приготовление аттестованного раствора AP1-N-NH4+
На весах высокого класса точности взвешивают в бюксе с точностью до четвертого знака после запятой (0,9545±0,0002) г NH4Cl, предварительно высушенного в сушильном шкафу при температуре от 105°С до 110°С в течение 1 ч и охлажденного до комнатной температуры в эксикаторе. Количественно переносят навеску в мерную колбу вместимостью 500 см3, растворяют в безаммиачной воде, доводят объём раствора до метки и перемешивают. Переносят раствор в темную склянку с хорошо притертой стеклянной или пластиковой пробкой.
Полученному раствору приписывают массовую концентрацию аммонийного азота 500,0 мг/дм3.
В.5.2 Приготовление аттестованного раствора AP2-N-NH4+
Пипеткой с одной отметкой отбирают 10,0 см3 раствора AP1-N-NH4+, помещают его в мерную колбу вместимостью 250 см3, доводят до метки безаммиачной водой и перемешивают. Переносят раствор в темную склянку с хорошо притертой стеклянной или пластиковой пробкой.
Полученному раствору приписывают массовую концентрацию аммонийного азота 20,00 мг/дм3.
В.5.3 Приготовление аттестованного раствора AP3-N-NH4+
Пипеткой с одной отметкой отбирают 20,0 см3 раствора AP2-N-NH4+, помещают его в мерную колбу вместимостью 100 см3, доводят до метки безаммиачной водой и перемешивают. Переносят раствор в темную склянку с хорошо притертой стеклянной или пластиковой пробкой.
Полученному раствору приписывают массовую концентрацию аммонийного азота 4,00 мг/дм3.
В.6.1 Расчет метрологических характеристик аттестованного раствора AP1-N-NH4+
Аттестованное значение массовой концентрации аммонийного азота C1, мг/дм3, рассчитывают по формуле
![]() , (В.1)
, (В.1)
где m - масса навески хлорида аммония, г;
14,01 и 53,49 - масса моль азота и хлорида аммония, соответственно, г/моль;
V - объем мерной колбы, см3.
Расчет погрешности приготовления аттестованного раствора AP1-N-NH4+ Δ1, мг/дм3, выполняют по формуле
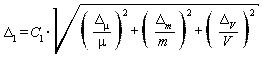 , (B.2)
, (B.2)
где Δμ - предельное значение возможного отклонения массовой доли основного вещества в реактиве от приписанного значения μ, %;
μ - массовая доля основного вещества (NH4Cl) в реактиве, приписанная реактиву квалификации "х.ч.", %;
Δm - предельная возможная погрешность взвешивания, г;
ΔV - предельное значение возможного отклонения вместимости мерной колбы от номинального значения, см3.
Погрешность приготовления аттестованного раствора AP1-N-NH4+ равна
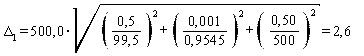 мг/дм3.
мг/дм3.
В.6.2 Расчет метрологических характеристик аттестованных растворов AP2-N-NH4+ и AP3-N-NH4+
Аттестованное значение массовой концентрации аммонийного азота для аттестованных растворов AP2-N-NH4+ или AP3-N-NH4+, Ci, мг/дм3, рассчитывают по формуле
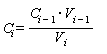 , (В.3)
, (В.3)
где Ci-1 - значение массовой концентрации аммонийного азота, приписанное раствору, используемому для приготовления растворов AP2-N-NH4+ или AP3-N-NH4+, мг/дм3;
Vi-1 - объем аттестованного раствора, отбираемый пипеткой, см3;
Vi - вместимость мерной колбы, см3.
Расчет погрешности приготовления аттестованных растворов AP2-N-NH4+ Δ2 и AP3-N-NH4+ Δ3 с массовой концентрацией аммонийного азота 20,00 и 4,00 мг/дм3 соответственно выполняют по формуле
 , (В.4)
, (В.4)
где Δi-1 - предел возможного значения погрешности приготовления раствора с массовой концентрацией аммонийного азота Ck;
![]() - предельное значение возможного отклонения объема мерной колбы от номинального значения, см3;
- предельное значение возможного отклонения объема мерной колбы от номинального значения, см3;
![]() - предельное значение возможного отклонения объема раствора, отбираемого пипеткой, от номинального значения, см3.
- предельное значение возможного отклонения объема раствора, отбираемого пипеткой, от номинального значения, см3.
Погрешность приготовления аттестованного раствора AP2-N-NH4+ равна
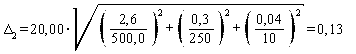 мг/дм3.
мг/дм3.
Погрешность приготовления аттестованного раствора AP3-N-NH4+ равна
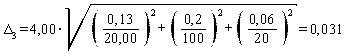 мг/дм3.
мг/дм3.
Необходимо соблюдать общие требования техники безопасности при работе в химических лабораториях.
Аттестованные растворы могут готовить инженер или лаборант со средним профессиональным образованием, прошедший специальную подготовку и имеющий стаж работы в химической лаборатории не менее 6 мес.
На склянки с аттестованными растворами должны быть наклеены этикетки с указанием шифра раствора, массовой концентрации аммонийного азота, погрешности ее установления и срока годности.
Аттестованный раствор AP1-N-NH4+ хранят не более 3 мес. при комнатной температуре и до 6 мес. в холодильнике.
Аттестованный раствор AP2-N-NH4+ хранят не более 5 сут при комнатной температуре и до 10 сут в холодильнике.
Аттестованный раствор AP3-N-NH4+ хранят не более суток.

Последние добавленные документы





