Введен в действие приказом Федерального агентства по техническому регулированию и метрологии от 21 августа 2018 г. N 509-ст
Межгосударственный стандарт ГОСТ 34430-2018
"ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ. МЕТОД ОПРЕДЕЛЕНИЯ ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТИ"
Enzyme preparations for food industry. Method for the determination of proteolitic activity
МКС 07.100.30
Дата введения - 1 июля 2019 г.
Введен впервые
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2015 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 Разработан Всероссийским научно-исследовательским институтом пищевой биотехнологии - филиалом Федерального государственного бюджетного учреждения науки "Федеральный исследовательский центр питания, биотехнологии и безопасности пищи" (ВНИИПБТ - филиал ФГБУН "ФИЦ питания и биотехнологии")
2 Внесен Федеральным агентством по техническому регулированию и метрологии
3 Принят Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 июня 2018 г. N 53-2018)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004-97
|
Код страны по МК (ИСО 3166) 004-97
|
Сокращенное наименование национального органа по стандартизации
|
|
Армения
|
AM
|
Минэкономики Республики Армения
|
|
Беларусь
|
BY
|
Госстандарт Республики Беларусь
|
|
Казахстан
|
KZ
|
Госстандарт Республики Казахстан
|
|
Киргизия
|
KG
|
Кыргызстандарт
|
|
Россия
|
RU
|
Росстандарт
|
|
Узбекистан
|
UZ
|
Узстандарт
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 21 августа 2018 г. N 509-ст межгосударственный стандарт ГОСТ 34430-2018 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2019 г.
5 Введен впервые
1 Область применения
Настоящий стандарт устанавливает метод определения протеолитической активности в ферментных препаратах в кислой, слабокислой, нейтральной и щелочной зонах рН действия ферментов с использованием в качестве субстрата гемоглобина.
Установленный в настоящем стандарте метод может быть применен для определения протеолитической активности ферментных препаратов и ферментсодержащих объектов, используемых в пищевой промышленности.
Примечание - Протеолитическую активность ферментных препаратов (ФП) обеспечивает комплекс протеаз, состоящий из протеолитических ферментов эндо- и (или) экзодействия.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.018-93 Система стандартов безопасности труда. Пожаровзрывобезопасность статического электричества. Общие требования
ГОСТ 12.2.007.0-75 Система стандартов безопасности труда. Изделия электротехнические. Общие требования безопасности
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 12.4.103-83 Система стандартов безопасности труда. Одежда специальная защитная, средства индивидуальной защиты ног и рук. Классификация
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 83-79 Реактивы. Натрий углекислый. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ ИСО 5725-6-2003* Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
──────────────────────────────
* В Российской Федерации действует ГОСТ Р ИСО 5725-6-2002.
ГОСТ 6691-77 Реактивы. Карбамид. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9656-75 Реактивы. Кислота борная. Технические условия
ГОСТ 10678-76 Кислота ортофосфорная термическая. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13867-68 Продукты химические. Обозначение чистоты
ГОСТ 16317-87 Приборы холодильные электрические бытовые. Общие технические условия
ГОСТ 18321-73 Статистический контроль качества. Методы случайного отбора выборок штучной продукции
ГОСТ 18481-81 Ареометры и цилиндры стеклянные. Общие технические условия
ГОСТ 18995.1-73 Продукты химические жидкие. Методы определения плотности
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 гидролиз: Расщепление исходного соединения на более простые в присутствии молекулы воды.
3.2 ферментный гидролиз: Расщепление высокомолекулярных соединений при участии катализаторов белковой природы - гидролитических ферментов.
3.3 субстрат: Соединение или вещество, на которое воздействует фермент.
3.4 белки: Высокомолекулярные полипептидные соединения - полимеры аминокислот, соединенные пептидными связями.
3.5 системные названия ферментов: Названия, указывающие природу химической реакции, катализируемой ферментом, в соответствии с современной классификацией (КФ), принятой Международной комиссией по ферментам [1] (см. приложение А).
3.6 комплекс протеаз: Комплекс гидролитических ферментов, расщепляющих белки до конечных продуктов - свободных аминокислот и (или) пептидов.
4 Сущность метода
4.1 Метод основан на гидролизе бычьего гемоглобина - животного белка в кислой (3, 0 ед. рН), слабокислой (5, 3 ед. рН), нейтральной (7, 0 ед. рН) и щелочной (9, 0 ед. рН) зонах ферментным препаратом до низкомолекулярных пептидов и свободных аминокислот с последующим прекращением действия фермента путем осаждения непрогидролизованного белка трихлоруксусной кислотой (ТХУ) и определением образовавшихся пептидов и свободных аминокислот.
Определение протеолитической активности кислых протеаз осуществляют при (3, 0 ± 0, 2) ед. рН реакционной смеси, слабокислых протеаз - при (5, 3 ± 0, 2) ед. рН, нейтральных протеаз - при (7, 0 ± 0, 2) ед. рН, щелочных протеаз - при (9, 0 ± 0, 2) ед. рН и рассчитывают по градуировочному графику, построенному для тирозина.
4.2 За единицу общей протеолитической активности (ПС) принимают такое количество фермента, которое за 1 мин при температуре 30 °С приводит гемоглобин в не осаждаемое ТХУ состояние в количестве, соответствующем 1 мкмоль тирозина (1 мкмоль тирозина равен 0, 181 мг). Активность выражают в ед. ПС/г или ед. ПС/см3 ферментного препарата.
4.3 Количество белка, превращенного в низкомолекулярные пептиды и аминокислоты, определяют по реакции свободных аминокислот с реактивом Фолина и дальнейшим определением оптической плотности образующихся голубых растворов на фотоэлектроколориметре при длине световой волны λ = 670 нм.
5 Средства измерений, вспомогательное оборудование, посуда, реактивы, материалы
Весы лабораторные по ГОСТ OIML R 76-1 высокого класса точности с ценой поверочного деления 0, 1 мг и пределом допускаемой погрешности ± 0, 15 мг.
Фотоэлектроколориметр или спектрофотометр любого типа, который обеспечивает измерение оптической плотности анализируемых растворов при длине световой волны λ = 670 нм с погрешностью измерения коэффициента пропускания ± 1 % в кюветах с толщиной поглощающего свет слоя 10 мм.
рН-метр любого типа для измерения в диапазоне от 0 до 14 ед. рН с пределом допускаемой погрешности в эксплуатации ± 0, 1 ед. рН.
Холодильник бытовой по ГОСТ 16317.
Мешалка магнитная любой марки, которая обеспечивает скорость вращения до 800 мин-1.
Ультратермостат или термостат водяной с точностью регулирования температуры ± 1 °С.
Секундомер с емкостью шкалы счетчика 1 мин, ценой деления 1 с и погрешностью ± 1, 5 с.
Встряхиватель для перемешивания жидкости со скоростью вращения гнезда от 50 до 3000 об/мин.
Термометры ртутные стеклянные лабораторные от 0 до 50 °С и от 0 до 100 °С с ценой деления 0, 1 или 0, 5 °С по ГОСТ 28498.
Ареометры общего назначения по ГОСТ 18481.
Стаканы стеклянные В-1-100 ТС, В-1-150 ТС, В-1-800 ТС по ГОСТ 25336.
Колбы стеклянные конические Кн-1-100-14/23 ТС, Кн-1-250-24/29 ТС по ГОСТ 25336.
Стаканчики для взвешивания СВ-19/9 по ГОСТ 25336.
Воронки ВР-56 ХС, ВР-75 ХС по ГОСТ 25336.
Пробирки П1-14-120 ХС, П1-16-150 ХС по ГОСТ 25336.
Колбы мерные 1-50-2, 1-100-2, 1-200-2, 1-250-2, 2-1000-2 по ГОСТ 1770.
Цилиндры 1-25-2, 1-50-2, 1-100-2, 1-250-2 по ГОСТ 1770.
Пипетки стеклянные 1-2-2-1, 1-2-2-2, 1-2-2-5, 1-2-2-10 по ГОСТ 29227 или автоматические с постоянной и переменной вместимостью на 0, 5, 1, 0 и 5, 0 см3.
Ступка 3 по ГОСТ 9147.
Бумага фильтровальная лабораторная по ГОСТ 12026.
Гемоглобин бычий лиофилизированный, содержание основного вещества не менее 95 %.
Тирозин, содержание основного вещества 98 %.
Реактив Фолина.
Кислота трихлоруксусная (ТХУ).
Кислота соляная по ГОСТ 3118.
Кислота ортофосфорная по ГОСТ 10678.
Кислота уксусная ледяная по ГОСТ 61.
Кислота борная по ГОСТ 9656.
Карбамид по ГОСТ 6691.
Натрий углекислый по ГОСТ 83.
Гидроокись натрия по ГОСТ 4328.
Вода дистиллированная по ГОСТ 6709.
Все реактивы должны относиться к подгруппе чистоты 2 (х. ч.) или 3 (ч. д. а.) по ГОСТ 13867, кроме ТХУ, которую используют марки ч.
Допускается применение других средств измерений с метрологическими характеристиками, вспомогательного оборудования, посуды, материалов с техническими характеристиками не ниже вышеуказанных и химических реактивов аналогичной квалификации.
6 Отбор и подготовка проб
6.1 Отбор проб
6.1.1 Ферментные препараты принимают партиями. Партией считают определенное количество продукции одного наименования, одинаково упакованной, изготовленной одним изготовителем по одному документу в определенный промежуток времени, сопровождаемое товаросопроводительной документацией, обеспечивающей прослеживаемость продукции.
6.1.2 В сопроводительном документе должны быть указаны:
- наименование предприятия-изготовителя;
- наименование ферментного препарата;
- номер партии;
- количество мест в партии;
- дата выработки;
- дата выдачи документа.
6.1.3 Для определения протеолитической активности ферментного препарата выборку упаковочных единиц проводят методом случайного отбора по ГОСТ 18321.
6.1.4 Из каждой отобранной упаковочной единицы отбирают точечную пробу:
- для сухих ферментных препаратов при помощи специального мешочного щупа, погружаемого на всю глубину единицы упаковки по вертикальной оси;
- жидких ферментных препаратов после тщательного перемешивания пробоотборником, погружаемым на всю глубину единицы упаковки по вертикальной оси.
6.1.5 Отобранные точечные пробы соединяют вместе и получают объединенную пробу:
- для сухих ферментных препаратов - массой не менее 150 г;
- жидких ферментных препаратов - не менее 1 дм3;
- ферментсодержащих объектов - не менее 500 г.
6.1.6 Объединенные пробы тщательно перемешивают, делят на две части и помещают в сухие чистые стеклянные банки с притертыми пробками или полиэтиленовые пакеты, которые затем запаивают.
Одну банку или один пакет передают в лабораторию для проведения микробиологических и физико-химических анализов. Другую(ой) банку (пакет) хранят для сухих препаратов - в течение одного года, для жидких препаратов - 6 мес.
6.1.7 На каждую(ый) банку (пакет) с пробой наклеивают этикетку с указанием:
- наименования препарата;
- даты выработки;
- номера партии;
- даты отбора пробы;
- массы нетто партии;
- должности и подписи лица, отобравшего пробу.
6.2 Подготовка проб
6.2.1 Приготовление основного раствора ферментного препарата
В стаканчик для взвешивания помещают анализируемую пробу сухого ферментного препарата массой (0, 1000 ± 0, 0005) г или жидкого ферментного препарата массой (1, 0000 ± 0, 0200) г и суспендируют в небольшом количестве дистиллированной воды. Суспензию количественно переносят в мерную колбу вместимостью 100 см3, доводят объем до метки дистиллированной водой при температуре 20 °С и тщательно перемешивают.
Приготовленный раствор является основным раствором ферментного препарата.
Раствор хранят в закрытой стеклянной посуде при температуре 20 °С не более 2 ч.
6.2.2 Приготовление рабочего раствора ферментного препарата
Рабочий раствор ферментного препарата готовят из основного раствора, приготовленного по 6.2.1, путем разведения его дистиллированной водой в мерных колбах вместимостью 100, 200 или 250 см3.
Рабочий раствор ферментного препарата готовят непосредственно перед проведением анализа.
7 Подготовка к анализу
7.1 Приготовление универсального буферного раствора молярной концентрации 0, 1 моль/дм3
7.1.1 Приготовление раствора уксусной кислоты молярной концентрации 0, 1 моль/дм3 (раствор А)
Концентрированную уксусную кислоту объемом 5, 7 см3 разводят в 300 см3 дистиллированной воды в мерной колбе вместимостью 1000 см3, доводят до метки дистиллированной водой при температуре 20 °С и перемешивают.
Раствор хранят в закрытой стеклянной посуде при температуре 20 °С в течение 30 сут.
7.1.2 Приготовление раствора ортофосфорной кислоты молярной концентрации 0, 1 моль/дм3 (раствор В)
Ортофосфорную кислоту объемом 6, 45 см3 разводят в 300 см3 дистиллированной воды в мерной колбе вместимостью 1000 см3, доводят до метки дистиллированной водой при температуре 20 °С и перемешивают.
Раствор хранят в закрытой стеклянной посуде при температуре 20 °С в течение 30 сут.
7.1.3 Приготовление раствора борной кислоты молярной концентрации 0, 1 моль/дм3 (раствор С)
Борную кислоту массой (6, 1800 ± 0, 0200) г растворяют в 300 см3 дистиллированной воды в мерной колбе вместимостью 1000 см3, доводят до метки дистиллированной водой при температуре 20 °С и перемешивают.
Раствор хранят в закрытой стеклянной посуде при температуре 20 °С в течение 30 сут.
7.1.4 Приготовление раствора гидроокиси натрия молярной концентрации 1, 0 моль/дм3
Гидроокись натрия массой (40, 0000 ± 0, 1000) г растворяют в 500 см3 дистиллированной воды в мерной колбе вместимостью 1000 см3, доводят до метки дистиллированной водой при температуре 20 °С и перемешивают.
Раствор хранят в закрытой стеклянной посуде при температуре 20 °С в течение 14 сут.
7.1.5 Приготовление универсального буферного раствора
При смешивании равных объемов растворов А, В и С получают универсальный буферный раствор со значением (2, 0 ± 0, 2) ед. рН, который используют для приготовления субстрата при определении протеолитической активности.
7.2 Приготовление буферных растворов для определения протеолитической активности в ферментных препаратах
7.2.1 Для кислых протеаз используют универсальный буферный раствор (см. 7.1.5).
7.2.2 Для слабокислых протеаз в конической колбе вместимостью 250 см3 к 100 см3 универсального буферного раствора (см. 7.1.5) добавляют 6, 0 см3 раствора гидроокиси натрия (см. 7.1.4) молярной концентрации 1, 0 моль/дм3, получая буферный раствор со значением 4, 7 ед. рН.
7.2.3 Для нейтральных протеаз в конической колбе вместимостью 250 см3 к 100 см3 универсального буферного раствора добавляют 10, 0 см3 гидроокиси натрия, получая буферный раствор со значением 7, 0 ед. рН.
7.2.4 Для щелочных протеаз в конической колбе объемом 250 см3 к 100 см3 универсального буферного раствора добавляют 14, 0 см3 гидроокиси натрия, получая буферный раствор со значением 9, 3 ед. рН.
7.2.5 Буферные растворы хранят в закрытой стеклянной посуде при температуре 4 °С в течение 3 сут.
7.3 Приготовление раствора гемоглобина с массовой долей 2, 0 % (субстрат)
2, 5 г бычьего гемоглобина предварительно растирают в фарфоровой ступке. Навеску растертого гемоглобина массой (2, 0000 ± 0, 0100) г взвешивают в стеклянном стакане вместимостью 100 см3 и растворяют в 50 см3 буферного раствора с соответствующим значением ед. рН по 7.2. После этого для получения субстрата к раствору гемоглобина добавляют (32, 0000 ± 0, 1000) г карбамида. Содержимое стакана количественно переносят в мерную колбу вместимостью 100 см3, доводят объем до метки буферным раствором с тем же значением рН и выдерживают в течение 1 ч при температуре 30 °С для денатурации белка. Так как карбамид изменяет значение рН буфера, особенно в кислой и слабокислой зонах рН, для получения необходимого рН субстрата раствор гемоглобина готовят на буферном растворе с более низким значением рН в соответствии с таблицей 1.
Таблица 1
|
рН буфера
|
рН субстрата
|
|
2, 0
|
3, 0
|
|
4, 7
|
5, 3
|
|
7, 0
|
7, 0
|
|
9, 3
|
9, 0
|
Раствор гемоглобина хранят в закрытой стеклянной посуде при температуре 4 °С в течение 3 сут.
7.4 Приготовление раствора углекислого натрия молярной концентрации 0, 5 моль/дм3
Навеску безводного углекислого натрия массой (53, 0000 ± 0, 1000) г растворяют в 500 см3 дистиллированной воды в мерной колбе вместимостью 1000 см3. Объем доводят до метки дистиллированной водой при температуре 20 °С и перемешивают.
Раствор хранят в закрытой стеклянной посуде при температуре 20 °С в течение 14 сут.
7.5 Приготовление раствора трихлоруксусной кислоты с массовой долей 5 %
Навеску ТХУ массой (5, 0000 ± 0, 1000) г растворяют в 50 см3 дистиллированной воды в мерной колбе вместимостью 100 см3. Объем доводят до метки дистиллированной водой при температуре 20 °С и перемешивают.
Раствор хранят в закрытой стеклянной посуде при температуре 20 °С в течение 30 сут.
7.6 Приготовление раствора реактива Фолина
Раствор реактива Фолина готовят в конической колбе вместимостью 100 см3 путем разведения реактива Фолина дистиллированной водой в соотношении 1:2 (одна часть реактива Фолина и две части дистиллированной воды).
Раствор реактива Фолина хранят в закрытой стеклянной посуде при температуре 20 °С в течение 7 сут.
7.7 Вычисление тирозинового эквивалента
Протеолитическую активность ферментного препарата вычисляют по тирозину. Для этого строят градуировочный график зависимости оптической плотности от концентрации тирозина и по нему вычисляют тирозиновый эквивалент (ТЭ), т.е. оптическую плотность, которая соответствует 1, 0 мкмоль тирозина в 1 см3 градуировочного раствора.
7.7.1 Приготовление раствора соляной кислоты молярной концентрации 0, 2 моль/дм3
Концентрированную соляную кислоту объемом 16, 45 см3 разводят в 300 см3 дистиллированной воды в мерной колбе вместимостью 1000 см3, доводят до метки дистиллированной водой при температуре 20 °С и перемешивают.
Раствор хранят в закрытой стеклянной посуде при температуре 20 °С в течение 30 сут.
7.7.2 Приготовление основного раствора тирозина концентрации 10-3 моль/дм3
В мерную колбу вместимостью 100 см3 помещают навеску тирозина массой (0, 0181 ± 0, 0001) г и растворяют в растворе соляной кислоты молярной концентрации 0, 2 моль/дм3, приготовленном по 7.7.1.
Раствор хранят в закрытой стеклянной посуде при температуре 20 °С в течение 14 сут.
7.7.3 Приготовление рабочих растворов тирозина
В мерную колбу вместимостью 50 см3 вносят основной раствор тирозина, приготовленный по 7.7.2 в соответствии с таблицей 2, и доводят до метки раствором соляной кислоты молярной концентрации 0, 2 моль/дм3, приготовленным по 7.7.1, получая рабочие растворы тирозина разной концентрации.
Таблица 2
|
Объем раствора тирозина молярной концентрации 10-3 моль/дм3, см3
|
Молярная концентрация тирозина в рабочем растворе, мкмоль/см3
|
|
1, 0
|
0, 02
|
|
2, 0
|
0, 04
|
|
4, 0
|
0, 08
|
|
5, 0
|
0, 10
|
|
7, 5
|
0, 15
|
|
10, 0
|
0, 20
|
7.7.4 Построение градуировочного графика
В шесть пробирок 16 х 150 мм вносят по 1 см3 рабочего раствора тирозина разной концентрации (см. 7.7.3) и добавляют при перемешивании по 5 см3 раствора углекислого натрия молярной концентрации 0, 5 моль/дм3, приготовленного по 7.4, и по 1 см3 раствора реактива Фолина, приготовленного по 7.6. Контрольную пробу готовят так же, но вместо раствора тирозина используют 1 см3 дистиллированной воды. Реакционную смесь выдерживают в ультратермостате при температуре (30, 0 ± 1, 0) °С в течение 20 мин (по секундомеру). Интенсивность окраски измеряют на фотоэлектроколориметре или спектрофотометре против контрольной пробы при длине волны λ = 670 нм в кюветах с толщиной поглощающего свет слоя 10 мм.
Для построения градуировочного графика вычисляют среднеарифметическое значение оптической плотности трех параллельных измерений для каждой концентрации рабочих растворов тирозина. По полученным значениям строят градуировочный график зависимости оптической плотности от концентрации тирозина (мкмоль/см3), который представлен на рисунке 1.
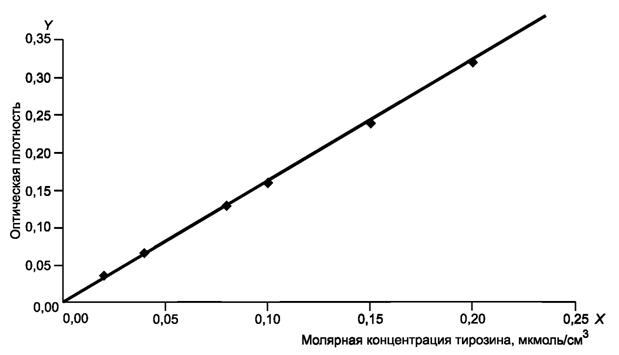
Рисунок 1
На оси абсцисс X откладывают значения молярной концентрации тирозина, мкмоль/см3, на оси ординат Y - соответствующие им значения оптической плотности D при λ = 670 нм.
По градуировочному графику находят тирозиновый эквивалент (ТЭ), соответствующий оптической плотности 1 мкмоль тирозина в 1 см3.
В данном случае 0, 1 мкмоль/см3 соответствует значению оптической плотности 0, 16, тогда 1, 0 мкмоль/см3 тирозина соответствует значению оптической плотности, равному 1, 6, следовательно, ТЭ равен 1, 6.
ТЭ необходимо устанавливать для каждой новой партии реактива Фолина, а также при смене прибора.
8 Условия проведения анализа
Анализ проводят в следующих лабораторных условиях:
- температура ... (20 ± 5) °С;
- относительная влажность воздуха ... от 45 % до 80 %;
- атмосферное давление ... от 630 до 800 мм. рт. ст.
9 Проведение анализа
9.1 Каждое разведение рабочего раствора ферментного препарата анализируют в двух повторностях. Для анализа берут две параллельные навески препарата.
В две пробирки размером 16 х 150 мм вносят по 1 см3 субстрата, приготовленного по 7.3, помещают их в ультратермостат при температуре (30, 0 ± 1, 0) °С и выдерживают в течение 5 мин.
9.2 В пробирки с субстратом добавляют по 1 см3 рабочего раствора ферментного препарата, приготовленного по 6.2.2, предварительно термостатированного в течение 3-4 мин при температуре (30, 0 ± 1, 0) °С. Пробирки встряхивают и оставляют в ультратермостате или водяном термостате для проведения ферментативной реакции на 10 мин при температуре (30, 0 ±, 0) °С (с точностью, определяемой по секундомеру от начала ферментативной реакции).
9.3 По окончании ферментативной реакции в обе пробирки к смеси добавляют по 2 см3 раствора ТХУ, приготовленного по 7.5, для осаждения непрогидролизованного белка и высокомолекулярных пептидов. Для их полного осаждения смесь перемешивают на встряхивателе и выдерживают в течение 10 мин, после чего фильтруют через бумажный фильтр в сухие пробирки размером 14 х 120 мм. Фильтрат должен быть совершенно прозрачен.
9.4 В чистые пробирки размером 16 х 150 мм вносят по 1 см3 фильтрата, добавляют по 5 см3 раствора углекислого натрия, приготовленного по 7.4, перемешивают, затем приливают по 1 см3 раствора реактива Фолина, приготовленного по 7.6, и реакционную смесь выдерживают в ультратермостате при температуре (30, 0 ± 1, 0) °С в течение 20 мин (по секундомеру). В процессе реакции растворы приобретают голубую окраску.
9.5 В контрольную пробирку размером 16 х 150 мм вносят 1 см3 рабочего раствора ферментного препарата того же разведения, что и в 6.2.2, добавляют 2 см3 раствора ТХУ, приготовленного по 7.5, 1 см3 субстрата, приготовленного по 7.3, выдерживают в ультратермостате или водяном термостате при температуре 30 °С в течение 10 мин, после чего фильтруют. Дальнейшие операции осуществляют аналогично 9.4.
9.6 Интенсивность окраски реакционной смеси (см. 9.4) определяют на фотоэлектроколориметре или спектрофотометре при длине световой волны λ = 670 нм в кюветах толщиной поглощающего свет слоя 10 мм на фоне контрольной пробирки (см. 9.5).
Количество фермента, взятого на анализ, должно быть рассчитано так, чтобы в реакционной смеси (см. 9.4) измеряемые величины оптической плотности в кювете с толщиной поглощающего свет слоя 10 мм находились в диапазоне значений от 0, 10 до 0, 21.
При отклонении оптической плотности от указанных значений необходимо подобрать разведение препарата таким образом, чтобы оптическая плотность окрашенных растворов реакционной смеси соответствовала указанным пределам диапазона.
10 Оформление результатов измерений
10.1 Протеолитическую активность ферментного препарата ПС, ед. ПС/г или ед. ПС/см3, вычисляют по формуле
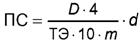 ,
,
(1)
где D - оптическая плотность;
4 - коэффициент, учитывающий степень разведения раствора фермента, взятого на анализ, после добавления ТХУ;
ТЭ - тирозиновый эквивалент, соответствующий оптической плотности 1 мкмоль тирозина и определяемый по градуировочному графику (см. 7.7);
10 - время гидролиза субстрата, мин;
m - масса ферментного препарата, взятая на анализ (расчет ведется на 1 см3 рабочего раствора ферментного препарата), г;
d - плотность ферментного препарата, определенная по ГОСТ 18995.1 (для жидких препаратов), г/см3.
10.2 Вычисления проводят до второго десятичного знака с последующим округлением до первого десятичного знака, если полученное значение протеолитической активности 100 ед. ПС/г (ед. ПС/см3) и менее. Вычисления проводят до первого десятичного знака с последующим округлением до целого числа, если полученное значение протеолитической активности более 100 ед. ПС/г (ед. ПС/см3).
10.3 За окончательный результат принимают среднеарифметическое значение двух параллельных измерений, выполненных в условиях повторяемости, если выполняется условие приемлемости (4).
Границы относительной погрешности δ = ± 7 % (соответствуют значению относительной расширенной неопределенности U0, 95 при коэффициенте охвата k = 2).
Результат анализа представляют в виде
X̅±Δ при Р=0, 95,
(2)
где X̅ - среднеарифметическое значение двух параллельных измерений, признанных приемлемыми, ед. ПС/г (ед. ПС/см3);
Δ - границы абсолютной погрешности измерений, ед. ПС/г (ед. ПС/см3), вычисляемые по формуле
Δ=X̅·δ·0, 01 или Δ=0, 07·X̅.
(3)
Наименьшие разряды числовых значений результата измерения и показателей точности должны быть одинаковы.
Значащих цифр численных показателей точности измерений должно быть не более двух.
11 Сходимость и воспроизводимость результатов
11.1 Результаты измерений, полученные в условиях повторяемости (сходимости), признаются удовлетворительными, если выполняется условие приемлемости
|X1-X2|≤0, 01·r·X̅,
(4)
где Х1 и Х2 - результаты двух параллельных измерений протеолитической активности ферментного препарата, полученные в условиях повторяемости, ед. ПС/г или ед. ПС/см3;
0, 01 - коэффициент для пересчета процентов в абсолютные значения;
r - предел повторяемости (сходимости), равный 8 %;
X̅ - среднеарифметическое значение двух параллельных измерений протеолитической активности, ед. ПС/г или ед. ПС/см3.
11.2 Результаты измерений, полученные в условиях воспроизводимости по ГОСТ ИСО 5725-6, признаются удовлетворительными, если выполняется условие приемлемости
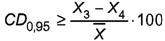 ,
,
(5)
где CD0, 95 - критическая разность, равная 10 %;
Х3 и Х4 - результаты двух окончательных результатов измерений, полученные в условиях воспроизводимости, ед. ПС/г или ед. ПС/см3;
X̅ - среднеарифметическое значение двух измерений протеолитической активности, выполненных в двух разных лабораториях в условиях воспроизводимости, ед. ПС/г или ед. ПС/см3;
100 - коэффициент для пересчета в проценты.
12 Требования безопасности
12.1 Условия безопасного проведения работ
При выполнении измерений необходимо соблюдать правила техники безопасности при работе в лаборатории с химическими веществами по ГОСТ 12.1.007 и ГОСТ 12.4.103, требования электробезопасности при работе с электроустановками - по ГОСТ 12.2.007.0 и в соответствии с требованиями, изложенными в инструкциях по эксплуатации оборудования. Требования пожарной безопасности - по ГОСТ 12.1.004 и ГОСТ 12.1.018.
Помещение, где проводят работы с реактивами, должно быть оснащено приточно-вытяжной вентиляцией по ГОСТ 12.4.021.
Содержание вредных веществ в воздухе не должно превышать допустимых значений по ГОСТ 12.1.005.
Остатки проб ферментных препаратов утилизируют в порядке, установленном в руководстве по качеству в лаборатории.
12.2 Требования к квалификации персонала
К выполнению измерений, обработке и оформлению результатов допускаются инженеры-химики и лаборанты, имеющие среднее специальное образование, опыт работы с данным оборудованием и владеющие настоящим методом.
Приложение А
(справочное)
Системные названия протеолитических ферментов
Протеазы подразделяют на две основные группы: пептидазы (КФ 3.4.11-3.4.15) и протеиназы (КФ 3.4.21 - 3.4.24) [1].
Пептидазы (КФ 3.4.11-3.4.15) катализируют гидролиз пептидной связи с N- и (или) С-конца пептидной цепи:
- аминоацилпептидгидролазы (КФ 3.4.11) - аминопептидазы - расщепляют первую пептидную связь с N-конца полипептидной цепи;
- гидролазы пептидиламинокислот или ациламинокислот (КФ 3.4.12) - карбоксипептидазы - расщепляют первую пептидную связь с С-конца полипептидной цепи с высвобождением отдельных аминокислот или дипептидов;
- дипептидгидролазы (КФ 3.4.13) - дипептидазы - гидролизуют дипептиды;
- дипептидилпептидгидролазы (КФ 3.4.14) и пептидилдипептидгидролазы (КФ 3.4.15) катализируют расщепление дипептидов с N- и С-конца пептидной связи до низкомолекулярных пептидов и свободных аминокислот.
Протеиназы (КФ 3.4.21-24) катализируют гидролиз пептидных связей полипептидной цепи с образованием пептидов с различной молекулярной массой:
- сериновые (КФ 3.4.21) - в каталитическом центре находится триада аминокислот: аспарагиновая, гистидин, серии, имеют оптимальный рН в щелочной зоне;
- тиоловые (КФ 3.4.22) - в каталитическом центре находится SH-группа цистеина, имеют оптимальный рН в слабокислой или нейтральной зоне;
- карбоксильные (КФ 3.4.23) - в каталитическом центре находятся остатки дикарбоновых аминокислот, имеют оптимальный рН в кислой и слабокислой зоне;
- металлосодержащие (КФ 3.4.24) - в каталитическом центре находятся ионы металлов, ингибируются хилатными соединениями, имеют оптимальный рН в нейтральной зоне.
Библиография
|
[1]
|
Номенклатура ферментов, рекомендации номенклатурного комитета IUB. Нью-Йорк, Академическое изд., 1984 (Enzyme Nomenclature, recommendations of the nomenclature Committee of the IUB, N.Y., Academic Press, 1984)
|
![]() — Все документы — ГОСТы — ГОСТ 34430-2018 ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ. МЕТОД ОПРЕДЕЛЕНИЯ ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТИ
— Все документы — ГОСТы — ГОСТ 34430-2018 ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ. МЕТОД ОПРЕДЕЛЕНИЯ ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТИ Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
 Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
 «МК»: в России не отменят льготную ипотеку
«МК»: в России не отменят льготную ипотеку
 Аренда квартир в Москве подешевела на 10 %
Аренда квартир в Москве подешевела на 10 %
 Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
