![]() — Все документы — ГОСТы — ГОСТ 31792-2012 РЫБА, МОРСКИЕ БЕСПОЗВОНОЧНЫЕ И ПРОДУКТЫ ИХ ПЕРЕРАБОТКИ. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ДИОКСИНОВ И ДИОКСИНПОДОБНЫХ ПОЛИХЛОРИРОВАННЫХ БИФЕНИЛОВ ХРОМАТО-МАСС-СПЕКТРАЛЬНЫМ МЕТОДОМ
— Все документы — ГОСТы — ГОСТ 31792-2012 РЫБА, МОРСКИЕ БЕСПОЗВОНОЧНЫЕ И ПРОДУКТЫ ИХ ПЕРЕРАБОТКИ. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ДИОКСИНОВ И ДИОКСИНПОДОБНЫХ ПОЛИХЛОРИРОВАННЫХ БИФЕНИЛОВ ХРОМАТО-МАСС-СПЕКТРАЛЬНЫМ МЕТОДОМ
ГОСТ 31792-2012 РЫБА, МОРСКИЕ БЕСПОЗВОНОЧНЫЕ И ПРОДУКТЫ ИХ ПЕРЕРАБОТКИ. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ДИОКСИНОВ И ДИОКСИНПОДОБНЫХ ПОЛИХЛОРИРОВАННЫХ БИФЕНИЛОВ ХРОМАТО-МАСС-СПЕКТРАЛЬНЫМ МЕТОДОМ
Добавил:
Дата: [18.03.2018]
ГОСТ 31792-2012 РЫБА, МОРСКИЕ БЕСПОЗВОНОЧНЫЕ И ПРОДУКТЫ ИХ ПЕРЕРАБОТКИ. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ДИОКСИНОВ И ДИОКСИНПОДОБНЫХ ПОЛИХЛОРИРОВАННЫХ БИФЕНИЛОВ ХРОМАТО-МАСС-СПЕКТРАЛЬНЫМ МЕТОДОМ
Fish, marine invertebrates and products of their processing. Determination of dioxins and dioxin-like biphenyls content by GC-MS method
Дата введения - 1 июля 2013 г.
Введен впервые
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 Подготовлен ГУ "НПО "Тайфун" Федеральной службы по гидрометеорологии и мониторингу окружающей среды, ФГУП "Атлантический научно-исследовательский институт рыбного хозяйства и океанографии" (ФГУП "Атлант НИРО")
2 Внесен Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 Принят Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 1 октября 2012 г. N 51)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004-97 |
Код страны по МК (ИСО 3166) 004-97 |
Сокращенное наименование национального органа по стандартизации |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргызстандарт |
|
Молдова |
MD |
Молдова-Стандарт |
|
Россия |
RU |
Росстандарт |
|
Узбекистан |
UZ |
Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 г. N 1629-ст межгосударственный стандарт ГОСТ 31792-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2013 г.
5 Настоящий стандарт подготовлен на основе применения ГОСТ Р 53184-2008
6 Введен впервые
1 Область применения
Настоящий стандарт предназначен для идентификации и выполнения измерений массовых концентраций 17 высокотоксичных полихлорированных дибензо-n-диоксинов и дибензофуранов: 2, 3, 7, 8-тетрахлордибензо-n-диоксина, 2, 3, 7, 8-пентахлордибензо-n-диоксина; 1, 2, 3, 4, 7, 8-гексахлордибензо-n-диоксина; 1, 2, 3, 6, 7, 8-гексахлордибензо-n-диоксина; 1, 2, 3, 7, 8, 9-гексахлордибензо-n-диоксина; 1, 2, 3, 4, 6, 7, 8-гептахлордибензо-n-диоксина; октахлордибензо-n-диоксина; 2, 3, 7, 8-тетрахлордибензофурана; 1, 2, 3, 7, 8-пентахлордибензофурана; 2, 3, 4, 7, 8-пентахлордибензофурана; 1, 2, 3, 4, 7, 8-гексахлордибензофурана; 1, 2, 3, 6, 7, 8-гексахлордибензофурана; 2, 3, 4, 6, 7, 8-гексахлордибензофурана; 1, 2, 3, 7, 8, 9-гексахлордибензофурана; 1, 2, 3, 4, 6, 7, 8-гептахлордибензофурана; 1, 2, 3, 4, 7, 8, 9-гептахлордибензофурана; октахлордибензофурана, а также 14 диоксиноподобных планарных полихлорированных бифенилов (ПХБ): 3, 3', 4, 4-тетрахлорбифенила; 3, 4, 4', 5-тетрахлорбифенила; 2, 3, 3', 4, 4'-пентахлорбифенила; 2, 3, 4, 4', 5-пентахлорбифенила; 2, 3, 3', 4, 4', 5-пентахлорбифенила; 2, 3, 4, 4', 5-пентахлорбифенила;
3, 3', 4, 4', 5-пентахлорбифенила; 2, 3, 3', 4, 4', 5-гексахлорбифенила; 2, 3, 3', 4, 4', 5'-гексахлорбифенила; 2, 3', 4, 4', 5, 5'-гексахлорбифенила; 3, 3', 4, 4', 5, 5'-гексахлорбифенила; 2, 2', 3, 3', 4, 4', 5-гептахлорбифенила; 2, 2', 3, 4, 4', 5, 5'-гептахлорбифенила; 2, 3, 3', 4, 4', 5, 5'-гептахлорбифенила в рыбе, морских беспозвоночных и продуктах их переработки.
Метод анализа основан на экстракции аналитов органическими растворителями, последовательной очистке экстракта с применением гель-фильтрации и колоночной хроматографии на различных сорбентах и количественном анализе методом хромато-масс-спектрометрии с использованием суррогатных изотопно-меченых стандартов - аналогов определяемых соединений, вводимых в пробу на стадии пробоподготовки.
Предел обнаружения различных конгенеров составляет соответственно от 0, 1 до 0, 5 нг/кг. Определению не мешает присутствие в образцах пестицидов, полихлорированных бифенилов и прочих галогенированных соединений.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты;
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 201-76 Три натрий фосфат. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2652-78 Калия бихромат технический. Технические условия
ГОСТ 4166-76 Реактивы. Натрий сернокислый. Технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 6995-77 Реактивы. Метанол-яд. Технические условия
ГОСТ 7636-85 Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Методы анализа
ГОСТ 9293-74 Азот газообразный и жидкий. Технические условия
ГОСТ 9968-86 Метилен хлористый технический. Технические условия
ГОСТ 20010-93 Перчатки резиновые технические. Технические условия
ГОСТ 24104-2001* Весы лабораторные. Общие технические требования
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-80) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины, определения и сокращения
3.1 В настоящем стандарте применены следующие термины с соответствующими определения ми:
3.1.1 полихлорированные дибензо-n-диоксины/дибензофураны; ПХДД/ДФ: Все конгенеры дибензо-n-диоксинов и дибензофуранов с содержанием в молекуле от одного до восьми атомов хлора.
3.1.2 суррогатный стандарт; S/S: Смесь конгенеров ПХДД/ДФ или ПХБ, изотопно-меченых по углероду 13C12, вводимая в пробу на стадии обработки для контроля полноты извлечения и количественных расчетов.
3.1.3 внутренний стандарт; R/S: Изотопномеченый по углероду 13C12 изомер ПХДД/ДФ, не входящий в состав S/S, вводимый в подготовленный к анализу экстракт для контроля конечного объема экстракта, проверки стабильности работы масс-спектрометра и оперативного контроля эффективности хроматографического разделения изомеров.
3.1.4 реконструированная масс-хроматограмма: Масс-хроматограмма, полученная компьютерной обработкой результатов анализа и показывающая значение сигнала, создаваемого ионами с заданной массой, а.е.м., характерной для конгенеров ПХДД/ДФ с определенной степенью хлорирования.
3.1.5 диоксиновый эквивалент токсичности; TEQ: Конгенеры ПХДД/ДФ или ПХБ - значение, выраженное в относительных величинах токсичности, установленных Всемирной организацией здравоохранения при условии, что токсичность изомера 2, 3, 7, 8-тетрахлордибензо-n-диоксина принята равной 1 (приложение А).
3.1.6 суммарный диоксиновый эквивалент токсичности пробы: Суммарная токсичность пробы, создаваемая токсичными конгенерами ПХДД/ДФ и пленарными ПХБ, определяемая как сумма произведений концентраций каждого конгенера на соответствующий эквивалент токсичности (2 TEQ, пг/г).
3.2 В настоящем стандарте применены следующие сокращения для нижеследующих конгенеров:
ТХДД - любой изомер тетрахлордибензо-n-диоксина;
ПеХДД - любой изомер пентахлордибензо-n-диоксина;
ГкХДД - любой изомер гексахлордибензо-n-диоксина;
ГпХДД - любой изомер гептахлордибензо-n-диоксина;
ОХДД - октахлордибензо-n-диоксин;
ТХДФ - любой изомер тетрахлордибензофурана;
ТХДФ - любой изомер пентахлордибензофурана;
ГкХДФ - любой изомер гексахлордибензофурана;
ГпХДФ - любой изомер гептахлордибензофурана;
ОХДФ - октахлордибензофуран;
ПХБ - любой конгенер полихлорбифенила.
Примечание - Порядок замещения для конкретного изомера указывается цифровым индексом, согласно правилам IUPAC, например, 1, 2, 3, 4, 5-пентахлордибензо-n-диоксин.
3.3 Для обозначения конгенеров пленарных полихлорированных бифенилов (ПХБ) используют следующие сокращения:
|
ПХБ |
77 |
- 3, 3', 4, 4'-тетраХБ |
|
ПХБ |
81 |
- 3, 4, 4', 5-тетраХБ; |
|
ПХБ |
105 |
- 2, 3, 3', 4, 4'-пентаХБ; |
|
ПХБ |
114 |
- 2, 3, 4, 4', 5-пентаХБ; |
|
ПХБ |
118 |
- 2, 3', 4, 4', 5-пентаХБ; |
|
ПХБ |
123 |
- 2', 3, 4, 4', 5-пентаХБ; |
|
ПХБ |
126 |
- 3, 3', 4, 4', 5-пентаХБ; |
|
ПХБ |
156 |
- 2, 3, 3', 4, 4', 5-гексаХБ; |
|
ПХБ |
157 |
- 2, 3, 3', 4, 4', 5'-гексаХБ; |
|
ПХБ |
167 |
- 2, 3', 4, 4', 5, 5'-гексаХБ; |
|
ПХБ |
169 |
- 3, 3', 4, 4', 5, 5'-гексаХБ; |
|
ПХБ |
170 |
- 2, 2', 3, 3', 4, 4', 5-гептаХБ; |
|
ПХБ |
180 |
- 2, 2', 3, 4, 4', 5, 5'-гептаХБ; |
|
ПХБ |
189 |
- 2, 3, 3', 4, 4', 5, 5'-гептаХБ. |
3.4 Для обозначения масс-спектрометрического режима анализа с использованием химической ионизации и детектированием отрицательно заряженных ионов используется сокращение ХИ ОИ.
4 Требования безопасности
Конгенеры ПХДД/ДФ относятся к высокотоксичным соединениям, обладающими канцерогенным, мутагенным и тератогенным действием. Для наиболее токсичного 2, 3, 7, 8-ТХДД LD50 = 0, 05 мг/кг, класс опасности 1.
Требования безопасности при работе с препаратами, содержащими ПХДД/ДФ, устанавливают в соответствии со специальными инструкциями по работе с диоксином, действующими на территории государства, принявшего стандарт.
Помещения, в которых проводится подготовка проб, должны быть оборудованы приточно-вытяжной вентиляцией. Исходные стандартные образцы для приготовления градуировочных растворов и аттестованных смесей следует хранить в запираемом металлическом шкафу.
Все операции по приготовлению аттестованных смесей и градуировочных растворов, содержащих ТХДД и его меченые аналога, добавление стандартов к образцу, подготовку образца к анализу следует проводить под тягой в вытяжном шкафу.
Пробы, подготовленные к анализу, и растворы стандартных образцов, градуировочных и контрольных растворов, аттестованных смесей следует держать в ампулах, закрытых завинчивающейся или запрессованной крышкой с тефлонированной резиновой прокладкой, прокалываемой микрошприцем.
Меры по оказанию первой помощи при попадании диоксина и его растворов на кожу, в глаза и желудок проводят в соответствии с инструкциями, действующими на территории государства, принявшего стандарт.
5 Средства измерений, вспомогательное оборудование, реактивы, материалы
5.1 Средства измерений
Хромато-масс-спектрометр высокого или низкого разрешения, позволяющий вести регистрацию отдельных ионов с заданными массами в диапазоне 50 - 600 а.е.м. при ионизации пробы в режиме электронного удара или химической ионизации с детектированием отрицательно заряженных ионов, оснащенный компьютерной системой обработки данных и имеющий предел обнаружения 2, 3, 7, 8-ТХДД в режиме селективного детектирования ионов (соотношение сигнал/шум) при инжекции 1, 0 пг данного вещества в прибор не хуже 5:1 (например, MAT-95XR DFS, JMS-700, Agilent-5975, Varian-320MS, ITMS-240MS, ITQ 900GC/MS, TSQ Quantum или другие с подобными характеристиками).
Кварцевые капиллярные хроматографические колонки 30(60) м, диаметром 0, 25 мм с неподвижной неполярной фазой типов (DB-5MS, VF-5MS) и (или) полярной фазой типов SP-Sil88, DB-DIOXIN (допускается использование и других колонок с неподвижными фазами, обеспечивающими разделение 2, 3, 7, 8-замещенных изомеров и других ПХДД и ПХДФ).
Термометр технический ртутный прямой с диапазоном измеряемой температуры от 0°С до 100°С с ценой деления 1°С и температуры 300°С с ценой деления 2°С по ГОСТ 28498.
Весы лабораторные общего назначения среднего класса точности с пределом допустимой погрешности до 0, 1 мг по ГОСТ 24104.
5.2 Вспомогательные устройства и лабораторная посуда
Микрошприцы хроматографические на 10 мкл, ценой деления 0, 1 мкл, например фирмы Hamilton N 700, по нормативным документам.
Автоматические дозаторы переменного объема (100 - 1000 мм3), с пределом погрешности не более ±0, 8%, например фирмы Eppendorf N 3111.000.165, по нормативным документам.
Автоматические дозаторы переменного объема (10 - 100 мм3), с пределом погрешности не более ±0, 6%, например Eppendorf N 3111.000.149, по нормативным документам.
Ротационный испаритель.
Аппарат для встряхивания проб.
Микроизмельчитель тканей, мощностью 300 - 500 Вт.
Шкаф сушильный, обеспечивающий поддержание температуры в диапазоне температур 90°С - 150°С.
Холодильник бытовой любой марки.
Муфельная печь любой марки, обеспечивающая нагрев в диапазоне температур 300°С - 800°С.
Пипетки 1-2-1, 2-2-5 по ГОСТ 29227.
Перчатки резиновые технические по ГОСТ 20010.
Цилиндры мерные исполнения 3, вместимостью 25, 50, 100, 250 см3 по ГОСТ 1770.
Стаканы мерные вместимостью 100, 500, 800 см3 по ГОСТ 25336.
Колбы круглодонные, исполнения 4, вместимостью 500 см3, 100 см3 по ГОСТ 25336.
Колбы плоскодонные конические исполнения 4, вместимостью 1000, 500, 250, 100 см3 по ГОСТ 25336.
Колбы мерные, 10, 50 см3 класса-2 по ГОСТ 1770.
Колбы грушевидные, 100 см3 исполнения 4 по ГОСТ 25336.
Воронки стеклянные конические 36 - 50, В-100-150 по ГОСТ 25336.
Колонки стеклянные, диаметром 8 мм, длиной 300 мм с верхним резервуаром (приложение Б).
Колонки стеклянные, диаметром 6 мм, длиной 150 мм с верхним резервуаром (приложение Б).
Колонки стеклянные для гель-фильтрации диаметром 18 мм, длиной 600 мм (приложение Б).
Колонки стеклянные диаметром 30 мм, длиной 400 мм, с фильтром Шотта (приложение Б).
Палочки стеклянные.
Краны тефлоновые типа Cole-Parmer N А-30503-00
Воронки делительные ВД-1-100 ХС по ГОСТ 25336.
Дефлегматор 250-14/23-29/32-ТС по ГОСТ 25336.
Холодильник ХПТ-1-300-14/23 ХС по ГОСТ 25336.
Эксикатор 2-250 по ГОСТ 25336.
Микрофлаконы на 0, 9 см3 с коническим дном, типа Wheaton, Supelco N 27333.
Стеклянные флаконы с завинчивающейся крышкой (Mini-Vials) вместимостью 2 см3 типа Supelco N 27023.
Стеклянные флаконы с завинчивающейся крышкой (Mini-Vials) вместимостью 4 см3 типа Supelco N 27024.
Тефлонированные прокладки (септы) диаметром 10 мм, для виал, типа Supelco N 27360-U.
Кримпер (устройство для герметизации виал) типа Supelco N 33195.
Ампулы темного стекла, медицинские, вместимостью 5 см3 типа Jena-Vitropack.
Насос водоструйный по ГОСТ 25336.
Баня водяная ультразвуковая.
5.3 Реактивы и материалы
Дихлорметан, х.ч., по ГОСТ 9968.
Метанол, х.ч., по ГОСТ 6995.
Силикагель Kieseigel 60, 70 - 230 мкм, импортный, например Merck N 7734.9025.
Алюминия окись 90, основная, например фирмы Merck N 1097.9050.
Натрий сернокислый безводный, х.ч., по ГОСТ 4166.
Калия бихромат, х.ч., по ГОСТ 2652.
Тринатрий фосфат, ч., по ГОСТ 201.
Гидроокись натрия, х.ч., по ГОСТ 4328.
Серная кислота концентрированная, ос.ч., по ГОСТ 4204.
Вода дистиллированная по ГОСТ 6709.
Гелий марки А.
Азот, ос.ч., по ГОСТ 9293.
Газовая смесь аргон-метан, 10% об. метана, ос.ч.
н-гексан, для следового анализа, импортный, например фирмы Merck, N 4368.2500.
н-декан, для следового анализа, импортный, например фирмы Merck, N 803405.0250.
н-нонан, для следового анализа, импортный, например фирмы Merck, N 806838.0250.
Волокнистый кварцевый материал СКВ.
Сорбент Bio-Beads S-X3, 200 - 400 mesh, Bio-Rad.Lab., N 152-2750.
5.4 Стандартные растворы и контрольные образцы
Изотопно-меченые суррогатные и внутренние стандарты ПХДД/ДФ, включающие:
a) S/Sпхдд / дф - раствор смеси изотопно-меченых по углероду 13C12 конгенеров ПХДД/ДФ в нонане, EDF-4053, производства компании Cambridge Isotope Laboratories, Inc., US (код по каталогу CIL N EDF4053), с погрешностью содержания каждого компонента + 10% (таблица 1).
Таблица 1 - Состав раствора S/SПХДД / ДФ
|
Компоненты |
Концентрация, мкг/см3 |
|
2, 3, 7, 8-ТХДД (13C12 99%) |
1, 0 |
|
1, 2, 3, 7, 8-ПеХДД (13C12 99%) |
1, 0 |
|
1, 2, 3, 6, 7, 8-ГхХДД (13C12 99%) |
1, 0 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДД (13C12 99%) |
1, 0 |
|
ОХДД (13C12 99%) |
2, 0 |
|
2, 3, 7, 8-ТХДФ (13C12 99%) |
1, 0 |
|
1, 2, 3, 7, 8-ПеХДФ (13C12 99%) |
1, 0 |
|
1, 2, 3, 6, 7, 8-ГхХДФ (13C12 99%) |
1, 0 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДФ (13C12 99%) |
1, 0 |
б) R/SПХДД / ДФ - раствор смеси внутренних стандартов ПХДД/ДФ в нонане ЕРА 23RIS производства Cambridge Isotope Laboratory, Inc., US (код по каталогу CIL N EDF4055), с погрешностью содержания каждого компонента + 10% (таблица 2).
Таблица 2 - R/SПХДД / ДФ
|
Компоненты |
Концентрация, мкг/см3 |
|
1, 2, 3, 4-ТХДД (13C12 99%) |
0, 5 |
|
1, 2, 3, 7, 8, 9-ГхХДД (13C12 99%) |
0, 5 |
Калибровочный стандарт, включающий раствор 18 токсичных конгенеров ПХДД/ДФ, производства Cambridge Isotope Laboratory, Inc., US (номер по каталогу CIL N EDF-7999-10x), с погрешностью содержания каждого компонента + 10% (таблица 3), раствор в нонане.
Таблица 3 - Состав калибровочного стандарта
|
Конгенер ПХДД |
Концентрация, нг/см3 |
Конгенер ПХДФ |
Концентрация, нг/см3 |
|
2, 3, 7, 8-ТХДД |
400 |
2, 3, 7, 8-ТХДФ |
400 |
|
1, 2, 3, 7, 8-ПеХДД |
2000 |
1, 2, 3, 7, 8-ПеХДф |
2000 |
|
1, 2, 3, 4, 7, 8-ГкХДД |
2000 |
2, 3, 4, 7, 8-ПеХДФ |
2000 |
|
1, 2, 3, 6, 7, 8-ГкХДД |
2000 |
1, 2, 3, 4, 7, 8-ГкХДФ |
2000 |
|
1, 2, 3, 7, 8, 9-ГкХДД |
2000 |
1, 2, 3, 6, 7, 8-ГкХДФ |
2000 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДД |
2000 |
2, 3, 4, 6, 7, 8-ГкХДФ |
2000 |
|
ОХДД |
4000 |
1, 2, 3, 6, 7, 8-ГкХДФ |
2000 |
|
2, 3, 4, 6, 7, 8-ГкХДФ |
2000 |
1, 2, 3, 7, 8, 9-ГкХДФ |
2000 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДФ |
2000 |
ОХДФ |
4000 |
Контрольный образец тканей рыбы с аттестованным содержанием ПХДД/ДФ и диоксинподобных планарных ПХБ (код по каталогу CIL N EDF2526), с содержанием конгенеров ПХДД/ДФ в диапазоне 10 - 50 нг/кг и конгенеров ПХБ в диапазоне 100 - 500 нг/кг.
Изотопно-меченые суррогатные и внутренние стандарты ПХБ, включающие:
a) S/SПХБ - раствор смеси изотопно-меченых суррогатных планарных ПХБ в нонане (код по каталогу CIL N ЕС4995), с погрешностью содержания каждого компонента ±10% (таблица 4).
Таблица 4 - Состав S/SПХБ
|
Конгенер ПХБ |
Концентрация, мкг/см3 |
Конгенер ПХБ |
Концентрация, мкг/см3 |
|
ПХБ 77 (13C12 99%) |
1, 0 |
ПХБ 156 (13C12 99%) |
1, 0 |
|
ПХБ 81 (13C12 99%) |
1, 0 |
ПХБ 157 (13C12 99%) |
1, 0 |
|
ПХБ 105 (13C12 99%) |
1, 0 |
ПХБ 167 (13C12 99%) |
1, 0 |
|
ПХБ 114 (13C12 99%) |
1, 0 |
ПХБ 169 (13C12 99%) |
1, 0 |
|
ПХБ 118 (13C12 99%) |
1, 0 |
ПХБ 170 (13C12 99%) |
1, 0 |
|
ПХБ 123 (13C12 99%) |
1, 0 |
ПХБ 180 (13C12 99%) |
1, 0 |
|
ПХБ 126 (13C12 99%) |
1, 0 |
ПХБ 189 (13C12 99%) |
1, 0 |
б) R/SПХБ - раствор 2, 3, 4, 4', 5, 6-гексахлорбифенила в нонане (код по каталогу CIL PCB N 166), с концентрацией (100 ± 5) мкг/см3.
Калибровочный стандарт, включающий раствор 14 планарных конгенеров ПХБ, производства Cambridge Isotope Laboratory (номер по каталогу CIL N ЕС-5000), с погрешностью содержания каждого компонента ± 10% (таблица 5), раствор в нонане.
Таблица 5 - Состав R/SПХБ
|
Конгенер ПХБ |
Концентрация, мкг/см3 |
Конгенер ПХБ |
Концентрация, мкг/см3 |
|
ПХБ 77 |
2, 0 |
ПХБ 156 |
2, 0 |
|
ПХБ 81 |
2, 0 |
ПХБ 157 |
2, 0 |
|
ПХБ 105 |
2, 0 |
ПХБ 167 |
2, 0 |
|
ПХБ 114 |
2, 0 |
ПХБ 169 |
2, 0 |
|
ПХБ 118 |
2, 0 |
ПХБ 170 |
2, 0 |
|
ПХБ 123 |
2, 0 |
ПХБ 180 |
2, 0 |
|
ПХБ 126 |
2, 0 |
ПХБ 189 |
2, 0 |
Допускается применение других средств измерений и оборудования с метрологическими характеристиками, а также других реактивов и материалов по качеству не нижеуказанных в настоящем стандарте.
6 Определение полихлорированных дибензо-n-диоксинов и дибензофуранов
6.1 Подготовка посуды, сорбентов и реактивов
6.1.1 Подготовка посуды
Стеклянную химическую посуду замачивают в растворе тринатрийфосфата на 6 - 7 ч, затем промывают водопроводной водой, моют горячей хромовой смесью, ополаскивают водопроводной водой, а затем трижды дистиллированной водой и сушат при температуре 300°С в сушильном шкафу.
6.1.2 Подготовка реактивов и материалов
Очистку растворителей н-гексана и дихлорметана осуществляют путем перегонки при атмосферном давлении с использованием стеклянной химической посуды в соответствии с правилами перегонки органических веществ.
Используемые растворители квалификации "для следового анализа" производства фирмы Merck или аналогичные используются без очистки.
Натрий сернокислый безводный марки ос.ч. прокаливают в муфельной печи 4 ч при температуре 400°С, охлаждают в эксикаторе, хранят в колбе со шлифом не более месяца.
Смесь гексан-дихлорметан (1:1) готовится смешением равных объемов гексана и дихлорметана в емкости вместимостью 5 дм3 из темного стекла, снабженной притертой пробкой.
Смесь гексан-дихлорметан (97:3) готовится смешением 970 см3 гексана и 30 см3 дихлорметана в емкости вместимостью 1 дм3 из темного стекла, снабженной притертой пробкой.
Смесь гексан-дихлорметан (40:60) готовится смешением 400 см3 гексана и 600 см3 дихлорметана в емкости вместимостью 1 дм3 из темного стекла, снабженной притертой пробкой.
Кварцевый волокнистый материал СКВ прокаливают в муфельной печи при 700°С в течение 30 мин и хранят в герметичной стеклянной таре не более месяца.
При подготовке и использовании каждой новой партии реактивов и материалов или замене одного из них проводят проверку путем выполнения всей процедуры анализа для холостого опыта и контрольной аттестованной смеси, оценивая результаты с учетом характеристик погрешности. Допускается использование растворителей и сорбентов других марок, обеспечивающих проведение анализа с заданной погрешностью.
6.1.3 Подготовка сорбентов
6.1.3.1 Активирование оксида алюминия
Навеску оксида алюминия массой 200 г помещают в кварцевый стакан и прокаливают в муфельной печи при 700°С в течение 8 ч. Активированную окись алюминия хранят в герметичной стеклянной таре не более 3 сут.
6.1.3.2 Активирование силикагеля
Навеску силикагеля массой 200 - 400 г промывают последовательно двойными объемами метанола, а затем активируют в муфельной печи 8 ч при 350°С. Активированный силикагель хранят в герметически закрытой стеклянной таре не более двух недель.
6.1.3.3 Приготовление силикагеля, модифицированного серной кислотой
Для приготовления партии силикагеля, модифицированного кислотой (SiO2/H2), тщательно смешивают 56 г активированного SiO2 и 24 см3 концентрированной H2SO4 (плотность 1, 83 г/см3). Кислоту необходимо приливать небольшими порциями в колбу с активированным SiO2, встряхивая содержимое колбы. Готовый модифицированный сорбент должен представлять собой однородную массу без комков. Хранят приготовленный сорбент в колбе, закрытой притертой стеклянной пробкой, в эксикаторе и используют в течение 1 мес. По истечении этого срока остатки сорбента утилизируют.
6.1.3.4 Приготовление силикагеля, модифицированного гидроксидом натрия
Силикагель, модифицированный щелочью, готовят на основе активированного силикагеля со сроком хранения не более одного дня. Для приготовления 100 г SiO2 + щелочь тщательно смешивают 67 г активированного SiO2 и 31 см3 1M водного раствора NaOH. Раствор щелочи приливают небольшими порциями в колбу с активированным SiO2 и встряхивают содержимое колбы. Готовый модифицированный сорбент должен представлять собой однородную массу без комков. Хранят приготовленный сорбент в колбе, закрытой стеклянной пробкой, вне эксикатора, используют в течение одного месяца.
6.1.3.5 Подготовка колонки для гель-фильтрации Bio-Beads SE-X3
20 г сухого полистирольного геля Bio-Beads SE-X3 помещают в чистую колбу вместимостью 250 см3, заливают смесью гексан-дихлорметан (1:1) и выдерживают 24 ч.
В колонку для гель-фильтрации, представляющую собой стеклянную трубку длиной 70 см и диаметром 20 мм с впаянным в нижней части пористым стеклянным фильтром Шотта и тефлоновым краном (рисунок Б.1, приложение Б.1), помещают слой кварцевого волокнистого материала СКВ и уплотняют его стеклянной палочкой. При закрытом кране наливают в колонку смеси гексан-дихлорметан (1:1) на 1/3 высоты рабочей части колонки. Переносят количественно сорбент в колонку, используя смесь гексан-дихлорметан (1:1). Пропускают через колонку 600 см3 смеси гексан-дихлорметан (1:1).
Подготовленный полистирольный материал для гель-фильтрации Bio-Beads SE-X3 хранят в набухшем состоянии в колонке под слоем растворителя.
6.2 Калибровка колонки Bio-Beads SE-X3
Калибровка колонки для гель-фильтрации заключается в определении объема элюента FI, после пропускания которого начинается выделение целевой фракции, содержащей ПХДД/ДФ, и объема элюента Fll, пропускание которого обеспечивает полное выделение целевой фракции из колонки.
В мини-виалу вместимостью 2 см3 вносят 1 см3 смеси гексан-дихлорметан (1:1), затем добавляют автоматическим дозатором 5 мкл раствора смеси калибровочного стандарта ПХДД/ДФ. Перемешивают содержимое виалы на ультразвуковой бане 30 с и количественно переносят в колонку для гель-фильтрации.
Элюируют колонку после внесения в нее раствора ПХДД/ДФ смесью гексан-дихлорметан (1:1) объемом 110 см3, пропуская растворитель со скоростью 1 мл/мин.
Отбирают в мерные цилиндры фракции в следующих объемах:
FI - 0 - 40 (40 см3);
FII - 40 - 50 (10 см3);
FIII - 50 - 60 (10 см3);
FIV - 60 - 100 (40 см3);
FV - 100 -110 (10 см3).
Концентрируют каждую фракцию на роторном испарителе до объема около 0, 5 - 1, 0 см3 и переносят количественно в мини-виалу, выпаривают потоком азота до 100 - 200 мкл, добавляют внутренний стандарт и определяют содержание ПХДД/ДФ в каждой фракции, как описано ниже.
Результат калибровки считается удовлетворительным, если суммарное содержание ПХДД/ДФ во фракциях Fl, FIll, FIV, FV не превышает 5% внесенного количества и составляет не менее 95% ПХДД/ДФ во фракции FII. В противном случае требуется повторный опыт и корректировка объемов отбрасываемой и собираемой фракций.
6.3 Подготовка градуировочных растворов ПХДД/ДФ и растворов изотопно-меченых суррогатных и внутренних стандартов
Градуировочные растворы смеси индивидуальных и изотопно-меченых ПХДД/ДФ используют для проверки времен удерживания конгенеров, линейного диапазона детектирования и расчета фактора отклика анализируемых конгенеров.
В качестве базового раствора смеси индивидуальных конгенеров ПХДД/ДФ используют смесь индивидуальных ПХДД/ДФ в нонане FDF-7999-Юх.
В качестве базового раствора суррогатного стандарта используют смесь изотопно-меченых по углероду 13C12 конгенеров ПХДД/ДФ в нонане EDF-4053.
В качестве базового раствора внутреннего стандарта ПХДД/ДФ используют смесь изотопно-меченых по углероду 13C12 конгенеров ПХДД/ДФ в нонане EDF-4055.
6.3.1 Приготовление градуировочных растворов
6.3.1.1 Приготовление раствора С1
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 2 см3 950 мкл н-декана, 10 мкл базового раствора EDF-7999-Юх и 40 мкл раствора EDF-4053.
6.3.1.2 Приготовление раствора С2
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 4 см3 1870 мкл н-декана, 50 мкл базового раствора EDF-7999-Юх и 80 мкл раствора EDF-4053.
6.3.1.3 Приготовление раствора С3
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 2 см3 910 мкл н-декана, 50 мкл базового раствора EDF-7999-Юх и 40 мкл раствора EDF-4053.
6.3.1.4 Приготовление раствора С4
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 2 см3 860 мкл н-декана, 100 мкл базового раствора EDF-7999-Юх и 40 мкл раствора EDF-4053.
6.3.1.5 Приготовление раствора С5
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 4 см3 760 мкл н-декана, 200 мкл базового раствора EDF-7999-Юх и 40 мкл раствора EDF-4053.
Концентрации градуировочных растворов (нг/см3) приведены в таблице 6.
Приготовленные градуировочные растворы можно хранить в герметически закрытых виалах при температуре не выше минус 10°С без доступа солнечного света не более 6 мес, в стеклянных запаянных ампулах не более двух лет.
Таблица 6 - Концентрации градуировочных растворов в
нанограммах/см3
|
Конгенер ПХДД/ДФ |
С1 |
C2 |
С3 |
С4 |
С5 |
|
2, 3, 7, 8-ТХДД |
4 |
10 |
20 |
40 |
80 |
|
1, 2, 3, 7, 8-ПеХДД |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 4, 7, 8-ГкХДД |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 6, 7, 8-ГкХДД |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 7, 8, 9-ГкХДД |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДД |
20 |
50 |
100 |
200 |
400 |
|
ОХДД |
40 |
100 |
200 |
400 |
800 |
|
2, 3, 7, 8-ТХДФ |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 7, 8-ПеХДФ |
20 |
50 |
100 |
200 |
400 |
|
2, 3, 4, 7, 8-ПеХДФ |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 4, 7, 8-ГкХДФ |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 6, 7, 8-ГкХДФ |
20 |
50 |
100 |
200 |
400 |
|
2, 3, 4, 6, 7, 8-ГкХДФ |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 6, 7, 8-ГкХДФ |
20 |
50 |
100 |
200 |
400 |
|
2, 3, 4, 6, 7, 8-ГкХДФ |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 7, 8, 9-ГкХДФ |
20 |
50 |
100 |
200 |
400 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДФ |
20 |
50 |
100 |
200 |
400 |
|
ОХДФ |
40 |
100 |
200 |
400 |
800 |
|
2, 3, 7, 8-ТХДД (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
1, 2, 3, 7, 8-ПеХДД (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
1, 2, 3, 6, 7, 8-ГхХДД (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДД (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ОХДД (13С1299%) |
80 |
80 |
80 |
80 |
80 |
|
2, 3, 7, 8-ТХДФ (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
1, 2, 3, 7, 8-ПеХДФ (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
1, 2, 3, 6, 7, 8-ГхХДФ (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДФ (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
6.3.2 Приготовление рабочего раствора изотопно-меченого суррогатного стандарта
Для приготовления рабочего раствора S/S-1 в мерную колбу вместимостью 50 см3 вносят автоматическим регулируемым дозатором 1000 мкл базового раствора EDF-4053 и доводят объем раствора до метки н-деканом. Обозначают полученный рабочий раствор как S/S-1. Концентрации суррогатных стандартов в рабочем растворе (нг/см3) приведены в таблице 7.
Таблица 7 - Концентрации суррогатных стандартов в рабочем растворе в нанограммах/см3
|
Конгенер ПХДД/ДФ |
S/SПХДД / ДФ базовый |
S/S-1 |
|
1, 2, 3, 7, 8-ПеХДД(13C12 99%) |
1000 |
20 |
|
1, 2, 3, 6, 7, 8-ГхХДД (13C12 99%) |
1000 |
20 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДД (13C12 99%) |
1000 |
20 |
|
ОХДД (13C12 99%) |
2000 |
40 |
|
2, 3, 7, 8-ТХДФ (13C12 99%) |
1000 |
20 |
|
1, 2, 3, 7, 8-ПеХДФ (13C12 99%) |
1000 |
20 |
|
1, 2, 3, 6, 7, 8-ГхХДФ (13C12 99%) |
1000 |
20 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДФ (13C12 99%) |
1000 |
20 |
Приготовленный раствор перемешивают на ультразвуковой бане 10 мин, расфасовывают в стеклянные ампулы по 1 см3. Ампулы запаивают и хранят до использования без доступа солнечного света не более двух лет.
6.3.3 Приготовление рабочего раствора изотопно-меченого внутреннего стандарта
Для приготовления рабочего раствора внутреннего стандарта в мерную колбу вместимостью 10 см3 вносят автоматическим регулируемым дозатором 1000 мкл базового раствора EDF-4055 и доводят объем раствора до метки н-деканом. Обозначают полученный рабочий раствор внутреннего стандарта как RIS-1. Концентрации внутренних стандартов в рабочем растворе (нг/см3) приведены в таблице 8.
Таблица 8 - Концентрации внутренних стандартов в рабочем растворе в нанограммах/см3
|
Конгенер ПХДД/ДФ |
R/SПХДД / ДФ базовый |
R/S-1 |
|
1, 2, 3, 4-ТХДД (13C12 99%) |
500 |
50 |
|
2, 3, 7, 8, 9-ГхХДД (13C12 99%) |
500 |
50 |
Приготовленный раствор перемешивают на ультразвуковой бане 10 мин, расфасовывают в стеклянные ампулы по 1 см3. Ампулы запаивают и хранят до использования без доступа солнечного света не более двух лет.
6.4 Подготовка проб для анализа
Образцы рыбы и морепродуктов хранят замороженными при температуре минус 20°С не более двух месяцев.
Для анализа отбирают из каждой партии рыбы не менее трех тушек общей массой 0, 5 - 1, 0 кг, при необходимости размораживают образцы при комнатной температуре.
Примечание - Если экземпляры рыбы имеют массу свыше 1 кг; допускается использовать для анализа серединную часть тушки от трех экземпляров рыбы общей массой 1 кг.
Отделяют голову и внутренности рыбы и гомогенизируют тушку на шнековой мясорубке с диаметром отверстий измельчителя не более 3 мм. Полученный фарш пропускают через мясорубку повторно. Отбирают для анализа образец фарша массой 50 г, остаток замораживают при минус 20°С и хранят в стеклянной таре до завершения анализа.
Печень рыбы размораживают, гомогенизируют образец массой не менее 100 г на шнековой мясорубке. Если рыба не разделана, размораживают тушки и извлекают печень не менее чем от трех экземпляров, так чтобы масса образца была не менее 100 г.
Неочищенные щупальца кальмара размораживают, отбирают пробу массой 0, 5 - 1 кг, гомогенизируют на шнековой мясорубке с диаметром отверстий измельчителя не более 3 мм. Полученный фарш пропускают через мясорубку повторно. Отбирают для анализа образец фарша массой 50 г, остаток замораживают при минус 20°С и хранят до завершения анализа.
У мелких ракообразных (креветок) отделяют голову и кишечный канал, гомогенизируют не очищенные от панциря тушки так, чтобы масса пробы составляла не меньше 100 г.
Пробы рыбьего жира используют без подготовки.
7 Проведение испытаний
7.1 Экстракция ПХДД/ДФ
Извлечение ПХДД/ДФ из образца проводится методом колоночной экстракции. Навеску гомогенизированного образца взвешивают в стакане вместимостью 250 см3 с точностью до 0, 01 г, добавляют к нему 120 - 150 г безводного Na2SO4 и тщательно перемешивают стеклянной палочкой. Образец с добавленным Na2SO4 выдерживают в течение 1 ч, периодически перемешивая, при необходимости добавляя некоторое количество Na2SO4 Перетирают образец пестиком в стеклянной ступке. Полностью высушенный образец представляет собой легко пересыпающуюся массу.
Для анализа рыбы и тканей с низким содержанием липидов используют навеску 15 - 20 г, при анализе печени, гонад, мышц с высоким содержание липидов - 6 - 8 г.
Экстракцию образца проводят в стеклянной колонке с внутренним диаметром 30 мм и высотой рабочей части 30 см, имеющей в своей нижней части впаянный стеклянный фильтр Шотта и снимающийся тефлоновый кран. На стеклянный фильтр помещают слой кварцевой ваты СКВ и уплотняют ее стеклянной палочкой. Помещают 1/3 массы образца в колонку; в следующую 1/3 массы сначала вносят 50 мкл изотопно-меченого раствора суррогатного стандарта S/S-1, перемешивают стеклянной палочкой, а затем помещают в колонку; после этого в колонку переносят остаток пробы и уплотняют содержимое колонки постукиванием.
Экстрагируют ПХДД/ДФ, пропуская через колонку с пробой 300 см3 смеси гексан-дихлорметан (1:1) со скоростью 3 - 4 мл/мин. Вытекающий из колонки экстракт-элюат собирают в круглодонную колбу вместимостью 500 см3.
Экстракт-элюат концентрируют на роторном испарителе при температуре 50°С до объема около 50 см3. Взвешивают грушевидную колбу 100 см3 и количественно переносят в нее сконцентрированный экстракт, обмывая стенки колбы смесью гексан-дихлорметан (1:1). Экстракт концентрируют на роторном испарителе до объема около 1 см3, добавляют около 1 см3 дихлорметана и очищают методом колоночной хроматографии.
Пробу рыбьего жира массой 1 г растворяют в 20 см3 смеси гексан-дихлорметан (1:1) и очищают методом колоночной хроматографии.
7.2 Очистка экстракта методом колоночной хроматографии
7.2.1 Отделение липидов и высокомолекулярных соединений методом гель-фильтрации
Из подготовленной колонки Bio-Beads SE-X3 сливают через тефлоновый кран растворитель и, не допуская высыхания верхнего слоя, промывают колонку, пропуская последовательно 35 см3 смеси метанол-дихлорметан (1:4) и 65 см3 смеси гексан-дихлорметан (1:1). Смесь такого же состава, гексан-дихлорметан (1:1), используют в качестве элюента.
После окончания промывки сорбента под колонку ставят мерный цилиндр вместимостью 50 см3 и вносят в колонку сконцентрированный экстракт. Стенки колбы из-под экстракта обмывают не менее пяти раз элюентом и смывки также вносят в колонку.
Пропускают элюат со скоростью 1 мл/мин, регулируя скорость тефлоновым краном. После пропускания 50 см3 элюата (фракция FI) заменяют цилиндр и отбирают целевую фракцию FII. Когда объем целевой фракции достигнет 50 см3, цилиндр с собранной фракцией FII извлекают из-под колонки.
Переносят фракцию FII в грушевидную колбу и концентрируют на роторном испарителе до объема ~1 см3 и далее очищают на колонке с активированным и модифицированным силикагелем.
7.2.2 Очистка на колонке с силикагелем
Помещают в стеклянную колонку с внутренним диаметром 8 мм и длиной рабочей части 200 мм, с резервуаром для элюата в верхней части слой кварцевой ваты заполняют в следующем порядке:
- 1 см3 SiO2акт;
- 1 см3 SiO2/NaOH;
- 1 см3 SiO2акт;
- 3 см3 SiO2/H2SO4;
- 1 см3 SiO2акт;
- слой безводного Na2SO4 на 1, 0 - 1, 5 см по высоте колонки.
Каждый вносимый слой уплотняют постукиванием.
Для смачивания сорбентов через колонку пропускают 10 см3 гексана. Под колонку подставляют чистую грушевидную колбу вместимостью 50 см3 для сбора элюата. Затем вносят сконцентрированную фракцию FII, собранную с колонки Bio-Beads SE-X3. Элюируют аналиты 50 см3 гексана. Стенки колбы обмывают гексаном не менее пяти раз, смывки вносят в колонку последовательно. Элюат концентрируют на роторном испарителе до объема около 1 см3.
7.2.3 Очистка на активированном оксиде алюминия
Используют колонку с внутренним диаметром 6 мм и длиной рабочей части 150 мм, с резервуаром для элюента в верхней части. На слой кварцевой ваты вносят 5 г сорбента. Пропускают через колонку 5 см3 гексана. После прохождения гексана в колонку вносят сконцентрированный элюат, собранный после колонки с силикагелем. Пропускают через колонку 50 см3 смеси гексан-дихлорметан (97:3), обмывают стенки колбы элюатом не менее пяти раз, смывы вносят в колонку последовательно. Отобранную фракцию утилизируют. Далее пропускают через колонку 50 см3 смеси гексан-дихлорметан (40:60) (об.), отбирая в чистую грушевидную колбу целевую фракцию Ф2, содержащую ПХДД/ДФ. Фракцию Ф2 концентрируют на роторном испарителе под вакуумом до объема около 0, 5 см3.
7.2.4 Концентрирование для инструментального анализа
Сконцентрированную фракцию Ф2 после колонки с активированным оксидом алюминия количественно переносят с помощью гексана во флакон mini-Vial с оттянутым донышком. Избыток гексана осторожно удаляют потоком азота. Когда объем растворителя во флаконе достигнет примерно 100 мкл, автоматическим дозатором добавляют 20 мкл раствора внутреннего стандарта в декане RIS-1 и продолжают отдув до объема добавленного декана. Герметизируют флакон тефлонированной прокладкой и крышкой и передают для инструментального анализа.
7.3 Выполнение измерений
7.3.1 Хромато-масс-спектрометрия низкого разрешения в режиме химической ионизации пробы с детектированием отрицательно заряженных ионов (ХИ ОИ)
Данный метод анализа обладает всеми преимуществами масс-спектрометрии и характеризуется высокой специфичностью ионизации аналитов ПХДЦ7ДФ, за счет чего снижается мешающее влияние посторонних веществ, присутствующих в пробе, и повышается надежность идентификации и чувствительность анализа. Метод позволяет использовать сравнительно недорогую аппаратуру низкого разрешения.
7.3.1.1 Подготовка хромато-масс-спектрометра
Хромато-масс-спектрометр готовят для анализа в режиме химической ионизации пробы с детектированием отрицательно заряженных ионов (ХИ ОИ) в соответствии с инструкцией по эксплуатации. В качестве газа-реагента используют смесь аргон-метан. Проверяют настройку и соответствие паспортной чувствительности прибора. Устанавливают программу анализа для хроматографического разделения конгенеров ПХДД/ДФ с использованием малополярной колонки типа DB-5MS. Примерный вид программы приведен ниже:
а) хроматографическая программа:
режим инжектора .................................... splitless;
задержка продувки инжектора ........................ 1 мин;
время сброса растворителя .......................... 5 мин;
тип колонки ........................................ DB-5MS;
длина колонки ...................................... 30 м;
диаметр колонки .................................... 25 мм;
толщина пленки фазы ................................ 25 мкм.
Программирование температуры;
начальная температура колонки ...................... 160°С;
начальное время задержки ........................... 1 мин;
скорость нагрева колонки ........................... 10°С/мин до
.................................................... 220°С, 3°С/мин
.................................................... до 300°С;
температура инжектора .............................. 290°С;
скорость потока гелия через колонку ................ 1 см3/мин;
б) режим масс-спектрометра
температура интерфейса ............................. 290°С;
температура ионного источника ...................... 200°С;
селективное сканирование ........................... массы ионов
................................................... (см. таблицу 9);
газ-реагент ....................................... аргон-метан, 10%
................................................... об. метана;
давление газа-реагента ........................ 2, 2 - 2, 5 мм рт.ст.;
инжектируемый объем ............................... 1 мкл.
Масс-спектрометрический анализ проводят в режиме селективного сканирования характеристических ионов аналитов. При химической ионизации ПХДД/ДФ максимальную интенсивность в спектре показывают ионы молекулярного кластера и ионы, образованные выбросом атома хлора из молекулярного иона. Значения масс характеристических ионов, используемых в анализе, приведены в таблице 9.
Таблица 9
|
Анализируемая группа конгенеров ПХДЦ/ДФ |
Тип иона |
Характеристические ионы, m/e, а.е.м. |
Соотношение интенсивностей сигнала ионов | |
|
ТХДД |
Mˉ, (M+2)ˉ, (M+4)ˉ |
320; |
322; 324 |
0, 8:1:0, 5 |
|
[13C12]-2, 3, 7, 8-ТХДД |
(M+2)ˉ, (M+4)ˉ |
334; |
336 |
1:0, 5 |
|
[13C12]-1, 2, 3, 4-ТХДД |
(M+2)ˉ, (M+4)ˉ |
334; |
336 |
1:0, 5 |
|
ПеХДД |
Mˉ, (M+2)ˉ, (M+4)ˉ |
354; |
356; 358 |
0, 7:1:0, 5 |
|
[13C12]-1, 2, 3, 7, 8-ПеХДД |
Mˉ, (M+2)ˉ |
366; |
368 |
0, 7:1 |
|
ГхХДД |
(M-Cl)ˉ, (M-Cl+2)ˉ (M-Cl+4)ˉ |
353; |
355; 357 |
0, 6:1:0, 6 |
|
[13C12]-1, 2, 3, 6, 7, 8-ГхХДД |
(M-Cl+2)ˉ, (M-Cl+4)ˉ |
367; |
369 |
1:0, 6 |
|
[13C12]-1, 2, 3, 7, 8, 9-ГхХДД |
(M-Cl+2)ˉ, (M-Cl+4)ˉ |
367; |
369 |
1:0, 6 |
|
ГпХДД |
(M-Cl)ˉ, (M-Cl+2)ˉ, (M-Cl+4)ˉ |
387; |
389; 391 |
0, 3:1:0, 7 |
|
[13C12]-1, 2, 3, 4, 6, 7, 8-ГпХДД |
(M-Cl+2)ˉ, (M-Cl+4)ˉ |
401; |
403 |
1:0, 7 |
|
ОХДД |
(M-Cl+2)ˉ, (M-Cl+4)ˉ (M-Cl+6)ˉ |
423; |
425; 427 |
0, 4:1:0, 3 |
|
[13C12]-ОХДД |
(M-Cl+2)ˉ, (M-Cl+4)ˉ |
435; |
437 |
0, 4:1 |
|
ТХДФ |
Mˉ, (M+2)ˉ; (M+4)ˉ |
304; |
306; 308 |
0, 7:1:0, 5 |
|
[13C12]-2, 3, 7, 8-ТХДФ |
(M+2)ˉ; (M+4)ˉ |
316; |
318 |
0, 7:1 |
|
ПХДФ |
Mˉ, (M+2)ˉ, (M+4)ˉ |
338; |
340; 342 |
0, 6:1:0, 7 |
|
[13C12]-1, 2, 3, 7, 8-ПеХДФ |
(M+2)ˉ, (M+4)ˉ |
352; |
354 |
1:0, 7 |
|
ГхДФ |
Mˉ, (M+2)ˉ, (M+4)ˉ |
372; |
374; 376 |
0, 5:1:0, 8 |
|
[13C12]-1, 2, 3, 6, 7, 8-ГхХДФ |
(M+2)ˉ, (M+4)ˉ |
386; |
388 |
1:0, 8 |
|
ГпХДФ |
Mˉ, (M+2)ˉ, (M+4)ˉ |
406; |
408; 410 |
0, 4:1:0, 9 |
|
[13C12]-1, 2, 3, 4, 6, 7, 8-ГпХДФ |
(M+2)ˉ, (M+4)ˉ |
420; |
422 |
1:0, 9 |
|
ОХДФ |
Mˉ, (M+2)ˉ, (M+4)ˉ |
442; |
444; 446 |
0, 9:1:0, 7 |
Для повышения чувствительности анализа режим масс-спектральной съемки разбивают на пять сегментов, в течение которых прибор фиксирует те или иные группы ионов. Примерная длительность сегментов и детектируемые ионы приведены в таблице 10.
Таблица 10
|
Сегмент |
Время начала сканирования группы ионов, мин |
Детектируемые массы, m/e, а.е.м. |
|
1 |
9, 0 |
304, 306, 308, 316, 318, 320, 322, 324, 334, 336 |
|
2 |
15, 5 |
338, 340, 342, 352, 354, 356, 358, 366, 368 |
|
3 |
19, 0 |
353, 355, 357, 367, 369, 372, 374, 376, 386, 388 |
|
4 |
23, 0 |
387, 389, 391, 401, 403, 406, 408, 410, 420, 422 |
|
5 |
28, 0 |
423, 425, 427, 435, 437, 442, 444, 446 |
Длительность сегментов корректируют при анализе калибровочной смеси.
7.3.1.2 Проведение градуировки
Градуировка заключается в определении времен удерживания и факторов отклика анализируемых конгенеров ПХДД/ДФ. Градуировка выполняется путем анализа калибровочных смесей С1 - С5.
Для оценки фона (чистоты аналитической системы) перед началом работы инжектируют в прибор 1 мкл чистого растворителя и записывают масс-хроматограмму. Наличие в фоне прибора ионов, мешающих анализу, проверяется путем построения реконструированных хроматограмм по всем характеристическим ионам, приведенным в таблице 9. При нормально работающем приборе на реконструированных хроматограммах не должно присутствовать пиков.
Каждый приготовленный градуировочный раствор С1 - С5 анализируют в условиях, приведенных в 7.3.1.1. Записывают масс-хроматограмму каждого раствора и с помощью программы обработки на реконструированных масс-хроматограммах, по сигналам характеристических ионов и соответствующих суррогатных стандартов определяют времена удерживания и площади пиков, соответствующие каждому анализируемому конгенеру.
Для каждого градуировочного раствора определяют относительный фактор отклика (RRF)n каждого индивидуального конгенера ПХДД/ДФ относительно соответствующего изотопно-меченого конгенера суррогатного стандарта, который рассчитывают по формуле
(RRF)n=(Sns)mis/(Sis)mns,
(1)
где Sns - площадь пика конгенера ПХДД/ДФ в калибровочном растворе;
mis - масса соответствующего изотопно-меченого конгенера суррогатного стандарта в калибровочном растворе, нг;
Sis - площадь пика соответствующего изотопно-меченого конгенера суррогатного стандарта в калибровочном растворе;
mns - масса конгенера ПХДД/ДФ в калибровочном растворе, нг.
При наличии линейности детектирования вариация значения относительного фактора отклика (RRF) не должна превышать ±20% для всех калибровочных растворов.
Проводят измерения для каждого раствора и рассчитывают относительные факторы отклика для каждого индивидуального конгенера ПХДД/ДФ для трех параллельных измерений.
Вариация значений относительных факторов отклика (RRF), рассчитанных для трех параллельных измерений, не должна превышать ±10%.
Перед началом анализа каждой новой партии проб проводят проверку линейного диапазона и постоянства факторов отклика путем хроматографирования не менее трех градуировочных растворов смеси ПХДД/ДФ, приготовленных в соответствии с 6.3.1. При отсутствии постоянства линейности (RRF)i выясняются и устраняются причины нестабильной работы прибора. Заменяя неполярную хроматографическую колонку на полярную, например DB-5MS на DB-Dioxin, определяют времена удерживания конгенеров на этом типе колонки. Примерные относительные значения времени удерживания для полярной и малополярной колонок приведены в таблице 11.
Таблица 11
|
Соединение |
Неподвижная фаза | |
|
DB-5MS |
DB-Dioxin | |
|
1, 2, 3, 4-ТХДЦ |
0, 99 |
1, 02 |
|
2, 3, 7, 8-ТХДД |
1, 00 |
1, 00 |
|
1, 2, 3, 7, 8-ПеХДД |
1, 23 |
1, 40 |
|
1, 2, 3, 4, 7, 8-ГхХДД |
1, 46 |
2, 08 |
|
1, 2, 3, 6, 7, 8-ГхХДД |
1, 47 |
1, 94 |
|
1, 2, 3, 7, 8, 9-ГхХДД |
1, 50 |
2, 15 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДД |
1, 76 |
2, 98 |
|
ОХДД |
2, 17 |
4, 50 |
|
2, 3, 7, 8-ТХДФ |
0, 96 |
0, 96 |
|
1, 2, 3, 7, 8-ПеХДФ |
1, 18 |
1, 31 |
|
2, 3, 4, 7, 8-ПеХДФ |
1, 22 |
1, 35 |
|
1, 2, 3, 4, 7, 8-ГкХДФ |
1, 39 |
2, 01 |
|
1, 2, 3, 6, 7, 8-ГхХДФ |
1, 39 |
2, 03 |
|
2, 3, 4, 6, 7, 8-ГхХДФ |
1, 43 |
2, 07 |
|
1, 2, 3, 7, 8, 9-ГхХДФ |
1, 48 |
2, 09 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДФ |
1, 61 |
2, 83 |
|
1, 2, 3, 4, 7, 8, 9-ГпХДФ |
1, 74 |
2, 96 |
|
ОХДФ |
2, 12 |
4, 45 |
7.3.1.3 Хромато-масс-спектральный анализ полученных экстрактов
Отбирают микрошприцем 1 мкл анализируемого экстракта, подготовленного как описано в 7.2, и вводят его в инжектор газового хроматографа. Записывают масс-хроматограммы, идентифицируют индивидуальные конгенеры ПХДД/ДФ и изотопно-меченые конгенеры суррогатного стандарта по масс-спектру и совпадению времен удерживания.
Наличие в пробе или контрольном образце индивидуального конгенера ПХДД/ДФ считают установленным при соблюдении следующих условий:
а) на всех реконструированных масс-хроматограммах, построенных по массам характеристических ионов для данного конгенера, присутствуют пики, имеющие соотношение интенсивности сигнал/шум больше или равное трем, при этом времена удерживания, определяемые по разным характеристическим пикам данного конгенера, совпадают (пики синхронны);
б) хроматографическое время удерживания конгенера, определяемое по положению максимума пика характеристического иона, не отличается более чем на ±1 с от времени удерживания, определенного для данного конгенера при анализе градуировочного раствора;
в) соотношение интенсивностей характеристических ионов на вершине пиков не отличается более чем на 15% от значений, приведенных в таблице 9.
При наличии плохо разделенных хроматографических пиков конгенеров ПХДД/ДФ меняют малополярную колонку на полярную. Приемлемым хроматографическим разделением считается выполнение условий для не полностью разделенных пиков:
2h/(H1+H2)<0, 7,
где h - высота долины между ними;
H1 и H2 - высоты неразрешенных пиков.
7.3.2 Хромато-масс-спектрометрия высокого или низкого разрешения с ионизацией пробы электронным ударом
Хромато-масс-спектрометрия высокого разрешения (R ≥ 10000) обладает чрезвычайно высокой специфичностью выделения характеристических ионов аналитов, масса которых определяется с точностью до 0, 001 а.е.м. Ионы, имеющие массу, отличную от заданной, не детектируются прибором, что резко снижает мешающее влияние посторонних веществ, присутствующих в пробе. При анализе ПХДД/ДФ методом хромато-масс-спектрометрии высокого разрешения для надежной идентификации аналитов достаточно фиксировать наличие двух характеристических ионов конгенера, масса которых определяется с точностью 0, 001 а.е.м.
7.3.2.1 Подготовка хромато-масс-спектрометра
Хромато-масс-спектрометр типа DFS, JMS-700, MAT-95XP или аналогичный готовят для анализа в режиме ионизации пробы электронным ударом в соответствии с инструкцией по эксплуатации. Устанавливают энергию ионизации 70 эВ. Проверяют масс-спектрометрическое разрешение и соответствие паспортной чувствительности прибора.
Устанавливают программу анализа для хроматографического разделения конгенеров ПХДД/ДФ с использованием малополярной колонки типа DB-5MS. Примерный вид программы приведен в 7.3.1.1.
Масс-спектрометрический анализ проводят в режиме селективного сканирования характеристических ионов аналитов. При ионизации ХДД/ДФ электронным ударом максимальную интенсивность в спектре показывают ионы молекулярного кластера. Значения масс характеристических ионов, используемых в анализе, приведены в таблице 12.
Таблица 12 - Значения масс характеристических ионов
|
Конгенеры ПХДЦ/ДФ и соответствующие изотопно-меченые конгенеры |
Характеристические ионы, m/е, а.е.м. |
Соотношение интенсивностей сигнала ионов | |
|
M1 |
М2 | ||
|
ТХДД |
319, 897 (M+) |
321, 894 (M+2)+ |
0, 77 |
|
[13C12]-2, 3, 7, 8-ТХДД |
331, 937 (M+) |
333, 934 (M+2)+ |
0, 77 |
|
[13C12]-1, 2, 3, 4-ТХДД |
331, 931 (M+) |
333, 934 (M+2)+ |
0, 77 |
|
ПеХДД |
355, 855 (M+2)+ |
357, 852 (M+4)+ |
1, 55 |
|
[13C12]-1, 2, 3, 7, 8-ПеХДД |
367, 895 (M+2)+ |
396, 892 (M+2)+ |
1, 55 |
|
ГхХДД |
389, 816 (M+2)+ |
391, 813 (M+4)+ |
1, 24 |
|
[13C12]-1, 2, 3, 6, 7, 8-ГхХДД |
401, 856 (M+2)+ |
403, 853 (M+4)+ |
1, 24 |
|
[13C12]-1, 2, 3, 7, 8, 9-ГхХДД |
401, 856 (M+2)+ |
403, 853 (M+4)+ |
1, 24 |
|
ГпХДД |
423, 777 (M+2)+ |
425, 774 (M+4)+ |
1, 05 |
|
[13C12]-1, 2, 3, 4, 6, 7, 8-ГпХДД |
435, 817 (M+2)+ |
437, 814 (M+4)+ |
1, 05 |
|
ОХДД |
457, 738 (M+2)+ |
459, 735 (M+4)+ |
0, 89 |
|
[13C12]-ОХДЦ |
469, 778 (M+2)+ |
471, 775 (M+4)+ |
0, 89 |
|
ТХДФ |
303, 902 (M+) |
305, 899 (M+2)+ |
0, 77 |
|
[13C12]-2, 3, 7, 8-ТХДФ |
315, 942 (M+) |
317, 939 (M+2)+ |
0, 77 |
|
ПХДФ |
339, 860 (M+2)+ |
341, 857 (M+4)+ |
1, 55 |
|
[13C12]-1, 2, 3, 7, 8-ПеХДФ |
351, 900 (M+2)+ |
353, 897 (M+4)+ |
1, 55 |
|
ГхДФ |
373, 821 (M+2)+ |
375, 818 (M+4)+ |
1, 24 |
|
[13C12]-1, 2, 3, 6, 7, 8-ГхХДФ |
383, 864 (M)+ |
385, 861 (M+2)+ |
0, 51 |
|
ГпХДФ |
407, 782 (M+2)+ |
409, 779 (M+4)+ |
1, 05 |
|
[13C12]-1, 2, 3, 4, 6, 7, 8-ГпХДФ |
417, 825 (M)+ |
419, 822 (M+2)+ |
0, 44 |
|
ОХДФ |
441, 743 (M+2)+ |
443, 740 (M+4)+ |
0, 89 |
При использовании масс-спектрометра низкого разрешения регистрируют ионы с соответствующими номинальными массами, например, вместо 319, 897 - 320 и т.д.
Для обеспечения большей достоверности результатов регистрируют по три иона в кластере для каждого соединения, например, (M)+, (M+2)+, (M+4)+.
7.3.2.2 Проведение градуировки
Градуировка прибора проводится по схеме, аналогичной приведенной в 7.3.1.2, и включает определение времен удерживания и относительных факторов отклика (RRF)n конгенеров ПХДД/ДФ.
7.3.2.3 Анализ экстрактов
Анализ экстрактов проводят согласно 7.3.1.3. Вычисляют отношение площадей хроматографических пиков на масс-хроматограммах ионов М1 и М2, регистрируемых для каждого определяемого соединения и внутреннего стандарта, и сравнивают его с теоретическим значением, приведенным в таблице 12, Это отношение должно быть в пределах ±15% от теоретического значения, например, для ТХДД - от 0, 65 до 0, 89 (теоретическое отношение равно 0, 77). Если хроматографические пики в указанной области времен удерживания имеются, но отношение площадей пиков выходит за эти пределы, то говорить о положительной идентификации по этим пикам ПХДД или ПХДФ в данной пробе нельзя, и требуется дополнительный анализ - на хроматографической колонке с другой неподвижной фазой или в режиме химической ионизации с детектированием отрицательно заряженных ионов. Если время удерживания данного компонента совпадает с временем удерживания соответствующего изотопномеченого внутреннего стандарта (отличается от него не более чем на 1 с или на 1 скан) или отличается от времени удерживания, измеренного для стандартного образца, не более чем на 0, 01% и отношение площадей пиков находится в указанных пределах, то этот конгенер ПХДД/ДФ в данной пробе считается идентифицированным.
7.4 Обработка результатов измерений
По окончании анализа с помощью системы обработки данных фиксируют на реконструированных масс-хроматограммах пики в области времен удерживания, соответствующих выходу 2, 3, 7, 8-замещенных ПХДД/ДФ и суррогатных стандартов.
Массовую концентрацию конгенеров ПХДД/ДФ в экстракте анализируемой пробы Ci, нг/кг, рассчитывают на основании полученных сигналов для каждого конкретного конгенера по формуле
C=(Sn)mi/(Si)(RRF)nM,
(2)
где Sn - площадь пика конгенера ПХДД/ДФ на реконструированной хроматограмме;
mi - количество введенного изотопно-меченого суррогатного стандарта, нг;
Si - площадь пика соответствующего конгенера изотопномеченого суррогатного стандарта ПХДД/ДФ;
(RRF)n - относительный фактор отклика для индивидуального конгенера ПХДД/ДФ, рассчитанный по формуле (1);
М - масса образца, взятого для анализа, кг.
Коэффициент извлечения конкретного конгенера изотопномеченого суррогатного стандарта (REC)s рассчитывают по формуле
(REC)S =(Ssur)mr/(Sr)ms(RRF)sr,
(3)
где Ssur - площадь пика конкретного конгенера изотопно-меченого суррогатного стандарта на реконструированной хроматограмме анализируемого образца;
mr - количество введенного в анализируемый образец изотопно-меченого внутреннего стандарта, нг;
Sr - площадь пика конкретного конгенера изотопно-меченого внутреннего стандарта на реконструированной хроматограмме анализируемого образца;
ms - количество введенного в анализируемый образец изотопно-меченого суррогатного стандарта, нг;
(RRF)sr - относительный фактор отклика для индивидуального конгенера изотопно-меченого суррогатного стандарта, рассчитываемый из градуировочного раствора по формуле
(RRF)sr=(Ssurs)mrs/(Srs)msurs,
(4)
где Ssurs - площадь пика индивидуального конгенера изотопно-меченого суррогатного стандарта на реконструированной хроматограмме градуировочного раствора;
mrs - массовая доля изотопно-меченого внутреннего стандарта в градуировочном растворе, нг;
Srs - площадь пика индивидуального конгенера изотопно-меченого внутреннего стандарта на реконструированной хроматограмме градуировочного раствора;
msurs - массовая доля изотопно-меченого суррогатного стандарта в градуировочном растворе, нг.
Определение площадей Sn, Si, Ssur, Sr, Ssurs, Srs проводят по масс-хроматограммам либо для одного из двух ионов, M1 или M2, указанных в таблице 12, либо для двух ионов с усреднением результатов, либо по сумме площадей соответствующих пиков на обеих масохроматограммах.
7.5 Характеристика погрешности измерений
Диапазон измеряемых концентраций конгенеров ПХДД/ДФ и показатели сходимости и воспроизводимости приведены в таблице 13.
Таблица 13
|
Диапазон измеряемых концентраций конгенеров ПХДД/ДФ, нг/кг |
Границы интервала, в котором погрешность находится с вероятностью Р = 0, 95, σ, ± % |
Относительное стандартное отклонение воспроизводимости σR, % |
|
От 0, 5 до 10 включ. |
48 |
61 |
|
Св. 10 до 200 включ. |
25 |
36 |
|
Св. 200 до 1000 включ. |
15 |
13 |
7.6 Оформление результатов измерений
Протокол испытаний должен содержать, как минимум, следующие сведения:
всю информацию, необходимую для исчерпывающей идентификации пробы;
метод испытания и определяемый элемент со ссылкой на настоящий стандарт;
результаты испытаний с указанием единиц измерений;
содержание липидов в образце по ГОСТ 7636;
дату отбора пробы и способ отбора (если он известен);
дату окончания проведения испытания;
информацию о выполнении требований к повторяемости результатов;
все детали проведения испытания, не оговоренные в настоящем стандарте или не считающиеся обязательными, а также все инциденты, наблюдавшиеся при проведении испытания, которые могли повлиять на конечный результат.
Результаты измерения массовой концентрации индивидуальных конгенеров ПХДД/ДФ представляют в форме
Ci±Δ нг/кг,
(5)
где Ci - концентрация конгенера ПХДД/ДФ в пробе, нг/кг;
Δ- граница интервала, в котором абсолютная погрешность измерений концентрации конгенера ПХДД/ДФ, нг/кг, находится с доверительной вероятностью Р = 0, 95.
Характеристику погрешности рассчитывают по формуле
Δ=0, 01δCi,
(6)
где δ - граница интервала, в котором относительная погрешность измерений концентрации конгенера ПХДД/ДФ, %, находится с доверительной вероятностью Р = 0, 95. Допускается результаты измерений в документах, выдаваемых лабораторией, представлять в виде
Ci±Δn нк/кг, при условии, что Δn<Δ,
(7)
где Δn - значение характеристики погрешности результатов измерений, установленное при реализации данной методики в лаборатории и обеспеченное контролем качества результатов. Рекомендуемая форма протокола представлена в приложении В.
7.7 Контроль качества измерений
Контроль качества измерений обеспечивают выполнением следующих условий:
- анализ проб проводят сериями. Каждая серия включает до 11 полевых образцов, один из которых анализируют дважды (дубликат), образец сертифицированного материала с заданным содержанием ПХДД/ДФ и процедурный холостой образец;
- оперативный контроль точности и правильности измерений обеспечивается анализом изотопно-меченых суррогатных стандартов - аналогов определяемых веществ, вводимых в каждый образец на стадии профподготовки.
Допускаемые критерии качества анализа:
- содержание индивидуальных конгенеров ПХДД/ДФ в процедурном холостом образце меньше 1 пг;
- определяемое содержание конгенеров ПХДД/ДФ в сертифицированном материале должно соответствовать сертификату анализа для 90% определяемых соединений;
- отклонение результатов при анализе дубликатов - не более ±25% от среднего значения плюс величина предела обнаружения метода для 90% определяемых соединений (оперативный контроль воспроизводимости);
- значения величины извлечения конгенеров (REC)s рассчитанные как указано в 7.4, находятся в диапазоне 50% - 110%;
- чувствительность прибора определяют один раз в день (или после настройки прибора) путем анализа стандартного градуировочного раствора ПХДД/ДФ;
- приемлемый критерий качества - соотношение сигнал - шум больше 10:1 при инжекции 1 пг 2, 3, 7, 8-ТХДД;
- хроматографическое разрешение подтверждают анализом градуировочного раствора, проводимым до и после анализа аналитической серии;
- приемлемое значение - разделение пиков 1, 2, 3, 4, 7, 8-ГхДФ и 1, 2, 3, 6, 7, 8-ГХДФ соответствует условию:
h/(H1+H2)<0, 7,
(8)
где h - высота долины между ними;
H1 и H2 - высоты пиков конгенеров;
- масс-спектральное разрешение, определенное при настройке прибора, составляет для низкого разрешения не ниже 0, 8 а.е.м, во всем диапазоне измеряемых масс для прибора высокого разрешения R ≥ 10000;
- линейность калибровки инструмента определяют по анализу пяти градуировочных растворов ПХДД/ДФ. Критерий качества - допустимое стандартное отклонение рассчитанного относительного фактора отклика (RRF)n должно быть меньше 20%;
- стабильность работы инструмента подтверждается до и после анализа серии образцов путем анализа градуировочного раствора ПХДД/ДФ С2. Критерий качества - различия значений величины относительного отклика (RRF)n, рассчитанные до и после анализа серии образцов, не должны превышать ±15%.
Проверку чистоты инструмента на содержание анализируемых компонентов проводят после каждого анализа градуировочного стандартного раствора путем инжекции декана. Приемлемый критерий - значение вносимой ошибки за счет фона инструмента не должно превышать 1% от среднего значения определяемых концентраций.
При невыполнении любого из перечисленных условий принимаются меры по выявлению причин и повторяется анализ партии проб.
8 Определение диоксинподобных (пленарных) полихлорированных бифенилов
8.1 Подготовка калибровочных растворов ПХБ и растворов изотопно-меченых суррогатных и внутренних стандартов
Градуировочные растворы смеси индивидуальных и изотопно-меченых ПХБ используют для проверки времен удерживания конгенеров, линейного диапазона детектирования и расчета фактора отклика анализируемых конгенеров.
В качестве базового раствора смеси индивидуальных конгенеров пленарных ПХБ используется смесь индивидуальных ПХБ в нонане EС-5000.
В качестве базового раствора суррогатного стандарта используется смесь изотопно-меченых по углероду 13C12 конгенеров ПХБ в нонане ЕС N 4995.
8.1.1 Приготовление градуировочных растворов
8.1.1.1 Раствор В1
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 4 см3 1910 мкл н-нонана, 10 мкл базового раствора ЕС-5000 и 80 мкл раствора ЕС N 4995.
8.1.1.2 Раствор B2
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 2 см3 940 мкл н-нонана, 20 мкл базового раствора ЕС-5000 и 40 мкл раствора ЕС N 4995.
8.1.1.3 Раствор В3
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 2 см3 920 мкл н-нонана, 40 мкл базового раствора ЕС-5000 и 40 мкл раствора ЕС N 4995.
8.1.1.4 Раствор В4
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 2 см3 860 мкл н-нонана, 100 мкл базового раствора ЕС-5000 и 40 мкл раствора ЕС N 4995.
8.1.1.5 Раствор В5
Используя регулируемые автоматические дозаторы на объемы 100 - 1000 мкл и 10 - 100 мкл, последовательно вносят в виалу вместимостью 2 см3 760 мкл н-нонана, 200 мкл базового раствора ЕС-5000 и 40 мкл раствора ЕС N 4995.
Концентрации калибровочных растворов (нг/см3) приведены в таблице 14.
Приготовленные калибровочные растворы могут храниться в герметически закрытых виалах при температуре не выше минус 10°С без доступа солнечного света не более 6 мес, в стеклянных запаянных ампулах не более двух лет.
Таблица 14 - Концентрации калибровочных растворов в
нанограммах/см3
|
Конгенер ПХДД/ДФ |
B1 |
B2 |
B3 |
B4 |
B5 |
|
ПХБ 77 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 81 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 105 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 114 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 118 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 123 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 126 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 156 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 157 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 167 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ169 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 170 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 180 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 189 |
10 |
40 |
80 |
200 |
400 |
|
ПХБ 77 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 81 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 105 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ114 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ118 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 123 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 126 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 156 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 157 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 167(13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 169 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 170 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 180 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
|
ПХБ 189 (13C12 99%) |
40 |
40 |
40 |
40 |
40 |
8.1.2 Приготовление рабочего раствора изотопно-меченого суррогатного стандарта ПХБ
Для приготовления рабочего раствора S/S в мерную колбу вместимостью 25 см3 вносят автоматическим регулируемым дозатором 1000 мкл раствора ЕС N 4995 и доводят объем раствора до метки н-нонаном. Обозначают полученный рабочий раствор как S/SПХБ. Концентрации суррогатных стандартов в рабочем растворе приведены в таблице 15.
Таблица 15 - Концентрации суррогатных стандартов в рабочем растворе в нанограммах/см3
|
Конгенер ПХДД/ДФ |
S/SПХБ базовый |
S/SПХБ |
|
ПХБ 77 (13C12 99%) |
1000 |
40 |
|
ПХБ 81 (13C12 99%) |
1000 |
40 |
|
ПХБ 105 (13C12 99%) |
1000 |
40 |
|
ПХБ 114 (13C12 99%) |
1000 |
40 |
|
ПХБ 118 (13C12 99%) |
1000 |
40 |
|
ПХБ 123 (13C12 99%) |
1000 |
40 |
|
ПХБ 126 (13C12 99%) |
1000 |
40 |
|
ПХБ 156 (13C12 99%) |
1000 |
40 |
|
ПХБ 157 (13C12 99%) |
1000 |
40 |
|
ПХБ 167 (13C12 99%) |
1000 |
40 |
|
ПХБ 169 (13C12 99%) |
1000 |
40 |
|
ПХБ 170 (13C12 99%) |
1000 |
40 |
|
ПХБ 180 (13C12 99%) |
1000 |
40 |
|
ПХБ 189 (13C12 99%) |
1000 |
40 |
Приготовленный раствор перемешивают на ультразвуковой бане 10 мин, расфасовывают в стеклянные ампулы по 1 см3. Ампулы запаивают и хранят до использования без доступа солнечного света не более двух лет.
8.1.3 Приготовление рабочего раствора внутреннего стандарта R/SПХБ
Для приготовления рабочего раствора внутреннего стандарта в мерную колбу вместимостью 50 см3 вносят автоматическим регулируемым дозатором 50 мкл раствора 2, 3, 4, 4', 5, 6-гексахлорбифенила (код по каталогу CIL РСВ N 166) с концентрацией (100±5) мкг/см3 и доводят объем раствора до метки н-нонаном. Обозначают полученный рабочий раствор внутреннего стандарта как R/SПХБ. Концентрация внутреннего стандарта в рабочем растворе составляет 100 нг/см3.
Приготовленный раствор перемешивают на ультразвуковой бане 10 мин, расфасовывают в стеклянные ампулы по 1 см3. Ампулы запаивают и хранят до использования без доступа солнечного света не более двух лет.
8.2 Подготовка проб для анализа
Подготовка проб для анализа пленарных ПХБ аналогична процедуре, описанной в 6.4. При этом размораживают, а затем гомогенизируют на шнековой мясорубке образец массой не менее 100 г.
8.3 Экстракция пленарных ПХБ
Для анализа рыбы и тканей с низким содержанием липидов используют навеску 7 - 8 г, при анализе печени, гонад, мышц с высоким содержанием липидов 3 - 5 г. Извлечение ПХБ из образца проводится методом колоночной экстракции, описанным в 7.1, а в качестве изотопно-меченого суррогатного стандарта используют раствор стандарта S/SПХБ (см. 8.1.2).
Пробу рыбьего жира массой 1 г растворяют в 20 см3 смеси гексан-дихлорметан (1:1) и очищают методом колоночной хроматографии.
8.4 Очистка экстракта методом колоночной хроматографии
Очистку экстракта проводят методом колоночной хроматографии, описанным в 7.2. При концентрировании экстракта для инструментального анализа, когда объем растворителя во флаконе достигнет примерно 100 мкл, автоматическим дозатором добавляют 20 мкл раствора внутреннего стандарта в нонане R/SПХБ (см. 8.1.3) и продолжают отдув до объема добавленного нонана. Герметизируют флакон тефлонированной прокладкой и передают для инструментального анализа.
8.5 Выполнение измерений
8.5.1 Подготовка хромато-масс-спектрометра
Хромато-масс-спектрометр низкого разрешения типов Varian-320MS, Agilent-5975, ITMS-240MS, ITQ-900GC/MS или аналогичный готовят для анализа в режиме ионизации пробы электронным ударом с селективным детектированием характеристических ионов в соответствии с инструкцией по эксплуатации. Проверяют настройку и соответствие паспортной чувствительности прибора.
Устанавливают программу анализа для хроматографического разделения конгенеров пленарных ПХБ с использованием малополярной колонки типа DB-5MS.
Примерный вид программы приведен ниже:
а) хроматографическая программа:
режим инжектора ........................ splitless;
задержка продувки инжектора ............ 1 мин;
время сброса растворителя .............. 10 мин;
тип колонки ............................ DB-5MS;
длина колонки .......................... 30 м;
диаметр колонки ........................ 0, 25 мм;
толщина пленки фазы .................... 0, 25 мкм;
программирование температуры:
начальная температура колонки .......... 80°С;
начальное время задержки ............... 1 мин;
скорость нагрева колонки ............... 20°С/мин до 180°С, 4°С/мин
............................................ до 280°С;
температура инжектора .................. 290°С;
скорость потока гелия через колонку .... 1 см3/мин;
б) режим масс-спектрометра:
температура интерфейса ................. 290°С;
температура ионного источника .......... 200°С;
селективное сканирование ...............массы ионов (см. таблицу 16);
инжектируемый объем .................... 1 мкл.
Масс-спектрометрический анализ проводится в режиме селективного сканирования характеристических ионов аналитов. При ионизации ПХБ методом электронного удара максимальную интенсивность в спектре показывают ионы молекулярного кластера и ионы, образованные выбросом атома хлора из молекулярного иона. Значения масс характеристических ионов, используемых в анализе, приведены в таблице 16.
Таблица 16
|
Анализируемая группа конгенеров ПХБ |
Тип иона |
Характеристические ионы, m/e, а.е.м. |
Соотношение интенсивностей сигнала ионов |
|
ПХБ 77 |
M+, (M+2)+, (M+4)+ |
290; 292; 294 |
0, 77:1:0, 5 |
|
ПХБ 77 (13C12 99%) |
M+, (M+2)+ |
302; 304 |
0, 77:0, 5 |
|
ПХБ 81 |
M+, (M+2)+, (M+4)+ |
290; 292; 294 |
0, 77:1:0, 5 |
|
ПХБ 81 (13C12 99%) |
M+, (M+2)+ |
302; 304 |
0, 77:0, 5 |
|
ПХБ 105 |
M+, (M+2)+, (M+4)+ |
324; 326; 328 |
0, 6:1:0, 65 |
|
ПХБ 105 (13C12 99%) |
M+, (M+2)+ |
336; 338 |
0, 6:1 |
|
ПХБ 114 |
M+, (M+2)+ (M+4)+ |
324; 326; 328 |
0, 6:1:0, 65 |
|
ПХБ 114 (13C12 99%) |
M+, (M+2)+ |
336; 338 |
0, 6:1 |
|
ПХБ 118 |
M+, (M+2)+, (M+4)+ |
324; 326; 328 |
0, 6:1:0, 65 |
|
ПХБ 118 (13C12 99%) |
M+, (M+2)+ |
336; 338 |
0, 6:1 |
|
ПХБ 123 |
M+, (M+2)+, (M+4)+ |
324; 326; 328 |
0, 6:1:0, 65 |
|
ПХБ 123 (13C12 99%) |
M+, (M+2)+ |
336; 338 |
0, 6:1 |
|
ПХБ 126 |
M+, (M+2)+, (M+4)+ |
324; 326; 328 |
0, 6:1:0, 65 |
|
ПХБ 126 (13C12 99%) |
M+, (M+2)+ |
336; 338 |
0, 6:1 |
|
ПХБ 156 |
M+, (M+2)+, (M+4)+ |
358; 360; 362 |
0, 5 1:0, 85 |
|
ПХБ 156 (13C12 99%) |
(M+2)+, (M+4)+ |
372; 374 |
10, 85 |
|
ПХБ 157 |
M+, (M+2)+, (M+4)+ |
358; 360; 362 |
0, 5 1:0, 85 |
|
ПХБ 157 (13C12 99%) |
(M+2)+, (M+4)+ |
372; 374 |
10, 85 |
|
ПХБ 167 |
M+, (M+2)+, (M+4)+ |
358; 360; 362 |
0, 51:0, 85 |
|
ПХБ 167 (13C12 99%) |
(M+2)+, (M+4)+ |
372; 374 |
10, 85 |
|
ПХБ 169 |
M+, (M+2)+, (M+4)+ |
358; 360; 362 |
0, 51:0, 85 |
|
ПХБ 169 (13C12 99%) |
(M+2)+, (M+4)+ |
372; 374 |
10, 85 |
|
ПХБ 170 |
M+, (M+2)+, (M+4)+ |
394; 396; 398 |
0, 44:1:0, 97 |
|
ПХБ 170 (13C12 99%) |
(M+2)+, (M+4)+ |
408; 410 |
1:0, 97 |
|
ПХБ 180 |
M+, (M+2)+, (M+4)+ |
394; 396; 398 |
0, 44:1:0, 97 |
|
ПХБ 180 (13C12 99%) |
(M+2)+, (M+4)+ |
408; 410 |
1:0, 97 |
|
ПХБ 189 |
M+, (M+2)+, (M+4)+ |
408; 410 |
0, 44:1:0, 97 |
|
ПХБ 189 (13C12 99%) |
(M+2)+, (M+4)+ |
408; 410 |
1:0, 97 |
|
ПХБ 166 RIS |
M+, (M+2)+, (M+4)+ |
358; 360; 362 |
0, 5:1:0, 85 |
Для повышения чувствительности анализа режим масс-спектральной съемки разбит на три сегмента, в течение которых прибор фиксирует те или иные группы ионов. Примерная длительность сегментов и детектируемые ионы приведены в таблице 17.
Таблица 17
|
Сегмент |
Время начала сканирования группы ионов, мин |
Детектируемые массы, m/e, а.е.м. |
|
1 |
16 - 18, 4 |
290; 292; 294; 302; 304 |
|
2 |
18, 4 - 21, 5 |
324; 326; 328; 336; 338; 358; 360; 362 |
|
3 |
21, 5 - 27, 5 |
358; 360; 362; 372; 374; 394; 396; 398; 408; 410 |
Длительность сегментов корректируется при анализе калибровочной смеси.
8.5.2 Проведение градуировки
Градуировка заключается в определении времен удерживания и факторов отклика анализируемых конгенеров ПХБ. Градуировка выполняется путем анализа калибровочных смесей B1 - B5.
Для оценки фона (чистоты аналитической системы) перед началом работы инжектируют в прибор 1 мкл чистого нонана и записывают масохроматограмму. Наличие в фоне прибора ионов, мешающих анализу, проверяется путем построения реконструированных хроматограмм по всем характеристическим ионам, приведенным в таблице 16. При нормально работающем приборе на реконструированных хроматограммах должны отсутствовать пики аналитов. Допустимо, если на реконструированных хроматограммах, построенных для иона m/e = 326 а.е.м. в диапазоне времен удерживания ПХБ 118 и ПХБ 105, имеются пики, соотношение сигнал - шум которых не менее 3:1. Если это условие не выполняется, определяют и устраняют причину фоновых сигналов.
Приготовленные градуировочные растворы B1 - B5 анализируют в условиях, приведенных в 8.5.1 в последовательности B1, B2, B3, B4, B5. Записывают масс-хроматограмму каждого раствора и с помощью программы компьютерной обработки данных определяют на масс-хроматограммах, реконструированных по сигналам характеристических ионов и соответствующих суррогатных стандартов, времена удерживания и площади пиков, соответствующие каждому анализируемому конгенеру.
Для вычисления площади пиков аналитов используют сигнал иона максимальной интенсивности в кластере или сумму сигналов двух ионов, одинаковых для нативного ПХБ и соответствующего суррогатного стандарта, например, для ПХБ 118 суммируют площади пиков ионов m/e = 324 + 326 и для соответствующего суррогатного стандарта m/e = 336 + 338 а.е.м.
Для каждого градуировочного раствора определяют относительный фактор отклика RRFn каждого индивидуального конгенера ПХБ относительно соответствующего изотопно-меченого конгенера суррогатного стандарта, который рассчитывают по формуле
(RRF)n=(Sns)mis/(Sis)mns,
(9)
где Sns - площадь пика конгенера ПХБ в калибровочном растворе;
mis - масса соответствующего изотопно-меченого конгенера суррогатного стандарта в калибровочном растворе, нг;
Sis - площадь пика соответствующего изотопно-меченого конгенера суррогатного стандарта в калибровочном растворе;
mns - масса конгенера ПХБ в калибровочном растворе, нг.
При наличии линейности детектирования различие величины относительного фактора отклика (RRF) не должно превышать ±20% для всех калибровочных растворов.
Проводят три параллельных измерения для каждого раствора и рассчитывают относительные факторы отклика для каждого индивидуального конгенера ПХБ для трех измерений.
Различие значений относительных факторов отклика (RRF), рассчитанных для трех параллельных измерений, не должно превышать ±10%.
Перед началом анализа каждой новой партии проб проводят проверку линейного диапазона и постоянства факторов отклика путем хроматографирования не менее трех рабочих растворов смеси ПХБ, приготовленных в соответствии с 8.1.1. При отсутствии постоянства (RRF)i, т.е. линейности, выясняют и устраняют причины нестабильной работы прибора.
Примерные относительные времена удерживания малополярной колонки DB-5MS приведены в таблице 18.
Таблица 18
|
Соединение |
Неподвижная фаза DB-5MS |
|
ПХБ 77 |
0, 84 |
|
ПХБ 81 |
0, 82 |
|
ПХБ 105 |
0, 93 |
|
ПХБ 114 |
0, 9 |
|
ПХБ 118 |
0, 88 |
|
ПХБ 123 |
0, 87 |
|
ПХБ 126 |
0, 99 |
|
ПХБ 156 |
1, 07 |
|
ПХБ 157 |
1, 08 |
|
ПХБ 167 |
1, 03 |
|
ПХБ 169 |
1, 15 |
|
ПХБ 170 |
1, 16 |
|
ПХБ 180 |
1, 10 |
|
ПХБ 189 |
1, 22 |
|
ПХБ 166 RIS |
1, 00 |
8.5.3 Хромато-масс-спектральный анализ полученных экстрактов
Отбирают микрошприцем 1 мкл анализируемого экстракта, подготовленного, как описано в 8.4, и вводят в инжектор газового хроматографа. Записывают масс-хроматограммы и идентифицируют индивидуальные конгенеры ПХБ и изотопно-меченые конгенеры суррогатного стандарта по масс-спектру и совпадению значений времени удерживания.
Наличие в пробе или контрольном образце индивидуального конгенера ПХБ считают установленным, если на всех реконструированных масс-хроматограммах, построенных по массам характеристических ионов для данного конгенера, присутствуют синхронные пики, имеющие отношение сигнал/шум больше или равное трем, время удерживания не отличается на ±2 с от определенного для данного конгенера или соответствующего изотопно-меченого аналога при анализе градуировочного раствора и соотношение интенсивностей характеристических ионов на вершине пиков не отличается более чем на 20% от теоретического (см. таблицу 16).
8.6 Обработка результатов измерений
По окончании анализа с помощью системы обработки данных фиксируют на реконструированных масс-хроматограммах пики в области времен удерживания, соответствующих выходу пленарных ПХБ, суррогатных и внутреннего стандартов.
Массовую концентрацию конгенеров ПХБ в экстракте анализируемой пробы Ci, нг/кг, рассчитывают на основании полученных сигналов для каждого конкретного конгенера по формуле
C=(Sn)mi/(Si)(RRF)nM,
(10)
где Sn - площадь пика конгенера ПХБ на реконструированной хроматограмме;
mi - количество введенного изотопно-меченого суррогатного стандарта, нг;
Si - площадь пика соответствующего конгенера изотопно-меченого суррогатного стандарта ПХБ;
(RRF)n - относительный фактор отклика для индивидуального конгенера ПХБ, рассчитанный по
формуле (9);
М - масса образца, взятого для анализа, кг.
Коэффициент извлечения конкретного конгенера изотопно-меченого суррогатного стандарта (REC)S определяется по формуле
(REC)S =(Ssur)mr/(SR)ms(RRF)sr,
(11)
где Ssur - площадь пика конкретного конгенера изотопно-меченого суррогатного стандарта на реконструированной хроматограмме анализируемого образца;
mr - количество введенного в анализируемый образец внутреннего стандарта, нг;
SR - площадь пика внутреннего стандарта на реконструированной хроматограмме анализируемого образца;
ms - количество введенного в анализируемый образец изотопно-меченого суррогатного стандарта, нг;
(RRF)sr - относительный фактор отклика для индивидуального конгенера изотопно-меченого суррогатного стандарта определяется из градуировочного раствора по формуле
RRFsr=(Ssurs)mrs/(Srs)msurs,
(12)
где Ssurs - площадь пика индивидуального конгенера изотопно-меченого суррогатного стандарта на реконструированной хроматограмме градуировочного раствора;
Srs - площадь пика внутреннего стандарта на реконструированной хроматограмме градуировочного раствора;
mrs - массовая доля внутреннего стандарта в градуировочном растворе, нг;
msurs - массовая доля изотопно-меченого суррогатного стандарта в градуировочном растворе, нг.
Определение площадей пиков проводят по реконструированным масс-хроматограммам либо для одного из двух ионов М1 или М2, указанных в таблице 16, либо для двух ионов с усреднением результатов, либо по сумме площадей соответствующих пиков на обеих масс-хроматограммах.
8.7 Характеристики погрешности измерений
Характеристики погрешности измерений для различных концентраций конгенеров ПХБ приведены в таблице 19.
Таблица 19
|
Диапазон измеряемых концентраций конгенеров ПХБ, нг/кг |
Границы интервала, в котором погрешность находится с вероятностью Р = 0, 95, σ, ± % |
Относительное стандартное отклонение воспроизводимости σR, % |
|
От 0, 5 до 50 включ. |
22 |
31 |
|
Св. 50 до 500 включ. |
13 |
26 |
8.8 Оформление результатов измерений
Протокол испытаний должен содержать, как минимум, следующие сведения:
- всю информацию, необходимую для исчерпывающей идентификации пробы;
- метод испытания и определяемый элемент со ссылкой на настоящий стандарт;
- результаты испытаний с указанием единиц измерений;
- содержание липидов в образце по ГОСТ 7636;
- дату отбора пробы и способ отбора (если он известен);
- дату окончания проведения испытания;
- информацию о выполнении требований к повторяемости результатов;
- все детали проведения испытания, не оговоренные в настоящем стандарте или не считающиеся обязательными, а также все инциденты, наблюдавшиеся при проведении испытания, которые могли повлиять на конечный результат.
Результаты измерения массовой концентрации индивидуальных конгенеров пленарных ПХБ Ci представляют в форме:
Ci±Δ нг/кг,
(13)
где Ci - концентрация конгенера ПХБ в пробе, нг/кг;
Δ- граница интервала, в котором абсолютная погрешность измерений концентрации конгенера ПХБ, нг/кг, находится с доверительной вероятностью Р = 0, 95. Характеристику погрешности вычисляют по формуле
Δ=0, 01δCi,
(14)
где δ - граница интервала, в котором относительная погрешность измерений концентрации конгенера ПХБ, %, находится с доверительной вероятностью Р = 0, 95.
Допускается результаты измерений в документах, выдаваемых лабораторией, представлять в виде
Ci±Δn нг/кг, при условии, что Δn<Δ,
(15)
где Δn - значение характеристики погрешности результатов измерений, установленное при реализации данной методики в лаборатории и обеспеченное контролем качества результатов.
Рекомендуемая форма протокола представлена в приложении Г.
8.9 Контроль качества измерений
Контроль качества измерений обеспечивают выполнением следующих условий:
- анализ проб проводят сериями. Каждая серия включает до 11 полевых образцов, один из которых анализируют дважды (дубликат), образец сертифицированного материала с заданным содержанием ПХБ и процедурный холостой образец;
- оперативный контроль точности и правильности измерений обеспечивается анализом изотопно-меченых суррогатных стандартов - аналогов определяемых веществ, вводимых в каждый образец на стадии пробоподготовки.
Допускаемые критерии качества анализа:
- содержание индивидуальных конгенеров ПХБ в процедурном холостом образце меньше 10 нг;
- определяемое содержание конгенеров ПХБ в сертифицированном материале должно соответствовать сертификату анализа для 90% определяемых соединений;
- отклонение результатов при анализе дубликатов - не более ±25% от среднего значения плюс величина предела обнаружения метода для 90% определяемых соединений (оперативный контроль воспроизводимости);
- значения величины извлечения конгенеров RECs, рассчитанные, как указано в 8.6, находятся в диапазоне 50% - 110%;
- чувствительность прибора определяют один раз в день (или после настройки прибора) путем анализа стандартного градуировочного раствора В1 ПХБ. Приемлемый критерий качества - соотношение сигнал - шум больше (10:1) для ПХБ 180;
- хроматографическое разрешение подтверждают анализом градуировочного раствора, проводимым до и после анализа аналитической серии. Приемлемое значение - разделение пиков ПХБ 123 и ПХБ 118 соответствует условию:
2h/(H1+H2)<0, 9,
(16)
где h - высота долины между пиками конгенеров;
H1 и H2 - высоты пиков;
- масс-спектральное разрешение, определенное при настройке прибора, составляет для низкого разрешения не ниже 0, 8 а.е.м во всем диапазоне масс проводимых измерений;
- линейность калибровки инструмента определяют по анализу пяти градуировочных растворов ПХБ. Критерий качества - допустимое стандартное отклонение рассчитанного относительного фактора отклика (RRF)n должно быть меньше 20%;
- стабильность работы инструмента подтверждается до и после анализа серии образцов путем анализа градуировочного раствора ПХБ В2. Критерий качества - различия значений величины относительного отклика (RRF)n, рассчитанные до и после анализа серии образцов, не должны превышать ±15%;
- проверку чистоты инструмента на содержание анализируемых компонентов проводят после каждого анализа градуировочного стандартного раствора путем инжекции декана. Приемлемый критерий - значение вносимой ошибки за счет фона инструмента не должно превышать 1% от среднего значения определяемых концентраций.
При невыполнении любого из перечисленных условий принимаются меры по выявлению причин и повторяется анализ партии проб.
_____________________________
* На территории Российской Федерации действует ГОСТ Р 53228-2008 "Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания".
Приложение А
(справочное)
Диоксиновый эквивалент токсичности (TEQ) конгенеров ПХДД/ДФ и диоксинподобных ПХБ
А.1 Диоксиновый эквивалент токсичности (TEQ) конгенеров ПХДД/ДФ и диоксиноподобных ПХБ - значение, выраженное в относительных величинах токсичности, установленных Всемирной организацией здравоохранения, приведен в таблице А.1.
Таблица А.1
|
Конгенер |
TEQ |
Конгенер |
TEQ |
|
Дибензо-n-диоксины (ПХДД): |
Диоксинподобные ПХБ: | ||
|
2, 3, 7, 8-ТХДД |
1 |
Не-орто ПХБ: | |
|
1, 2, 3, 7, 8-ПеХДД |
1 |
ПХБ 77 |
0, 0001 |
|
1, 2, 3, 4, 7, 8-ГеХДД |
0, 1 |
ПХБ 81 |
0, 0001 |
|
1, 2, 3, 6, 7, 8-ГеХДД |
0, 1 |
ПХБ 126 |
0, 1 |
|
1, 2, 3, 7, 8, 9-ГеХДД |
0, 1 |
ПХБ 169 |
0, 01 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДД |
0, 01 |
- |
- |
|
ОХДД |
0, 0001 |
- |
- |
|
Дибензофураны (ПХДФ): | |||
|
2, 3, 7, 8-ТХДФ |
0, 1 |
Моно-орто ПХБ: | |
|
1, 2, 3, 7, 8-ПеХДФ |
0, 05 |
ПХБ 105 |
0, 0001 |
|
2, 3, 4, 7, 8-ПеХДФ |
0, 5 |
ПХБ 114 |
0, 0005 |
|
1, 2, 3, 4, 7, 8-ГеХДФ |
0, 1 |
ПХБ 118 |
0, 0001 |
|
1, 2, 3, 6, 7, 8-ГеХДФ |
0, 1 |
ПХБ 123 |
0, 0001 |
|
1, 2, 3, 7, 8, 9-ГеХДФ |
0, 1 |
ПХБ 156 |
0, 0005 |
|
2, 3, 4, 6, 7, 8-ГеХДФ |
0, 1 |
ПХБ 157 |
0, 0005 |
|
1, 2, 3, 4, 6, 7, 8-ГпХДФ |
0, 01 |
ПХБ 167 |
0, 00001 |
|
1, 2, 3, 4, 7, 8, 9-ГпХДФ |
0, 01 |
ПХБ 189 |
0, 0001 |
|
ОХДФ |
0, 0001 |
- |
- |
Приложение Б
(справочное)
Колонки для анализа
Б.1 Колонки для анализа приведены на рисунках Б.1 - Б.4
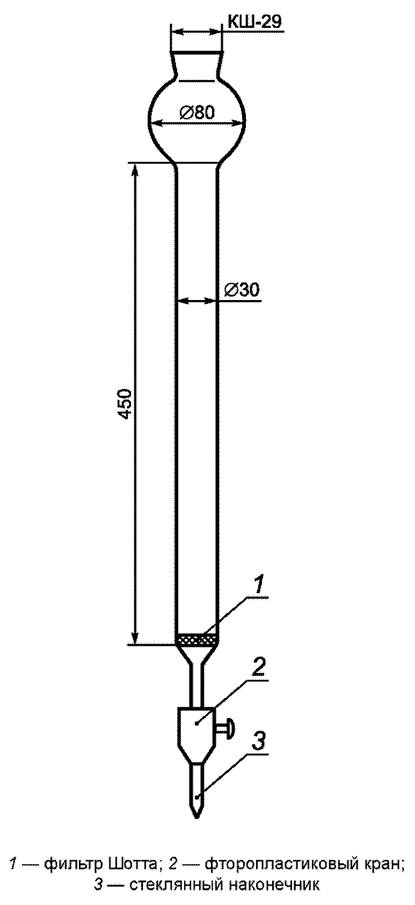 | 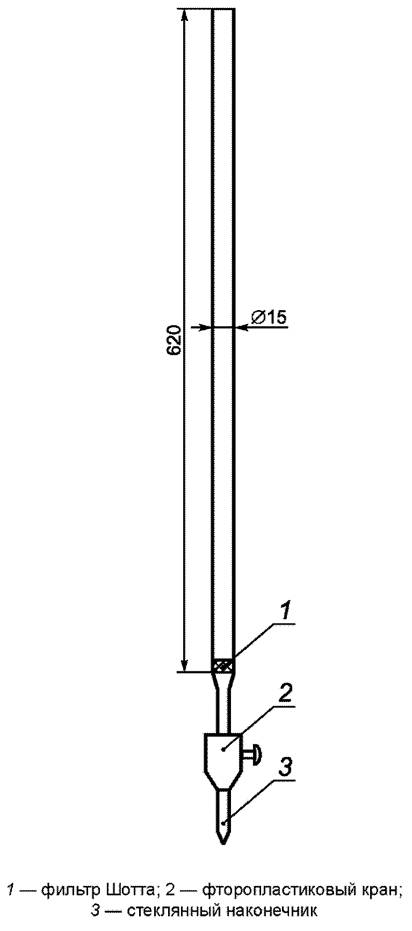 |
|
Рисунок Б.1 - Колонка для экстракции |
Рисунок Б.2 - Колонка Bio-Beads SE-X3 |
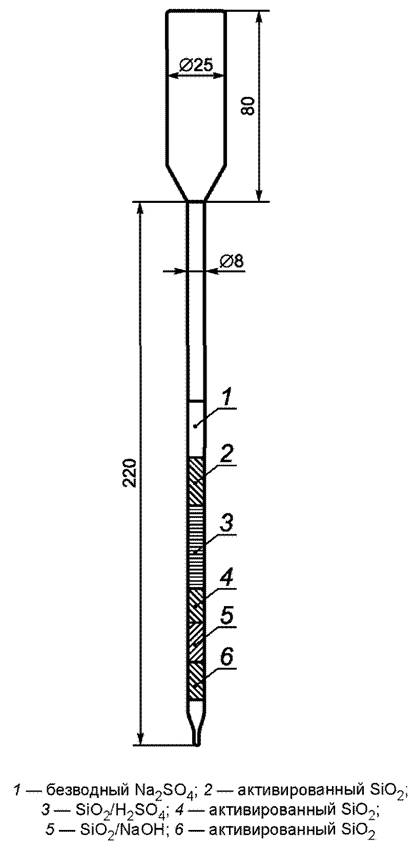 |  |
|
Рисунок Б.3 - Колонка для мультислойного сорбента |
Рисунок Б.4 - Колонка для навески A1₂O3 массой 5 г |
Приложение В
(справочное)
Форма представления результатов анализа на содержание ПХДД/ПХДФ
ПРОТОКОЛ КОЛИЧЕСТВЕННОГО ХИМИЧЕСКОГО АНАЛИЗА N
Заказчик
Описание пробы
Код образца заказчика
Дата получения проб
Дата анализа проб
Определяемые компоненты: полихлорированные дибензо-n-диоксины и дибензофураны (ПХДД/ПХДФ)
Метод анализа:
|
Код пробы |
Матрица | ||
|
Определяемый компонент |
Диоксиновый эквивалент, TEQ |
Результаты анализов | |
|
Концентрация, нг/кг |
Концентрация в TEQ, нг/кг | ||
|
2, 3, 7, 8-ТХДД |
1 | ||
|
1, 2, 3, 7, 8-ПеХДД |
1 | ||
|
1, 2, 3, 4, 7, 8-ГкХДД |
0, 1 | ||
|
1, 2, 3, 6, 7, 8-ГкХДД |
0, 1 | ||
|
1, 2, 3, 7, 8, 9-ГкХДД |
0, 1 | ||
|
1, 2, 3, 4, 6, 7, 8-ГпХДД |
0, 01 | ||
|
ОХДД |
0, 0001 | ||
|
2, 3, 7, 8-ТХДФ |
0, 1 | ||
|
1, 2, 3, 7, 8-ПеХДФ |
0, 5 | ||
|
2, 3, 4, 7, 8-ПеХДФ |
0, 5 | ||
|
1, 2, 3, 4, 7, 8-ГкХДФ |
0, 1 | ||
|
1, 2, 3, 6, 7, 8-ГкХДФ |
0, 1 | ||
|
2, 3, 4, 6, 7, 8-ГкХДФ |
0, 1 | ||
|
1, 2, 3, 7, 8, 9-ГкХДФ |
0, 1 | ||
|
1, 2, 3, 4, 6, 7, 8-ГпХДФ |
0, 01 | ||
|
1, 2, 3, 4, 7, 8, 9-ГпХДФ |
0, 01 | ||
|
ОХДФ |
0, 0001 | ||
|
Суммарная концентрация в TEQ, нг/кг | |||
|
Другие ТХДД |
- |
- | |
|
Другие ТХДФ |
- |
- | |
|
Другие ПеХДД |
- |
- | |
|
Другие ПеХДФ |
- |
- | |
|
Другие ГкХДД |
- |
- | |
|
Другие ГкХДФ |
- |
- | |
|
Другие ГпХДД |
- |
- | |
|
Другие ГпХДФ |
- |
- | |
|
(13C12) 2, 3, 7, 8-ТХДД | |||
|
(13C12) 2, 3, 7, 8-ТХДФ | |||
|
(13C12) 1, 2Д7, 8-ПеХДД | |||
|
(13C12) 1, 2, 3, 7, 8-ПеХДФ | |||
|
(13C12) 1, 2, 3, 6, 7, 8-ГкХДД | |||
|
(13C12) 1, 2, 3, 4, 7, 8-ГкХДФ | |||
|
(13C12) 1, 2, 3, 4, 6, 7, 8-ГпХДД | |||
|
(13C12) 1, 2, 3, 4, 6, 7, 8-ГпХДФ | |||
|
(13C12) ОХДД | |||
|
Содержание липидов в пробе, % | |||
Личная подпись ответственного исполнителя
Приложение Г
(справочное)
Форма представления результатов анализа на содержание планарных полихлорированных бифенилов
ПРОТОКОЛ КОЛИЧЕСТВЕННОГО ХИМИЧЕСКОГО АНАЛИЗА N
Заказчик
Описание пробы
Код образца заказчика
Дата получения проб
Дата анализа проб
Определяемые компоненты: полихлорированные планарные бифенилы
Метод анализа:
|
Код пробы |
Матрица | |||
|
Конгенер ПХБ |
TEQ |
Результаты анализов | ||
|
Концентрация, нг/кг |
Концентрация в TEQ, нг/кг | |||
|
ПХБ 81 |
0, 0001 | |||
|
ПХБ 77 |
0, 0001 | |||
|
ПХБ 123 |
0, 0001 | |||
|
ПХБ 118 |
0, 0001 | |||
|
ПХБ 114 |
0, 0005 | |||
|
ПХБ 105 |
0, 0001 | |||
|
ПХБ 126 |
0, 1 | |||
|
ПХБ 167 |
0, 00001 | |||
|
ПХБ 156 |
0, 0005 | |||
|
ПХБ 157 |
0, 0005 | |||
|
ПХБ 169 |
0, 01 | |||
|
ПХБ 180 |
- | |||
|
ПХБ 170 |
- | |||
|
ПХБ 189 |
0, 0001 | |||
|
Суммарная концентрация TEQ, нг/кг | ||||
|
Суррогатный стандарт |
Предел обнаружения, нг/кг |
Извлечение, % | ||
|
ПХБ 81 (13C12 99%) | ||||
|
ПХБ 77 (13C12 99%) | ||||
|
ПХБ 123 (13C12 99%) | ||||
|
ПХБ 118 (13C12 99%) | ||||
|
ПХБ 114 (13C12 99%) | ||||
|
ПХБ 105 (13C12 99%) | ||||
|
ПХБ 126 (13C12 99%) | ||||
|
ПХБ 167 (13C12 99%) | ||||
|
ПХБ 156 (13C12 99%) | ||||
|
ПХБ 157 (13C12 99%) | ||||
|
ПХБ 169 (13C12 99%) | ||||
Окончание таблицы
|
Суррогатный стандарт |
Предел обнаружения, нг/кг |
Извлечение, % |
|
ПХБ 180 (13C12 99%) | ||
|
ПХБ 170 (13C12 99%) | ||
|
ПХБ 189 (13C12 99%) | ||
|
Содержание липидов в пробе, % |
Личная подпись ответственного исполнителя
(Нет голосов) |
-
12.04.2024
Названы города России с самым доступным жильем
 Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
-
12.04.2024
Россиянам назвали лучшее время для продажи дачи
 Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
-
12.04.2024
Предсказано будущее рынка жилья в России
 «МК»: в России не отменят льготную ипотеку
«МК»: в России не отменят льготную ипотеку
-
12.04.2024
В Москве подешевела аренда квартир
 Аренда квартир в Москве подешевела на 10 %
Аренда квартир в Москве подешевела на 10 %
-
22.03.2024
Хуснуллин назвал необходимый размер ставки по ипотеке
 Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов