![]() — Все документы — ГОСТы — ГОСТ 33505-2015 КАРАНТИН РАСТЕНИЙ. МЕТОДЫ ВЫЯВЛЕНИЯ И ИДЕНТИФИКАЦИИ ПОТИВИРУСА ШАРКИ СЛИВ
— Все документы — ГОСТы — ГОСТ 33505-2015 КАРАНТИН РАСТЕНИЙ. МЕТОДЫ ВЫЯВЛЕНИЯ И ИДЕНТИФИКАЦИИ ПОТИВИРУСА ШАРКИ СЛИВ
ГОСТ 33505-2015 КАРАНТИН РАСТЕНИЙ. МЕТОДЫ ВЫЯВЛЕНИЯ И ИДЕНТИФИКАЦИИ ПОТИВИРУСА ШАРКИ СЛИВ
Добавил:
Дата: [01.09.2017]
ГОСТ 33505-2015 КАРАНТИН РАСТЕНИЙ. МЕТОДЫ ВЫЯВЛЕНИЯ И ИДЕНТИФИКАЦИИ ПОТИВИРУСА ШАРКИ СЛИВ
Plant quarantine. Methods of detection and identification of Plum pox virus
Дата введения - 1 января 2017 г.
Введен впервые
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 Разработан Федеральным государственным бюджетным учреждением "Всероссийский центр карантина растений" (ФГБУ "ВНИИКР")
2 Внесен Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 Принят Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 29 сентября 2015 г. N 80-П)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004-97 |
Код страны по МК (ИСО 3166) 004-97 |
Сокращенное наименование национального органа по стандартизации |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 1 октября 2015 г. N 1424-ст межгосударственный стандарт ГОСТ 33505-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2017 г.
5 Настоящий стандарт разработан с учетом основных нормативных положений Приложения ДП 2:2012 "Потивирус шарки слив" ("Plum pox virus") международного стандарта по фитосанитарным мерам Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО ООН) МСФМ 27:2006 "Диагностические протоколы для регулируемых вредных организмов" (ISPM 27:2006 "Diagnostic protocols for regulated pests")
6 Введен впервые
1 Область применения
Настоящий стандарт распространяется на плодовые косточковые культуры рода Prunus (далее - растения) и устанавливает методы выявления и идентификации (далее - исследование) потивируса шарки слив Plum pox virus (далее - потивирус шарки слив).
Примечание - Общие сведения о потивирусе шарки слив приведены в приложении А.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019-79 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты*
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 83-79 Реактивы. Натрий углекислый. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2156-76 Натрий двууглекислый. Технические условия
ГОСТ 2493-75 Реактивы. Калий фосфорнокислый двузамещенный 3-водный. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 4153-93 Секаторы. Технические условия
ГОСТ 4172-76 Реактивы. Натрий фосфорнокислый двузамещенный 12-водный. Технические условия
ГОСТ 4198-75 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4234-77 Реактивы. Калий хлористый. Технические условия
ГОСТ 6259-75 Реактивы. Глицерин. Технические условия
ГОСТ 6552-80 Реактивы. Кислота ортофосфорная. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия**
ГОСТ 20562-2013 Карантин растений. Термины и определения
ГОСТ 21240-89 Скальпели и ножи медицинские. Общие технические требования и методы испытаний
ГОСТ 21507-2013 Защита растений. Термины и определения
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 26678-85 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
ГОСТ 28311-89 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины, определения и сокращения
3.1 В настоящем стандарте применены термины по ГОСТ 20562 и ГОСТ 21507, а также следующие термины с соответствующими определениями:
3.1.1 инокулюм (в области карантина растений): Инфицированный материал (живые микроорганизмы), используемый для искусственного заражения.
3.1.2 инокуляция (в области карантина растений): Введение инокулюма в ткани индикаторных растений, а также в питательные среды.
3.1.3 стратифицированные семена: Семена, находящиеся в состоянии покоя и выдержанные в условиях достаточной влажности и хорошей аэрации для ускорения прорастания.
3.2 В настоящем стандарте применены следующие сокращения:
ДИЕКА - N, N-диэтилдитиокарбамат натрия;
ДНК - дезоксирибонуклеиновая кислота;
ДТТ - дитиотреитол;
ИФА - иммуноферментный анализ;
кДНК - комплементарная ДНК;
ОТ - обратная транскрипция;
п. н. - пара нуклеотидов;
ПЦР - полимеразная цепная реакция;
РНК - рибонуклеиновая кислота;
ЭДТА - этилендиаминтетрауксусная кислота;
HEPES - 4-(2-оксиэтил)1-пиперазинэтансульфоновая кислота.
4 Общие положения
4.1 Для выявления и идентификации потивируса шарки слив применяют отборочные и подтверждающие анализы, схема применения которых представлена на рисунке 1.
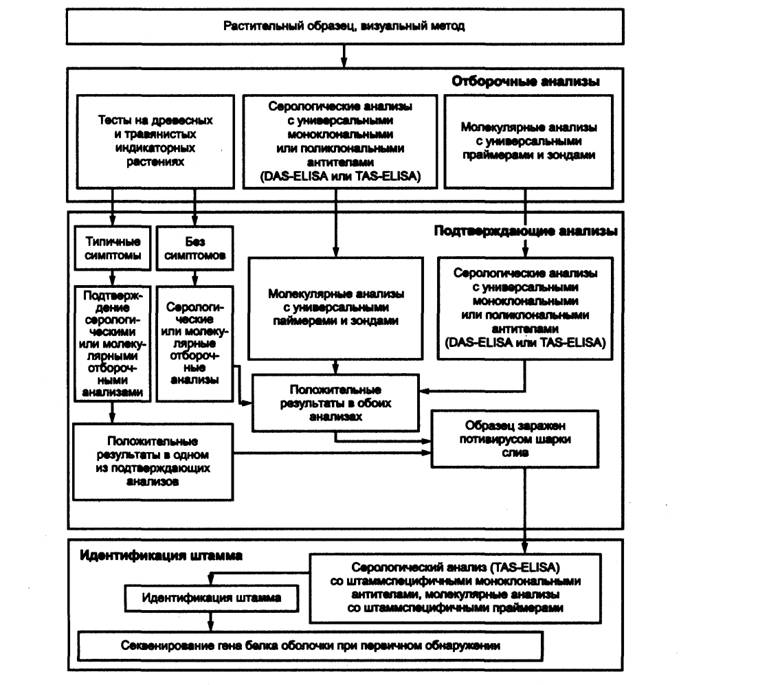
Рисунок 1 - Схема выявления и идентификации потивируса шарки слив
4.2 В качестве отборочных анализов используют биологические тесты на древесных и травянистых индикаторных растениях по 8.2, серологические анализы по 8.3 или молекулярные анализы по 8.4.
4.3 Результаты биологических тестов подтверждают дополнительными серологическими или молекулярными отборочными анализами.
Образец считают зараженным потивирусом шарки слив, если наличие симптомов на индикаторных растениях подтверждено положительными результатами серологических или молекулярных отборочных анализов.
4.4 Серологические отборочные анализы проводят твердофазным ИФА в модификациях DAS-ELISA и TAS-ELISA с универсальными моноклональными или поликлональными антителами, позволяющими выявлять все штаммы потивируса шарки слив.
Положительный результат в серологическом отборочном анализе проверяют в подтверждающем молекулярном анализе с универсальными праймерами и зондами на основе ПЦР в различных модификациях или методом гибридизации нуклеиновых кислот, позволяющими выявлять все штаммы потивируса шарки слив.
Образец считают зараженным потивирусом шарки слив при наличии положительных результатов в обоих анализах.
4.5 В случае использования в качестве отборочных анализов молекулярных методов положительный результат проверяют в подтверждающем серологическом анализе, который проводят твердофазным ИФА в модификациях DAS-ELISA и TAS-ELISA с универсальными моноклональными или поликлональными антителами, позволяющими выявлять все штаммы потивируса шарки слив.
Образец считают зараженным потивирусом шарки слив при наличии положительных результатов в обоих анализах.
4.6 При выявлении потивируса шарки слив отборочными и подтверждающими анализами рекомендуется проводить идентификацию штамма вируса твердофазным ИФА в модификации TAS-ELISA со штаммспецифичными моноклональными антителами или молекулярными методами с праймерами и зондами, специфичными к штаммам потивируса шарки слив.
4.7 При первичном обнаружении потивируса шарки слив рекомендуется провести секвенирование гена белка оболочки для сравнения с сиквенсами изолятов потивируса шарки слив в базах данных генетических последовательностей.
4.8 Исходный образец плодов или листьев растений с этикетками, образцы РНК и экстракты сока, полученные из образцов растений, хранят в пробирках при температуре минус 80°С не менее 12 мес; продукты амплификации ПЦР - при температуре минус 20°С не менее 12 мес.
5 Общие требования
5.1 Требования безопасности
При выполнении исследования необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007.
Исследования проводят в перчатках и лабораторных халатах. При работе с раствором бромистого этидия используют резиновые перчатки.
Помещение, в котором проводят исследования, должно быть оборудовано общей приточно-вытяжной вентиляцией по ГОСТ 12.4.021. Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
При работе с электроустановками электробезопасность должна соответствовать требованиям ГОСТ 12.1.019. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009. При работе с УФ-излучением необходимо пользоваться защитным экраном и защитными очками.
Утилизацию зараженного растительного материала проводят автоклавированием в течение 20 мин при температуре от 121°С до 125°С.
5.2 Требования к лаборатории
Общие требования к лаборатории - по ГОСТ ИСО МЭК 17025.
Для исключения ложноположительных результатов исследования и некорректной интерпретации полученных результатов ПЦР-лаборатория должна включать следующий набор рабочих зон:
- приема и регистрации образцов;
- первичной обработки образцов;
- выделения ДНК/РНК;
- проведения ПЦР;
- детекции продуктов амплификации (отсутствует в случае, если детекцию продуктов ПЦР осуществляют по методике ПЦР в режиме реального времени).
5.3 Требования к персоналу
Персонал, участвующий в исследовании, должен владеть методами ИФА и ПЦР и быть обучен технике обращения с лабораторным оборудованием.
6 Средства измерений, аппаратура, реактивы, посуда и материалы
6.1 Для отбора и хранения образцов по 7.2 используют:
- камеру холодильную диапазоном температур от 2°С до 5°С по ГОСТ 26678;
- спирт этиловый ректификованный технический по ГОСТ 18300;
- хлорамин;
- бумагу фильтровальную лабораторную по ГОСТ 12026;
- пакеты из полимеров этилена, герметично закрывающиеся;
- пакеты из полимеров этилена, с отверстиями для доступа воздуха;
- секатор по ГОСТ 4153;
- скальпель медицинский по ГОСТ 21240.
6.2 Для проведения биологического теста на древесных индикаторных растениях по 8.2.1 используют:
- семена персика стратифицированные безвирусные клонов GF 305 или Elberta;
- растения индикаторные древесные: вишню войлочную (Prunus tomentosa) клонов IR 473/1 или IR 474/1 или сливу Марьяне (Prunus marianna) гибрид GF 8.1 (Prunus cerasifera х Prunus munsoniana), или сливу терновую (Prunus insititia) клона St. Julien N 2, или сливу домашнюю (Prunus domestica) гибрид K4 (Kirke×Persikovaja), или сливу домашнюю (Prunus domestica) сорта Pozegaca.
6.3 Для проведения биологического теста на травянистых индикаторных растениях по 8.2.2 используют:
- весы по ГОСТ OIML R 76-1 высокого класса точности с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0, 0001 г;
- измельчитель лабораторный (гомогенизатор);
- измеритель рН диапазоном измерений от 0 до 14 ед. рН, имеющий минимальную чувствительность 0, 1 ед. рН;
- камеру холодильную диапазоном температур от 2°С до 5°С по ГОСТ 26678;
- альбумин бычий сывороточный молекулярной массы 69000 г/моль, х.ч.;
- альбумин яичный, х.ч.;
- воду дистиллированную по ГОСТ 6709;
- ДИЕКА молекулярной массы 225, 31 г/моль, х.ч.;
- дифенилдитиомочевина (N, N'-дифенилтиокарбамид) молекулярной массы 228, 31 г/моль), х.ч.;
- калия гидроокись по ГОСТ 24363;
- калия дигидроортофосфат (калий фосфорнокислый однозамещенный) по ГОСТ 4198;
- калия дигидрофосфат (калий фосфорнокислый двузамещенный 3-водный) по ГОСТ 2493;
- калия хлорид (калий хлористый) по ГОСТ 4234;
- кислоту ортофосфорную по ГОСТ 6552;
- кофеин (1, 3, 7-триметилксантин) молекулярной массы 194 г/моль, х.ч.;
- кремния карбид;
- натрия гидрофосфат додекагидрат (натрий фосфорнокислый двузамещенный 12-водный) по ГОСТ 4172;
- натрия хлорид (натрий хлористый) по ГОСТ 4233;
- никотин с содержанием действующего вещества не менее 99%, молекулярной массой 162, 2 г/моль;
- поливинилпирролидон;
- полисорбат 20 (твин 20);
- HEPES молекулярной массы 238, 31 г/моль;
- колбы мерные вместимостью 100, 200, 500 и 1000 см3 по ГОСТ 1770;
- контейнеры пластиковые вместимостью 50 см3;
- ступку фарфоровую с пестиком по ГОСТ 9147;
- перчатки одноразовые для лабораторных исследований;
- растения индикаторные травянистые: марь вонючую (Chenopodium foetidum) (в возрасте четырех - шести листьев), табак Кливленда (Nicotiana clevelandii) (в возрасте пяти - шести листьев), или гибрид табака Кливленда (Nicotiana clevelandii × табака клейкого Nicotiana giutinosa), или табак Бентхама (Nicotiana benthamiana), или никандру физалисовидную (Nicandra physalodes) и горох посевной (Pisum sativum);
- халаты лабораторные.
6.4. Для проведения исследования серологическими методами по 8.3 используют:
- весы по ГОСТ OIML R 76-1 высокого класса точности с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0, 0001 г;
- анализатор фотометрический иммуноферментный диапазоном длин волн от 400 до 800 нм и интерференционным светофильтром длиной волны 405 нм;
- встряхиватель лабораторный термостатируемый для 96-луночных планшетов, орбитального типа движения, диапазоном температур от 18°С до 40°С и скоростью вращения в диапазоне от 100 до 1300 об/мин;
- дозаторы восьмиканальные варьируемого объема от 100 до 200 мм3 в комплекте со сменными одноразовыми наконечниками по ГОСТ 28311;
- дозаторы одноканальные варьируемого объема от 10 до 500 мм3 в комплекте со сменными одноразовыми наконечниками по ГОСТ 28311;
- измельчитель лабораторный (гомогенизатор);
- измеритель рН диапазоном измерений от 0 до 14 ед. рН, имеющий минимальную чувствительность 0, 1 ед. рН;
- камеру холодильную диапазоном температур от 2°С до 5°С по ГОСТ 26678;
- устройство промывочное для 96-луночных планшетов любого типа;
- центрифугу лабораторную для микроцентрифужных пробирок типа Эппендорф вместимостью от 1, 5 до 2, 0 см3, со скоростью вращения не менее 2000 об/мин, с функцией охлаждения;
- альбумин бычий сывороточный молекулярной массы 69000 г/моль, х.ч.;
- альбумин яичный, х.ч.;
- воду дистиллированную по ГОСТ 6709;
- диэтаноламин;
- калия дигидроортофосфат (калий фосфорнокислый однозамещенный) по ГОСТ 4198;
- калия хлорид (калий хлористый) по ГОСТ 4234;
- кислоту соляную по ГОСТ 3118;
- натрия гидрокарбонат (натрий двууглекислый) по ГОСТ 2156;
- натрия гидрофосфат додекагидрат (натрий фосфорнокислый двузамещенный 12-водный) по ГОСТ 4172;
- ДИЕКА молекулярной массы 225, 31 г/моль, х.ч.;
- натрия карбонат (натрий углекислый) по ГОСТ 83;
- натрия хлорид (натрий хлористый) по ГОСТ 4233;
- поливинилпирролидон;
- полисорбат 20 (твин 20);
- р-нитрофенилфосфат;
- колбы мерные вместимостью 100, 200, 500 и 1000 см3 по ГОСТ 1770;
- контейнеры пластиковые вместимостью 50 см3;
- пробирки конические микроцентрифужные с крышкой типа Эппендорф вместимостью от 1, 5 до 2, 0 см3;
- ступку фарфоровую с пестиком по ГОСТ 9147;
- тест-системы для проведения твердофазного ИФА потивируса шарки слив в модификациях DAS-ELISA и TAS-ELISA, включающие, в зависимости от изготовителя: планшеты полистироловые 96-луночные в комплекте с крышкой для закрывания или пленкой для заклеивания лунок, контроли положительные и отрицательные, специфические антитела, конъюгаты антител с ферментами-маркерами, буферные растворы и реактивы;
- перчатки одноразовые для лабораторных исследований;
- халаты лабораторные.
6.5 Для проведения исследования молекулярными методами по 8.4 используют:
- весы по ГОСТ OIML R 76-1 высокого класса точности с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0, 0001 г;
- амплификатор под микроцентрифужные пробирки типа Эппендорф вместимостью 0, 2 и 0, 5 см3 со скоростью нагрева/охлаждения активного элемента не менее 1, 5°С/с;
- дозаторы одноканальные варьируемого объема от 10 до 500 мм3 в комплекте со сменными одноразовыми наконечниками по ГОСТ 28311;
- измельчитель лабораторный (гомогенизатор);
- измеритель рН диапазоном измерений от 0 до 14 ед. рН, имеющий минимальную чувствительность 0, 1 ед. рН;
- калия хлорид (калий хлористый) по ГОСТ 4234;
- камеру морозильную, способную поддерживать температуру до минус 80°С по ГОСТ 26678;
- камеру холодильную диапазоном температур от 2°С до 5°С по ГОСТ 26678;
- микроцентрифугу-встряхиватель со скоростью вращения до 2000 об/мин;
- прибор для горизонтального электрофореза с комплектом кювет и гребенок;
- ПЦР-бокс или бокс ламинарный;
- ПЦР-детектор диапазоном длин волн от 470 до 580 нм;
- термостат твердотельный для микроцентрифужных пробирок типа Эппендорф, диапазоном температур от 25°С до 100°С;
- трансиллюминатор ультрафиолетовый в комплекте с гельдокументирующей системой;
- центрифугу лабораторную для микроцентрифужных пробирок типа Эппендорф вместимостью от 1, 5 до 2, 0 см3, со скоростью вращения не менее 2000 об/мин, с функцией охлаждения;
- альбумин бычий сывороточный молекулярной массы 69000 г/моль, х.ч.;
- альбумин яичный, х.ч.;
- бромфеноловый голубой (краситель);
- воду дистиллированную по ГОСТ 6709;
- глицерин по ГОСТ 6259;
- калия дигидроортофосфат (калий фосфорнокислый однозамещенный) по ГОСТ 4198;
- кислоту уксусную по ГОСТ 61;
- натрия гидрофосфат додекагидрат (натрий фосфорнокислый двузамещенный 12-водный) по ГОСТ 4172;
- натрия хлорид (натрий хлористый) по ГОСТ 4233;
- набор реагентов для выделения нуклеиновых кислот из растительных образцов;
- набор реагентов для проведения ОТ, включающий из расчета на один образец: 100 ед./мм3 обратной транскриптазы вируса лейкемии мышей (ревертазы MMLV) - 2 мм3 (200 ед); 5х буферный раствор для синтеза первой цепи кДНК (гидрохлорида Трис молярной концентрации 280 ммоль/дм3, рН 8, 7; хлорида калия молярной концентрации 375 ммоль/дм3; хлорида магния молярной концентрации 30 ммоль/дм3) - 4 мм3; ДТТ молярной концентрации 20 ммоль/дм3 - 2 мм3 (40 ммоль/дм3); смесь из четырех дезоксинуклеозидтрифосфатов (dNTP) (по 10 ммоль/дм3 каждого) - 2 мм3 (20 ммоль/дм3); 0, 02 ммоль/дм3 праймера Oligo (dT)17 - 0, 5 мм3 (0, 01 ммоль/дм3); 0, 02 ммоль/дм3 праймера Random (dN)10 - 0, 5 мм3 (0, 01 ммоль/дм3); РНК анализируемого образца - 5 мм3; воду стерильную - до 20 мм3.
Примечание - При использовании наборов реагентов с модифицированной ревертазой MMLV или обратной транскриптазой миелобластоза птиц (ревертаза AMV) состав и концентрацию ингредиентов реакционной смеси корректируют в соответствии с инструкциями изготовителей;
- набор реагентов для проведения ПЦР, включающий из расчета на один образец: 5х мастер-микс, содержащий Smart Taq-полимеразу; смесь из четырех дезоксинуклеозидтрифосфатов (dNTP), хлорида магния и реакционного буферного раствора - 5 мм3; специфические праймеры - по 2 мм3 каждого праймера (по 2 х 10-8 ммоль/дм3); синтезированную кДНК - 4 мм3; воду стерильную - 12 мм3.
Примечание - При использовании наборов реагентов с другими типами Taq-полимеразы состав и концентрацию ингредиентов реакционной смеси корректируют в соответствии с инструкциями изготовителей;
- набор реагентов для проведения ПЦР в режиме реального времени и в формате FLASH;
- набор реагентов для проведения электрофореза;
- натрия гидрокарбонат (натрий двууглекислый) по ГОСТ 2156;
- натрия карбонат (натрий углекислый) по ГОСТ 83;
- поливинилпирролидон;
- раствор дезинфицирующий, вызывающий деградацию ДНК;
- трис (оксиметил) аминометан (Трис);
- ЭДТА;
- этидий бромистый, х.ч.;
- колбы мерные вместимостью 100, 500 и 1000 см3 по ГОСТ 1770;
- контейнеры пластиковые, вместимостью 50 см3;
- пробирки конические микроцентрифужные с крышкой типа Эппендорф вместимостью 0, 2; 0, 5; от 1, 5 до 2, 0 см3;
- ступку фарфоровую с пестиком по ГОСТ 9147;
- перчатки одноразовые для лабораторных исследований и резиновые;
- пленку лабораторную Парафилм;
- праймеры для универсального выявления всех изолятов потивируса шарки слив:
Р1: 5'-АСС GAG ACC ACT АСА СТС СС-3';
Р2: 5'-CAG ACT АСА GCC TCG CCA GA-3';
3'NCR sense: 5' -GTA GTG GTC TCG GTA TCT АТС АТА-3';
3'NCR antisense: 5' -GTC TCT TGC ACA AGA ACT ATA ACC-3';
- праймеры для выявления штамма PPV-D:
Р1: 5'-3'ACC GAG ACC ACT АСА СТС СС;
PD: 5'-3'CTT CAA CGA CAC CCG TAC GG;
- праймеры для выявления штамма PPV-M:
Р1: 5'-3'ACC GAG ACC ACT АСА СТС СС;
РМ: 5'-3'CTT CAA CAA CGC CTG TGC GT;
- праймеры для выявления штамма PPV-Rec:
mD5: 5'-TAT GTC АСА TAA AGG CGT TCT C-3';
mM3: 5'-CAT TTC CAT AAA CTC CAA AAG AC-3';
- праймеры для выявления штамма PPV-C:
CSoC-2: 5'-TAC АТС TCG АТС CTT CCT C-3';
HSoC-2: 5'-TCC ACC ATT CCC AAA TCT G'-3';
- праймеры для выявления штамма PPV-CR:
CR8597F: 5'-ATGATGTGACGTTAGTGGAC-3'
CR9023R: 5'-TCGTGTGTTAGACAGGTCAAC-3';
- праймеры для выявления штамма PPV-W:
W8328F: 5'-GCA TCA ATG GTA GAG GCA TG-3;
W8711R: 5'-CAT TGA CGT TGT GCT CTG CA-3;
- халаты лабораторные.
6.6 Допускается применение других средств измерений и посуды по метрологическим характеристикам, а также аппаратуры, реактивов и материалов по техническим характеристикам не хуже вышеуказанных.
7 Подготовка к исследованиям
7.1 Приготовление растворов
7.1.1 Приготовление растворов для теста на травянистых индикаторных растениях
7.1.1.1 Приготовление натрий-фосфатного буферного раствора с рН 7, 3
В мерной колбе вместимостью 1000 см3 с 800 см3 дистиллированной воды растворяют 8 г хлорида натрия, 0, 2 г хлорида калия, 2, 9 г гидрофосфат додекагидрата натрия и 0, 2 г дигидроортофосфата калия. Доводят дистиллированной водой до метки и перемешивают. Проверяют рН буферного раствора, который должен быть (7, 3±0, 1) ед. рН.
Срок хранения натрий-фосфатного буферного раствора в колбе в холодильной камере при температуре от 2°С до 5°С - не более 5 сут.
7.1.1.2 Приготовление промывочного буферного раствора
В мерную колбу вместимостью 1000 см3 наливают 800 см3 натрий-фосфатного буферного раствора по 7.1.1.1 и добавляют 0, 5 см3 твина 20. Доводят дистиллированной водой до метки и перемешивают.
Срок хранения промывочного буферного раствора в колбе в холодильной камере при температуре от 2°С до 5°С - не более 5 сут.
7.1.1.3 Приготовление экстрагирующего буферного раствора
Вариант 1
В мерную колбу вместимостью 500 см3 наливают 400 см3 промывочного буферного раствора по 7.1.1.2, добавляют 10 г поливинилпирролидона и 1 г яичного или бычьего сывороточного альбумина. Доводят дистиллированной водой до метки и перемешивают.
Вариант 2
В мерную колбу вместимостью 500 см3 наливают 400 см3 промывочного буферного раствора по 7.1.1.2, добавляют 10 г поливинилпирролидона и 2, 25 г ДИЕКА молярной концентрации 0, 01 моль/дм3. Доводят дистиллированной водой до метки и перемешивают.
Срок хранения экстрагирующего буферного раствора в колбе в холодильной камере при температуре от 2°С до 4°С - не более 2 сут.
7.1.1.4 Приготовление стабилизирующего HEPES буферного раствора с рН 8, 0
В мерной колбе вместимостью 1000 см3 с 825, 7 см3 дистиллированной воды растворяют 238, 3 г HEPES молярной концентрации 0, 02 моль/дм3. Доводят 10%-ным раствором гидроокиси калия рН до 8, 0 и перемешивают.
Срок хранения HEPES буферного раствора в колбе в холодильной камере при температуре от 2°С до 5°С - не более 5 сут.
7.1.1.5 Приготовление фосфатного буферного раствора молярной концентрации 0, 03 моль/дм3, рН 8, 5
В мерной колбе вместимостью 1000 см3 с 500 см3 дистиллированной воды растворяют 3, 5 г дигидрофосфата калия и 4, 5 г хлорида натрия. Доводят рН до 8, 5 с помощью смеси равных объемов 10%-ного раствора ортофосфорной кислоты и дистиллированной воды и перемешивают.
Срок хранения фосфатного буферного раствора в колбе в холодильной камере при температуре от 2°С до 5°С - не более 10 сут.
7.1.1.6 Приготовление стабилизирующего раствора с ДИЕКА, дифенилдитиомочевиной и кофеином
В мерной колбе вместимостью 200 см3 с 100 см3 фосфатного буферного раствора по 7.1.1.5 растворяют 3, 38 г ДИЕКА молярной концентрации 0, 015 моль/дм3, 3, 42 г дифенилдитиомочевины молярной концентрации 0, 015 моль/дм3 и 5, 82 г кофеина молярной концентрации 0, 03 моль/дм3 и перемешивают.
Срок хранения раствора с ДИЕКА, дифенилдитиомочевиной и кофеином в колбе в холодильной камере при температуре от 2°С до 5°С - не более 5 сут.
7.1.1.7 Приготовление 1%-ного стабилизирующего раствора никотина
В мерной колбе вместимостью 100 см3 с 90 см3 дистиллированной воды растворяют 10 см3 никотина и перемешивают.
Раствор используют немедленно, хранение не допускается.
7.1.1.8 Допускается использование готовых буферных растворов и стабилизирующих смесей в соответствии с инструкциями изготовителей.
7.1.2 Приготовление растворов для исследований серологическими методами
7.1.2.1 Для проведения исследований потивируса шарки слив серологическими методами используют натрий-фосфатный буферный раствор по 7.1.1.1, промывочный буферный раствор по 7.1.1.2, экстрагирующий буферный раствор по 7.1.1.3, а также следующие буферные растворы.
7.1.2.2 Приготовление карбонатного буферного раствора с рН 9, 6
В мерной колбе вместимостью 1000 см3 с 800 см3 дистиллированной воды растворяют 1, 59 г карбоната натрия и 2, 93 г гидрокарбоната натрия. Доводят дистиллированной водой до метки и перемешивают.
Проверяют рН буферного раствора, который должен быть (9, 6±0, 1) ед. рН.
Срок хранения карбонатного буферного раствора в колбе в холодильной камере при температуре от 2°С до 5°С - не более 10 сут.
7.1.2.3 Приготовление 0, 5%-ного раствора бычьего сывороточного альбумина
В мерной колбе вместимостью 100 см3 с 99 см3 дистиллированной воды растворяют 0, 5 см3 бычьего сывороточного альбумина и перемешивают.
Срок хранения 0, 5%-ного раствора бычьего сывороточного альбумина в колбе в холодильной камере при температуре от 2°С до 5°С - не более 1 сут.
7.1.2.4 Приготовление буферного раствора для конъюгата
В мерной колбе вместимостью 200 см3 с 100 см3 натрий-фосфатного буферного раствора по 7.1.1.1 растворяют 0, 5 г 0, 5%-ного раствора бычьего сывороточного альбумина.
Срок хранения буферного раствора для конъюгата в колбе в холодильной камере при температуре от 2°С до 5°С - не более 3 сут.
7.1.2.5 Приготовление субстратного буферного раствора с рН 9, 8
В мерной колбе вместимостью 1000 см3 с 800 см3 дистиллированной воды растворяют 97 см3 диэтаноламина. Доводят концентрированной соляной кислотой рН до (9, 8±0, 1) ед. рН, затем доводят дистиллированной водой до метки и перемешивают.
Срок хранения субстратного буферного раствора в колбе в холодильной камере при температуре от 2°С до 4°С - не более 10 сут.
7.1.2.6 Допускается использование готовых буферных растворов в соответствии с инструкциями изготовителей.
7.1.3 Приготовление растворов для исследований молекулярными методами
7.1.3.1 Для проведения исследований потивируса шарки слив молекулярными методами используют натрий-фосфатный буферный раствор по 7.1.1.1, промывочный буферный раствор по 7.1.1.2 без добавления твина-20, экстрагирующий буферный раствор по 7.1.1.3 (вариант 1), карбонатный буферный раствор по 7.1.2.2, а также следующие буферные растворы.
7.1.3.2 Приготовление буферного раствора 0, 5х ТАЕ
В мерной колбе вместимостью 1000 см3 с 100 см3 ЭДТА молярной концентрации 0, 5 моль/дм3, рН 8, 0, растворяют 242 г Трис и 58 см3 ледяной уксусной кислоты. Доводят дистиллированной водой до метки и перемешивают.
Срок хранения буферного раствора 0, 5х ТАЕ в колбе при температуре от 18°С до 25°С - не более 7 сут, в холодильной камере при температуре от 2°С до 5°С - не более 30 сут.
7.1.3.3 Приготовление загрузочного буферного раствора
В мерной колбе вместимостью 100 см3 с 7 см3 дистиллированной воды растворяют 0, 025 г бромфенолового голубого и 3 см3 глицерина.
Загрузочный буферный раствор используют немедленно, хранение не допускается.
7.1.3.4 Приготовление раствора бромистого этидия
В мерной колбе вместимостью 100 см3 с 100 см3 дистиллированной воды растворяют 1 г бромистого этидия.
Срок хранения раствора бромистого этидия в посуде из темного стекла в холодильной камере при температуре от 2°С до 5°С - не более 12 мес.
7.1.3.5 Допускается использование готовых буферных растворов в соответствии с инструкциями изготовителей.
7.2 Отбор и хранение образцов
7.2.1 Правила отбора образцов
При наличии на растениях типичных симптомов потивируса шарки слив отбирают листья, цветки или плоды с симптомами.
На бессимптомных растениях осенью отбирают полностью сформировавшиеся листья, зимой - побеги, весной и летом - листья, цветки, незрелые плоды или побеги.
Примечания
1 При температуре окружающей среды выше 30°С в течение 5 сут необходимо исключить отбор образцов с середины июля до начала сентября.
2 Побеги подвергают искусственному пробуждению в лабораторных условиях и используют в качестве образцов их вегетативные и цветочные почки, а также камбиальный слой.
В маточно-черенковых садах весной - в начале лета (в период завершения роста побегов) отбирают по 12 листьев с центральной части кроны каждого дерева или по четыре побега с листьями (длиной от 10 до 15 см) с четырех сторон средней части кроны. В зимний период на каждом маточно-черенковом растении отбирают по четыре побега длиной от 15 до 20 см с четырех сторон средней части кроны.
Образцы отбирают на каждой породно-сорто-подвойной комбинации.
Одновременно отбирают образцы с дикорастущих растений рода Prunus, расположенных вблизи насаждений культурных растений.
7.2.2 Объем выборки образцов
7.2.2.1 В зависимости от числа подвоев выборка образцов составляет:
- до 100 шт. подвоев - не менее пяти образцов;
- от 101 до 1000 шт. - 10 образцов;
- от 1001 до 3000 шт. - 20 образцов;
- от 3001 до 10000 шт. - 30 образцов;
- от 10001 до 50000 шт. - 50 образцов;
- от 50001 до 100000 шт. - 80 образцов;
- более 100000 шт. - 100 образцов.
7.2.2.2 Для однолетних привитых некронированных саженцев выборка образцов составляет:
- до 100 шт. саженцев - не менее трех образцов;
- от 101 до 1000 шт. - не менее шести образцов;
- от 1001 до 5000 шт. - 10 образцов;
- от 5001 до 10000 шт. - 20 образцов;
- более 10000 шт. - 30 образцов.
7.2.2.3 Для одно - двухлетних привитых кронированных саженцев выборка образцов составляет:
- до 100 шт. саженцев - не менее трех образцов;
- от 101 до 1000 шт. - не менее пяти образцов;
- от 1001 до 5000 шт. - 10 образцов;
- от 5001 до 10000 шт. - 15 образцов;
- более 10000 шт. - 20 образцов.
7.2.2.4 На саженцах с закрытой корневой системой отбирают один образец вегетативных частей на каждую тысячу саженцев одной сорто-подвойной комбинации.
Образец формируют следующим способом:
- в период вегетации на отдельном растении подвоя или саженца в питомнике отбирают с различных частей кроны три хорошо развитых листа, листья с 10 растений объединяют в исходный образец;
- в зимний период на отдельном растении подвоя или саженца в питомнике или в хранилищах отбирают по одному - два побега длиной от 15 до 20 см, побеги с 10 растений объединяют в исходный образец.
7.2.2.5 В плодоносящих насаждениях образцы отбирают на растениях с симптомами заражения потивирусом шарки слив. При отсутствии симптомов с 1 га каждой сорто-подвойной комбинации отбирают по пять образцов вегетативных частей растений, объединяя в исходный образец вегетативные части 10 растений.
7.2.2.6 В период вегетации на одном растении отбирают четыре листа с четырех сторон кроны в средней части скелетной ветви на одно - двухлетних побегах, листья с 10 деревьев объединяют в исходный образец. При этом весной и в начале лета рекомендуется отбирать полностью развитые листья со средней части побегов, а осенью - листья с верхушек побегов.
7.2.2.7 В зимний период на плодоносящих деревьях рекомендуется отбирать двух - трехлетние побеги с обязательным наличием цветочных почек. На одном дереве отбирают четыре побега с четырех сторон кроны в средней части скелетной ветви, побеги с 10 деревьев объединяют в исходный образец.
7.2.2.8 После отбора каждого образца инструменты (секатор, скальпель), используемые при отборе, обеззараживают этиловым спиртом или хлорамином.
7.2.2.9 Образцы помещают в герметично закрывающиеся полиэтиленовые пакеты, в которые вкладывают этикетку с указанием культуры, сорта и подвоя, фазы развития растения, происхождения привойного и подвойного материала, места и даты отбора, а также фамилии специалиста, отобравшего образец, и направляют для последующей идентификации в соответствии с 8.3 и 8.4.
7.2.2.10 После отбора образцов составляют акт, который подписывает представитель хозяйства и специалист, отобравший образец.
7.2.3 Хранение образцов
7.2.3.1 Перед исследованием допускается хранение образцов листьев в течение не более семи дней при температуре от 3°С до 5°С. Плоды и покоящиеся черенки допускается хранить в течение одного месяца при температуре от 3°С до 5°С.
7.2.3.2 Свежие листья и плоды перекладывают умеренно увлажненной фильтровальной бумагой, помещают в полиэтиленовые пакеты с отверстиями для доступа воздуха и хранят при температуре от 3°С до 5°С. Нижнюю часть черенков, находящихся в состоянии покоя, упаковывают в фильтровальную бумагу, которую регулярно увлажняют; черенки помещают в полиэтиленовые пакеты с отверстиями для доступа воздуха и хранят при температуре от 3°С до 5°С.
8 Методы выявления и идентификации потивируса шарки слив
8.1 Визуальный метод выявления
8.1.1 Сущность метода
Сущность метода заключается в визуальном обследовании листьев растений в конце весны - начале лета и с осмотром листьев и плодов растений осенью в период созревания на наличие симптомов поражения потивирусом шарки слив.
8.1.2 Проведение обследования
8.1.2.1 При однородном породном и сортовом составе растений обследование проводят по двум диагоналям и четырем сторонам обследуемого участка.
При разносортном составе растений обследование участка проводят на каждом сорте растений в соответствии с 8.1.2.2.
В насаждениях вегетативно размножаемых подвоев обследование проводят на каждой сорто-подвойной комбинации в соответствии с 8.1.2.2.
При происхождении посадочного материала из разных питомников обследуют каждую партию исходного посадочного материала.
8.1.2.2 В зависимости от вида и площади обследуемого участка устанавливают следующие нормы обследования:
- на участках площадью более 3 га осматривают не менее 20% растений;
- участках менее 3 га - от 20% до 50% растений;
- приусадебных участках - 100% растений.
В маточно-черенковых садах обследуют каждое растение.
8.1.2.3 При обследовании одновременно осматривают корневую поросль растений и дикорастущие растения рода Prunus, произрастающие вблизи насаждений культурных растений.
8.1.2.4 В случае обнаружения симптомов поражения потивирусом шарки слив на листьях и плодах, представленных в приложениях Б и В, проводят отбор образцов по 7.2 для последующей идентификации в соответствии с 8.3 и 8.4.
8.1.2.5 После завершения обследования составляют акт, который подписывает представитель хозяйства и обследователь.
8.2 Биологические методы выявления
8.2.1 Тест на древесных индикаторных растениях
8.2.1.1 Сущность теста
Сущность теста заключается в прививке исследуемого образца растения (черенка, почки или участка коры) на древесные индикаторные растения с целью последующего обнаружения специфических симптомов заражения потивирусом шарки слив.
8.2.1.2 Проведение теста
Семена персика (Prunus persica) высаживают в горшки в зимней теплице в феврале - марте, затем в возрасте 60 дней на полученные сеянцы прививают по два - три глазка или щитка коры от исследуемого образца, верхушку сеянца удаляют.
При отсутствии зимней теплицы тест проводят в полевых условиях, высаживая в марте - мае сеянцы персика, инокулированные в зимний период глазками или щитками коры исследуемого образца.
Повторность теста в полевых условиях - трехкратная, один сеянец персика оставляют неинокулированным в качестве контроля. Продолжительность теста - три года.
Одно - двухлетние индикаторные растения инокулируют методом массированного заражения, прививая по четыре - шесть глазков или щитков коры исследуемого образца.
Повторность тестов на сеянцах персика в теплице и одно - двухлетних индикаторных растениях пятикратная, один сеянец/индикаторное растение оставляют неинокулированным в качестве контроля. Продолжительность теста - один год.
Зараженность потивирусом шарки слив исследуемых образцов растений выявляют по наличию симптомов, представленных в таблице 1.
Таблица 1 - Симптомы потивируса шарки слив на древесных индикаторных растениях
|
Наименование растения |
Симптомы |
|
Сеянцы персика (Prunus persica) клонов Elberta и GF 305 |
Посветление жилок и деформация листьев |
|
Войлочная вишня (Prunus tomentosa) клонов IR 473/1 или IR 474/1 |
Хлоротическая крапчатость, хлороз жилок, некротические пятна и деформация листьев |
|
Слива Марьяне (Prunus marianna) гибрид GF 8.1 (Prunus cerasifera × Prunus munsoniana) |
Диффузные хлоротические пятна на листьях |
|
Слива терновая (Prunus insititia) клона St. Julien N 2 |
Хлоротические пятна и кольца на листьях |
|
Слива домашняя (Prunus domestica) гибрид K4 (Kirke × Persikovaja) |
Светло-зеленая крапчатость и некротические пятна на листьях, некрозы верхушек побегов, отмирание растений при заражении сильнопатогенными штаммами |
|
Слива домашняя (Prunus domestica) сорта Pozegaca |
Хлоротические кольца, полосы и пятна на листьях |
8.2.2 Тест на травянистых индикаторных растениях
8.2.2.1 Сущность теста
Сущность теста заключается в приготовлении смеси исследуемого образца растения с экстрагирующим буферным раствором, инокуляции полученной смесью травянистых индикаторных растений с целью последующего обнаружения специфических симптомов заражения потивирусом шарки слив.
8.2.2.2 Подготовка проб
Исследуемый образец растения, отобранный по 7.2.1, массой 1 г гомогенизируют в пластиковом контейнере с 20 см3 экстрагирующего буферного раствора по 7.1.1.3 на гомогенизаторе в течение 2 - 5 мин или с помощью фарфоровой ступки и пестика до получения однородной суспензии.
8.2.2.3 Проведение теста
Подготовленную пробу растительного материала, полученную по 8.2.2.2, смешивают с одним из стабилизирующих растворов по 7.1.1 (фосфатным буферным раствором, раствором с ДИЕКА, дифенилдитиомочевиной и кофеином, раствором никотина или HEPES буферным раствором) в соотношении 1:3, растирают в фарфоровой ступке и образовавшимся соком натирают поверхность листьев травянистых индикаторных растений, предварительно опудренных карбидом кремния.
Примечание - Растворы и фарфоровую ступку перед растиранием охлаждают до температуры 3°С.
При использовании раствора никотина в качестве стабилизирующего раствора место инокуляции промывают дистиллированной водой с целью предотвращения появления ожогов.
Повторность теста - пятикратная, одно индикаторное растение оставляют неинокулированным в качестве контроля. Продолжительность теста - 20 дней.
Зараженность потивирусом шарки слив исследуемых образцов растений выявляют по наличию симптомов, представленных в таблице 2.
Таблица 2 - Симптомы потивируса шарки слив на травянистых индикаторных растениях
|
Наименование растения |
Симптомы |
|
Марь вонючая (Chenopodium foetidum) |
Хлоротические, хлоротически-некротические или некротические пятна (в зависимости от изолята вируса) на инокулированных листьях, отсутствие системного заражения |
|
Табак Кливленда (Nicotiana clevelandii) или гибрид табака Кливленда и табака клейкого (Nicotiana clevelandii × Nicotiana glutinosa) |
Хлоротические или некротические пятна на инокулированных листьях, системная хлоротическая крапчатость |
|
Табак Бентхама (Nicotiana benthamiana) |
Системные карликовость растений, хлоротическая мозаика с темно-зелеными участками ткани, деформации листьев |
|
Никандра физалисовидная (Nicandra physalodes) |
Темно-коричневые некротические пятна на инокулированных листьях |
|
Горох посевной (Pisum sativum) |
Системные светло-зеленая мозаика, хлоротическая крапчатость |
8.3 Серологические методы выявления и идентификации
8.3.1 Сущность методов
Серологические методы исследования потивируса шарки слив представлены твердофазным ИФА в модификациях DAS-ELISA и TAS-ELISA.
Сущность методов ИФА заключается в выявлении в образце иммунного комплекса "антиген-антитело" к потивирусу шарки слив путем присоединения к одному из компонентов реакции ферментативной метки с последующей ее детекцией в сравнении с положительными и отрицательными контролями.
8.3.2 Подготовка проб
Исследуемый образец растения, отобранный по 7.2.1, массой 1 г гомогенизируют в пластиковом контейнере с 20 см3 экстрагирующего буферного раствора по 7.1.1.3 на гомогенизаторе в течение 2 - 5 мин или с помощью фарфоровой ступки и пестика до получения однородной суспензии и осветляют центрифугированием в течение 5 мин при скорости 2000 об/мин с охлаждением до температуры 5°С.
8.3.3 Проведение исследования
8.3.3.1 Твердофазный ИФА в модификации DAS-ELISA
Твердофазный ИФА в модификации DAS-ELISA на выявление потивируса шарки слив (в том числе с использованием тест-системы биотин/стрептавидин) проводят с использованием тест-систем и специфических моноклональных антител 5B-IVIA или поликлональных антител для универсального выявления всех изолятов потивируса шарки слив в соответствии с инструкциями изготовителей.
Готовят рекомендуемое разведение кроличьих поликлональных антител или моноклональных антител 5B-IVIA в карбонатном буферном растворе по 7.1.2.2 и вносят по 200 мм3 в каждую лунку планшета, используя дозаторы со сменными одноразовыми наконечниками.
Планшет закрывают и инкубируют в термостатируемом встряхивателе при температуре 37°С в течение 4 ч или при температуре 4°С в течение 16 ч и трижды промывают лунки планшета промывочным буферным раствором по 7.1.1.2.
Вносят в каждую лунку планшета по 200 мм3 пробы растительного экстракта, полученной по 8.3.2. Используют по две лунки для каждого образца и для положительного контроля и не менее двух лунок для отрицательного контроля. Лунки маркируют.
Планшет закрывают и инкубируют в холодильной камере при температуре 4°С в течение 16 ч и трижды промывают лунки планшета промывочным буферным раствором.
Для универсального выявления всех изолятов потивируса шарки слив готовят рекомендуемое разведение конъюгата в буферном растворе для конъюгата по 7.1.2.4.
Вносят в каждую лунку планшета по 200 мм3 поликлональных антител или моноклональных антител 5B-IVIA, конъюгированных с щелочной фосфатазой или биотином.
Планшет закрывают и инкубируют в термостатируемом встряхивателе при температуре 37°С в течение 2 - 4 ч в зависимости от рекомендаций изготовителя тест-системы и трижды промывают лунки планшета промывочным буферным раствором.
В случае если антитела мечены биотином, используют рекомендуемые разведения стрептавидин-щелочнофосфатазного конъюгата. Вносят по 200 мм3 в каждую лунку планшета.
Планшет закрывают и инкубируют в термостатируемом встряхивателе при температуре 37°С в течение 30 мин и трижды промывают лунки планшета промывочным буферным раствором.
Для обеих тест-систем (традиционной системы и системы биотин/стрептавидин) готовят раствор субстрата для щелочной фосфатазы (1 мг р-нитрофенил-фосфата на 1 см3 субстратного буферного раствора по 7.1.2.5) и вносят по 200 мм3 в каждую лунку планшета.
Планшет закрывают и инкубируют при температуре от 18°С до 25°С, затем считывают показания на иммуноферментном фотометрическом анализаторе при длине волны 405 нм через 30, 60, 90 и 120 мин.
8.3.3.2 Твердофазный ИФА в модификации TAS-ELISA
Твердофазный ИФА в модификации TAS-ELISA на выявление потивируса шарки слив проводят с использованием тест-систем и специфических моноклональных антител 5B-IVIA для универсального выявления всех изолятов потивируса шарки слив в соответствии с инструкциями изготовителей.
Характеризацию и типизацию штаммов PPV-D, PPV-M, PPV-C и PPV-EA осуществляют с использованием специфических моноклональных антител, специфичных к этим штаммам.
Готовят рекомендуемое разведение кроличьих поликлональных иммуноглобулинов к потивирусу шарки слив в карбонатном буферном растворе по 7.1.2.2 и вносят по 200 мм3 в каждую лунку планшета, используя дозаторы со сменными одноразовыми наконечниками.
Планшет закрывают и инкубируют в термостатируемом встряхивателе при температуре 37°С в течение 4 ч или при температуре 4°С в течение 16 ч и трижды промывают лунки планшета промывочным буферным раствором по 7.1.1.2.
Вносят в каждую лунку планшета по 200 мм3 пробы растительного экстракта, полученной по 8.3.2. Используют по две лунки для каждого образца и для положительного контроля и не менее двух лунок для отрицательного контроля. Лунки маркируют.
Планшет закрывают и инкубируют в холодильной камере при температуре 4°С в течение 16 ч и трижды промывают лунки планшета промывочным буферным раствором.
Для универсального выявления всех изолятов потивируса шарки слив готовят рекомендуемые разведения моноклональных антител 5B-IVIA в буферном растворе для конъюгата по 7.1.2.4 и вносят по 200 мм3 раствора антител в каждую лунку планшета.
Для специфического выявления штамма PPV-D с использованием моноклональных антител 4D, штамма PPV-M с использованием моноклональных антител AL, штамма PPV-C с использованием моноклональных антител Ас, штамма PPV-EA с использованием моноклональных антител ЕА готовят рекомендуемые разведения соответствующих моноклональных антител в буферном растворе для конъюгата и вносят по 200 мм3 раствора антител в каждую лунку планшета.
Планшет закрывают и инкубируют в термостатируемом встряхивателе при температуре 37°С в течение 2 ч и трижды промывают лунки планшета промывочным буферным раствором.
Вносят в лунки планшета антимышиные иммуноглобулины, конъюгированные с щелочной фосфатазой, готовят рекомендуемое разведение конъюгата в буферном растворе для конъюгата. Вносят по 200 мм3 в каждую лунку планшета.
Планшет закрывают и инкубируют в термостатируемом встряхивателе при температуре 37°С в течение 2 ч и трижды промывают лунки планшета промывочным буферным раствором.
Готовят раствор субстрата для щелочной фосфатазы (1 мг р-нитрофенил-фосфата на 1 см3 субстратного буферного раствора по 7.1.2.5).
Планшет закрывают и инкубируют при температуре от 18°С до 25°С, затем считывают показания на иммуноферментном фотометрическом анализаторе при длине волны 405 нм через 30, 60, 90 и 120 мин.
8.3.4 Обработка результатов
Результат исследования считают отрицательным, если значение абсорбции образца не более двукратного значения абсорбции в отрицательном контроле.
8.4 Молекулярные методы выявления и идентификации
8.4.1 Сущность методов
Сущность молекулярных методов исследования потивируса шарки слив заключается в выявлении вируса в образце путем многократного избирательного копирования определенного участка нуклеиновой кислоты при помощи ферментов в искусственных условиях (in vitro) в целях обнаружения чужеродной для образца РНК вируса.
8.4.2 Подготовка к исследованию
8.4.2.1 Для ОТ рекомендуется использовать готовые наборы реагентов (мастер-миксы). Приготовление реакционных смесей осуществляют с помощью микроцентрифуги-встряхивателя в соответствии с инструкциями изготовителей.
8.4.2.2 Для ПЦР рекомендуется использовать готовые наборы реагентов (мастер-миксы). Приготовление реакционных смесей осуществляют с помощью микроцентрифуги-встряхивателя в соответствии с инструкциями изготовителей.
8.4.2.3 Подготовка проб
При проведении классической ПЦР с ОТ, ПЦР с ОТ в формате FLASH и ПЦР с ОТ в режиме реального времени из исследуемого образца растения, отобранного по 7.2.1, проводят выделение РНК с использованием наборов реагентов для выделения нуклеиновых кислот в соответствии с инструкциями изготовителей.
При проведении иммуноспецифической ПЦР с ОТ исследуемый образец растения, отобранный по 7.2.1, массой 1 г гомогенизируют в пластиковом контейнере с 20 см3 экстрагирующего буферного раствора по 7.1.1.3 (вариант 1) на гомогенизаторе в течение 2 - 5 мин или с помощью фарфоровой ступки и пестика до получения однородной суспензии.
8.4.3 Проведение исследования для универсального выявления всех изолятов потивируса шарки слив
8.4.3.1 ПЦР с ОТ
Для универсального выявления всех изолятов потивируса шарки слив используют пару праймеров Р1/Р2 или пару праймеров 3' NCR sense/3' NCR antisense (см. 6.5).
Реакцию ОТ проводят при термоциклических условиях, указанных в таблице 3.
Таблица 3 - Термоциклические условия для проведения реакции ОТ
|
Первый этап ОТ | |||
|
Реакция ОТ |
Режим ОТ | ||
|
Вода стерильная |
3 мм3 |
При температуре 70°С в течение 5 мин При температуре 4°С в течение 5 мин | |
|
Праймеры |
Random dN10 |
0, 5 мм3 | |
|
Oligo dT17 |
0, 5 мм3 | ||
|
РНК |
5 мм3 | ||
|
Второй этап ОТ | |||
|
Вода стерильная |
1 мм3 |
При температуре 40°С в течение 60 мин При температуре 70°С в течение 10 мин | |
|
5х буферный раствор для синтеза первой цепи кДНК |
4 мм3 | ||
|
dNTPs |
2 мм3 | ||
|
ДТТ |
2 мм3 | ||
|
Ревертаза MMLV |
2 мм3 | ||
Примечание - При использовании наборов реагентов с модифицированной ревертазой MMLV или ревертазой AMV термоциклические условия реакции корректируют в соответствии с инструкциями изготовителей.
ПЦР проводят на амплификаторе при термоциклических условиях, указанных в таблицах 4 и 5.
Таблица 4 - Термоциклические условия для ПЦР с ОТ с праймерами Р1/Р2
|
Температура, °С |
Время |
Число циклов |
|
95 |
15 мин |
1 |
|
95 60 72 |
30 с 30 с 1 мин |
35 |
|
72 |
10 мин |
1 |
|
4 |
Хранение |
- |
Таблица 5 - Термоциклические условия для ПЦР с ОТ с праймерами 3' NCR sense/3'NCR antisense
|
Температура, °С |
Время |
Число циклов |
|
95 |
15 мин |
1 |
|
95 61 72 |
30 с 30 с 1 мин |
35 |
|
72 |
10 мин |
1 |
|
4 |
Хранение |
- |
Примечание - При использовании комплектов реагентов с другими типами Taq-полимеразы термоциклические условия корректируют в соответствии с инструкциями изготовителей.
Анализ результатов ПЦР осуществляют с применением горизонтального электрофореза в 2%-ном агарозном геле. При положительном анализе обнаруживают ампликоны молекулярной массой 243 п.н. для пары праймеров Р1/Р2 или 220 п.н. для пары праймеров 3' NCR sense/3' NCR antisense.
Электрофорез продуктов амплификации
При электрофорезе продуктов амплификации готовят 2%-ный агарозный гель в буферном растворе 0, 5х ТАЕ по 7.1.3.2. Наносят капли загрузочного буферного раствора по 7.1.3.3 объемом 3 мм3 на пленку Парафилм, добавляют к капле 20 мм3 продукта амплификации и тщательно перемешивают, вносят продукты амплификации, включая положительный и отрицательный контроли, в лунки геля. В первую лунку геля вносят ДНК-маркер с молекулярной массой 100 п.н.
Проводят электрофорез в течение 20 мин при напряжении 120 В (для геля 15×10 см) или в течение 40 мин при напряжении 160 В (для геля 15×25 см) в буферном растворе 0, 5х ТАЕ. Погружают гель в раствор бромистого этидия по 7.1.3.4 на 20 мин. Просматривают гель на ультрафиолетовом трансиллюминаторе.
8.4.3.2 Иммуноспецифическая ПЦР с ОТ
Вносят иммуноглобулины в пробирки типа Эппендорф вместимостью 0, 5 см3. Для этого готовят рекомендуемое разведение специфичных поликлональных антител или моноклональных антител 5B-IVIA в карбонатном буферном растворе рН 9, 6.
Вносят по 100 мм3 раствора антител в каждую пробирку типа Эппендорф. Инкубируют в термостате 3 ч при температуре 37°С. Дважды промывают пробирки, используя 150 мм3 промывочного буферного раствора.
Готовят растительный экстракт с использованием экстрагирующего буферного раствора, осветляют 100 мм3 растительного экстракта центрифугированием (в течение 5 мин при скорости 2000 об/мин) и вносят в пробирки типа Эппендорф с адсорбированными антителами, инкубируют пробирки в течение 2 ч на льду или в термостате при температуре 37°С. Пробирки трижды промывают, используя 150 мм3 промывочного буферного раствора.
Проводят ОТ в соответствии с термоциклическими условиями, приведенными в таблице 3.
Готовят реакционную смесь для ПЦР в соответствии с 8.4.2.2 и вносят ее в пробирки с нанесенными антителами. ПЦР и анализ результатов проводят в соответствии с 8.4.3.1.
8.4.3.3 ПЦР с ОТ в режиме реального времени
ПЦР с ОТ в режиме реального времени на выявление потивируса шарки слив проводят с использованием соответствующих наборов реагентов в соответствии с инструкциями изготовителей.
8.4.3.4 ПЦР с ОТ в формате FLASH
ПЦР с ОТ в формате FLASH на выявление потивируса шарки слив проводят с использованием соответствующих наборов реагентов в соответствии с инструкциями изготовителей.
8.4.4 Проведение исследования для идентификации штаммов потивируса шарки слив
Идентификацию штаммов PPV-D, PPV-M, PPV-Rec, PPV-C, PPV-CR и PPV-W потивируса шарки слив проводят методом ПЦР с ОТ.
8.4.4.1 Идентификация штаммов PPV-D и PPV-M
Для специфического выявления штамма PPV-D используют пару праймеров P1/PD (см. 6.5).
Для специфического выявления штамма PPV-M используют пару праймеров Р1/РМ (см. 6.5).
Проводят ОТ в соответствии с термоциклическими условиями, приведенными в таблице 3.
Реакционную смесь для ПЦР готовят в соответствии с 8.4.2.2.
ПЦР проводят на амплификаторе при термоциклических условиях, указанных в таблице 6.
Таблица 6 - Термоциклические условия для ПЦР с ОТ с праймерами P1/PD и Р1/РМ
|
Температура, °С |
Время |
Число циклов |
|
95 |
15 мин |
1 |
|
95 60 72 |
30 с 30 с 1 мин |
35 |
|
72 |
10 мин |
1 |
|
4 |
Хранение |
- |
Примечание - При использовании наборов реагентов с другими типами Taq-полимеразы термоциклические условия корректируют в соответствии с инструкциями изготовителей.
Анализ результатов ПЦР осуществляют с применением горизонтального электрофореза в 2%-ном агарозном геле. При положительном анализе обнаруживают ампликоны молекулярной массой 198 п. н.
8.4.4.2 Идентификация штамма PPV-Rec
Для специфического выявления штамма PPV-Rec используют пару праймеров mD5/mM3 (см. 6.5).
Проводят ОТ в соответствии с термоциклическими условиями, приведенными в таблице 3.
Реакционную смесь для ПЦР готовят в соответствии с 8.4.2.2.
ПЦР проводят на амплификаторе при термоциклических условиях, указанных в таблице 7.
Таблица 7 - Термоциклические условия для ПЦР с ОТ с праймерами mD5/mM3
|
Температура, °С |
Время |
Число циклов |
|
95 |
15 мин |
1 |
|
95 60 72 |
30 с 30 c 1 мин |
35 |
|
72 |
10 мин |
1 |
|
4 |
Хранение |
- |
Примечание - При использовании комплектов реагентов с другими типами Taq-полимеразы термоциклические условия корректируют в соответствии с инструкциями изготовителей.
Анализ результатов ПЦР осуществляют с применением горизонтального электрофореза в 2%-ном агарозном геле. При положительном анализе обнаруживают ампликоны молекулярной массой 605 п.н.
8.4.4.3 Идентификация штамма PPV-C
Для специфического выявления штамма PPV-C используют пару праймеров CSoC-2/HSoC-2 (см. 6.5).
ОТ проводят в соответствии с термоциклическими условиями, приведенными в таблице 3.
Реакционную смесь для ПЦР готовят в соответствии с 8.4.2.2.
ПЦР проводят на амплификаторе при термоциклических условиях, указанных в таблице 8.
Таблица 8 - Термоциклические условия для ПЦР с ОТ с праймерами CSoC-2/HSoC-2
|
Температура, °С |
Время |
Число циклов |
|
95 |
15 мин |
1 |
|
95 62 72 |
30 с 30 с 30 с |
35 |
|
72 |
5 мин |
1 |
|
4 |
Хранение |
- |
Примечание - При использовании комплектов реагентов с другими типами Taq-полимеразы термоциклические условия корректируют в соответствии с инструкциями изготовителей.
Анализ результатов ПЦР осуществляют с применением горизонтального электрофореза в 2%-ном агарозном геле. При положительном анализе обнаруживают ампликоны молекулярной массой 193 п. н.
8.4.4.4 Идентификация штамма PPV-CR
Для специфического выявления штамма PPV-CR используют пару праймеров CR8597F/CR9023R (см. 6.5).
Проводят ОТ в соответствии с термоциклическими условиями, приведенными в таблице 3.
Реакционную смесь для ПЦР готовят в соответствии с 8.4.2.2.
ПЦР проводят на амплификаторе при термоциклических условиях, указанных в таблице 9.
Таблица 9 - Термоциклические условия для ПЦР с ОТ с праймерами CR8597F/CR9023R
|
Температура, °С |
Время |
Число циклов |
|
95 |
15 мин |
1 |
|
95 55 72 |
30 с 30 с 1 мин |
35 |
|
72 |
10 мин |
1 |
|
4 |
Хранение |
- |
Примечание - При использовании комплектов реагентов с другими типами Taq-полимеразы термоциклические условия корректируют в соответствии с инструкциями изготовителей.
Анализ результатов ПЦР осуществляют с применением горизонтального электрофореза в 2%-ном агарозном геле. При положительном анализе обнаруживают ампликоны молекулярной массой 427 п. н.
8.4.4.5 Идентификация штамма PPV-W
Для специфического выявления штамма PPV-W используют пару праймеров W8328F/W8711R (см. 6.5).
Проводят ОТ в соответствии с термоциклическими условиями, приведенными в таблице 3.
Реакционную смесь для ПЦР готовят в соответствии с 8.4.2.2.
ПЦР проводят на амплификаторе при термоциклических условиях, указанных в таблице 10.
Таблица 10 - Термоциклические условия для ПЦР с ОТ с праймерами W8328F/W8711R
|
Температура, °С |
Время |
Число циклов |
|
95 |
15 мин |
1 |
|
92 62 72 |
30 с 30 с 1 мин |
35 |
|
72 |
10 мин |
1 |
|
4 |
Хранение |
- |
Примечание - При использовании комплектов реагентов с другими типами Taq-полимеразы термоциклические условия корректируют в соответствии с инструкциями изготовителей.
Анализ результатов ПЦР осуществляют с применением горизонтального электрофореза в 2%-ном агарозном геле. При положительном анализе обнаруживают ампликоны молекулярной массой 384 пар п. н.
9 Требования к протоколу исследования
Протокол исследования должен включать следующую информацию:
- латинское наименование идентифицированного вредного организма;
- дату выявления и идентификации вредного организма;
- код или номер образца (для возможности отслеживания);
- природу зараженного материала, в том числе, по возможности, латинское наименование растения-хозяина;
- происхождение (включая географическое местонахождение, если оно известно) зараженного материала и место его задержания или выявления вредного организма;
- описание признаков или симптомов (включая фотографии в соответствующих случаях, или указание об их отсутствии);
- методы выявления и идентификации вредного организма, а также результаты, полученные с помощью каждого метода;
- документирование результатов исследований, например, фотографии диагностических гелей или распечатка результатов ИФА, на которых основывалось исследование;
- в случае необходимости, масштабы заражения (процент зараженных образцов, относительная концентрация вируса);
- наименование лаборатории и, при необходимости, фамилию лица (лиц), ответственного(ых) за исследование и/или выполнившего исследование;
- комментарии о степени точности идентификации.
_____________________________
* В Российской Федерации действует ГОСТ Р 12.1.019-2009 "Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты".
** В Российской Федерации действует ГОСТ Р 55878-2013 "Спирт этиловый технический гидролизный ректификованный. Технические условия".
Приложение А
(справочное)
Общие сведения
о потивирусе шарки слив
А.1 Общие сведения
Таксономическое положение: Viruses: Potyviridae: Potyvirus.
Наименование: Plum pox virus.
Синонимы: Sharka virus.
Plum pox potyvirus.
Prunus virus 7.
Annulus pruni.
Prunus broad streak and ringspot variegation virus.
Общепринятые наименования: PPV.
Sharka, plum pox (англ.).
Variole du prunier (франц.).
Scharka-Krankheit (нем.).
Vaiolatura delle drupacee (итал.).
Компьютерный код Байера: PPV000.
Фитосанитарный статус*:
Европейская и Средиземноморская организации по карантину и защите растений - А2;
Комиссия по защите растений для Азиатско-Тихоокеанского региона - А2;
Страны Восточной Африки - А1;
Страны Южной Африки - А1;
Аргентина - А1;
Бразилия - А1;
Израиль - статус карантинного объекта;
Казахстан - А1;
Канада - А1;
Новая Зеландия - статус карантинного объекта;
Норвегия - статус карантинного объекта;
Парагвай - А1;
Россия - А2;
США - статус карантинного объекта;
Турция - А2;
Узбекистан - А1;
Украина - А2;
Уругвай - А1;
Чили - А2.
А.2 Биологические особенности
Потивирус шарки слив представляет собой нитевидный вирус с частицами от 660 до 770 нм длиной и от 12, 5 до 20, 0 нм шириной.
Точка термической инактивации потивируса шарки слив в соке табака Кливленда Nicotiana clevelandii составляет от 51°С до 54°С, а в соке мари вонючей Chenopodium foetidum - от 45°С до 47°С, точка конечного разведения – 10-4, инфекционность в соке теряется при 20°С в течение одного - двух дней.
Вирионы потивируса шарки слив содержат 7% нуклеиновой кислоты и единственный белок оболочки. Молекулярная масса белка оболочки составляет от 36 до 38 кДа по анализам методом электрофореза, или от 36, 3 до 36, 7 кДа - по расчету последовательности нуклеотидов.
Геном потивируса шарки слив представляет собой одну молекулу однонитевой РНК величиной около 10000 нуклеотидов, с поли-(А)-трактом на 3'-конце и ковалентносвязанным белком на 5'-терминусе. РНК транслирует большой полипротеин молекулярной массой 355 кДа, который расщепляется тремя кодируемыми вирусом протеазами (Р1-Pro, НС-Pro и Nla-Pro) на 10 функциональных белков с меньшей молекулярной массой.
В цитоплазме зараженных листьев и плодов присутствуют протеиновые включения типа вертушек.
В настоящее время все изоляты PPV подразделены на восемь штаммов: PPV-D (Dideron), PPV-M (Marcus), PPV-C (Cherry), PPV-CR (Cherry Russian), PPV-EA (El Amar), PPV-Rec (Recombinant), PPV-W (Winona) и PPV-T (Turkish).
Штаммы вируса шарки различаются по последовательности нуклеотидов вирусной РНК, антигенной специфичности, эпидемиологическим свойствам и патогенности для различных видов косточковых культур. Знание штаммового состава потивируса шарки слив необходимо для разработки стратегии борьбы с вирусом.
Наиболее распространены штаммы PPV-D и PPV-M.
Штамм PPV-M широко распространен в восточной части Средиземноморского бассейна, в Центральной и Юго-Восточной Европе, наиболее вредоносен для персика, но заражает также сливу.
Изоляты штамма PPV-D способны в естественных условиях заражать абрикос и сливу и достаточно редко распространяются с этих культур на персик. Штамм PPV-D распространен в Европе и выявлен в Аргентине, Казахстане, Канаде, Пакистане, Кипре, Китае, Тунисе, Соединенных Штатах Америки (далее - США) и Чили. Изоляты этого штамма менее эффективно переносятся тлями, что обуславливает их относительно медленное распространение в садах по сравнению с изолятами штамма PPV-M.
Штамм PPV-Rec объединяет группу изолятов, представляющих собой генетические рекомбинанты между штаммами PPV-M и PPV-D. Изоляты этого штамма достаточно широко распространены в Центральной и Восточной Европе, чаще всего заражают сливу и эффективно переносятся на эту культуру тлями-векторами.
Принадлежность изолятов к штамму PPV-C установлена в России, Белоруссии, Молдове, Венгрии, Хорватии и Италии на вишне и черешне. На других растениях рода Prunus PPV-C выявлен не был.
Штамм PPV-W обнаруживали в Канаде и в США на растениях сливы, импортированных из Украины, а также в Латвии, широко распространен в России на сливе и вишне войлочной, а также способен заражать абрикос и алычу.
Штамм PPV-EA имеет ограниченное распространение в Египте и в Турции.
Штамм PPV-T распространен в восточных провинциях Турции на сливе и представляет собой новую вариацию рекомбинантов между штаммами PPV-D и PPV-M.
Штамм PPV-CR идентифицирован на вишне в Самарской, Саратовской областях и Московской области России.
А.3 Поражаемые растения
Первоначально восприимчивыми к потивирусу шарки считались слива домашняя (Prunus domestica), алыча (Prunus cerasifera), слива трехлопастная (Prunus triloba) и абрикос (Prunus armeniaca). Затем была установлена восприимчивость к болезни персика (Prunus persica), черешни (Prunus avium), вишни обыкновенной (Prunus cerasus) и терна (Prunus spinosa).
Потивирус шарки слив был выявлен на ряде других диких и декоративных видах растений рода Prunus: слива американская (Prunus americana), миндаль (Prunus dulcis) гибриды миндаля и персика (Prunus amygdalopersica), абрикос Бриансона (Prunus brigantina), слива вишнеплодная Prunus divaricata), вишня железистая (Prunus glandulosa), абрикос тибетский (Prunus holosericena), слива садовая американская (Prunus hortulana), слива терновая (Prunus insititia), вишня японская (Prunus japonica), абрикос маньчжурский (Prunus mandschurica), слива морская (Prunus maritime), слива японская (Prunus mume), слива Мунсона (Prunus munsoniana), алыча краснолистная (Prunus pissardii), абрикос сибирский (Prunus sibirika), слива абрикосовая (Prunus simonii), слива китайская (Prunus salicina), вишня войлочная (Prunus tomentosa).
Экспериментальными растениями-хозяевами вируса являются также межвидовые гибриды Prunus - Prunus besseyi x Prunus munsomiana x Prunus salicina, Prunus cerasifera × Prunus munsoniana х Prunus angustifolia, Prunus cerasifera x Prunus spinosa, x Prunus munsoniana x Prunus triloba.
Иммунными к потивирусу шарки слив считаются следующие виды рода Prunus: вишня горькая (Prunus emarginata), вишня кустарниковая (Prunus fruticosa), лавровишня (Prunus laurocerasus), черемуха пенсильванская (Prunus pensylvanica), черемуха обыкновенная (Prunus padus), вишня Саржента (Prunus sargentii), черемуха поздняя (Prunus serotina), черемуха виргинская (Prunus virginiana), вишня едонская (Prunus yedoensis).
Искусственным путем вирус был перенесен на хмель (Humulus lupulus) и рябину (Sorbus domestica).
В качестве экспериментальных хозяев потивирус шарки слив известно более 100 видов травянистых растений различных семейств. Наибольшее значение из этих растений имеют сорняки-космополиты: амми большая (Ammi majus), пастушья сумка обыкновенная (Capsella bursa-pastovims), яснотка стеблеобъемлющая (Lamium amplexicaule), крестовник лесной (Senecio sylvaticus), крестовник клейкий (Senecio viscosus), крестовник обыкновенный (Senecio vulgaris), звездчатка средняя (Stellaria media), вероника персидская (Veronica persica), паслен черный (Solanun nigrum), лютик полевой (Ranunculus arvensis), клевер ползучий (Trifolium repens), томат обыкновенный (Lucopersicon esculentum), щавель воробьиный (Rumex acetosella), первоцвет весенний (Primula officinalis), осот полевой (Sonchus arvensis) и ряд других, которые могут являться потенциальными природными резерваторами потивируса шарки слив.
А.4 Способы переноса и распространения
Потивирус шарки слив способен переноситься неперсистентным способом следующими видами тлей: люцерновая тля (Aphis craccivora), ракитниковая тля (Aphis cytisorum), крыжовниковая тля (Aphis gossypi), бобовая тля (Aphis fabae), плющевая тля (Aphis hederae), спиреиная тля (Aphis spiraecola), чертополоховая тля (Brachycaudus cardui), гелихризовая тля (Brachycaudus helichrysi), черная персиковая тля (Brachycaudus persicaecola), сливово-тростниковая тля (Hyalopterus pruni), зеленая розанная тля (Macrosiphum rosae), зеленая персиковая тля (Myzus persicae), тля Дэвидсона (Myzus varians), хмелевая тля (Phorodon humuli), обыкновенная черемуховая тля (Rhopalosiphum padi).
Из них наиболее значительными векторами вируса считаются зеленая персиковая (Myzus persicae), гелихризовая (Brachycaudus helichrysi) и хмелевая (Phorodon humuli) тли. Определенное значение имеют также спиреиная тля (Aphis spiraecola), чертополоховая тля (Brachycaudus cardui), черная персиковая тля (Brachycaudus persicaecola) и тля Дэвидсона (Myzus varians), питающиеся на растениях рода Prunus. Остальные виды тлей являются экспериментэльными векторами потивируса шарки сливы и не питаются на растениях рода Prunus.
Эффективность распространения потивируса шарки слив тлями зависит от вида вектора, сорта и вида растения-хозяина и штамма самого вируса. Существуют также изоляты потивируса шарки слив, не переносящиеся тлями.
А.5 Географическое распространение
Степень распространенности и вредоносности потивируса шарки слив варьирует в зависимости от региона. В этом аспекте Европа может быть разделена на три зоны:
- первая зона - страны Центральной и Восточной Европы (Чехия, Словакия, Венгрия, Румыния, Болгария, Польша, страны бывшей Югославии), в которых потивирус шарки слив распространился давно и уровни зараженности по-прежнему остаются высокими.
- вторая зона - страны Северной и Западной Европы, в которых уровни заражения потивирусом шаркой слив отмечаются высокой гетерогенностью. В Германии, Австрии и Великобритании вирус широко распространен, во Франции встречается очагами, в Бельгии, Нидерландах, Швейцарии и Швеции очаги ликвидированы.
- третья зона - страны средиземноморского бассейна (Италия, Испания, Греция, Португалия, Албания, Турция, государства Северной Африки), в которых вирус появился сравнительно недавно, но наблюдается устойчивая тенденция к ее широкому распространению.
_____________________________
* По состоянию на начало 2015 г.
Приложение Б
(справочное)
Симптомы поражения потивирусом шарки слив
Б.1 На листьях сливы симптомы шарки появляются в виде широких колец, пятен, дуг или полос от светло-зеленого до бледно-желтого цвета на первых весенних листьях после достижения ими нормальных размеров. Количество и интенсивность проявления этих симптомов зависит от восприимчивости сорта, времени от начала заражения, погодных условий и штамма вируса. К концу вегетационного сезона у одних сортов симптомы на листьях частично или полностью маскируются, а у других - сохраняют свою интенсивность.
На плодах восприимчивых сортов потивирус шарки слив вызывает некрозы в виде вдавленных пятен, полос и дуг. Мякоть, расположенная под вдавленными пятнами, обычно окрашена в бурый или красноватый цвет и пропитана камедью. Характерный узор на плодах часто доходит до косточки, где после отделения мякоти можно наблюдать красновато-бурые пятна. Пораженные плоды мельче, чем здоровые, раньше окрашиваются, преждевременно созревают и начинают опадать за 20 - 30 дней до созревания основного урожая. На восприимчивых сортах может преждевременно осыпаться большая часть плодов.
Б.2 На листьях восприимчивых сортов сливы китайской (Prunus salicina) развиваются хлоротические кольца, пятна или крапчатость, которые затем могут некротизироваться. Не более 15% плодов на таких зараженных растениях могут иметь симптомы в виде колец, крапчатости, побуревших участков или некоторой деформации. Большинство сортов сливы японской штамм PPV-D заражает в латентной форме.
Б.3 Симптомы шарки слив на листьях абрикоса (Prunus armeniaca) напоминают симптомы у сливы, но у большинства сортов обычно встречаются лишь на отдельных листьях. Вскоре после распускания на листьях появляются светло-зеленые пятна и кольца, которые лучше различимы в проходящем свете. Вдоль главных жилок часто развивается светло-зеленое окаймление шириной 1 - 2 мм. На последующих листьях симптомы отсутствуют, поэтому зараженные листья необходимо выявлять у основания побегов. С наступлением жаркой погоды симптомы могут полностью маскироваться.
На плодах восприимчивых сортов абрикоса в период созревания развиваются светлоокрашенные пятна с более темной каймой. У наиболее восприимчивых сортов плоды деформируются, на их кожице появляются темные или некротические кольца и выпуклости неправильной формы. Некрозы конусообразно пронизывают мякоть и образуют на косточке отчетливые кольца. Пораженная мякоть плодов губчатая и безвкусная.
Б.4 Развитие симптомов на растениях персика (Prunus persica) зависит от штамма потивируса шарки слив. Большинство сортов персика при заражении штаммом PPV-D не образуют симптомов на листьях, но на их плодах могут развиваться хлоротические пятна, желтые кольца или линейный рисунок. Плоды деформируются, изменяют форму и имеют небольшие коричневые или некротические участки на кожице. Мякоть плодов буреет, их вкусовые качества снижаются, пораженные плоды могут преждевременно опадать.
Штамм PPV-M вызывает очень серьезную болезнь персика. На некоторых сортах может изменяться окраска лепестков. На распускающихся листьях развиваются симптомы в виде различной мозаичности, пятен, колец, хлоротического посветления и окаймления жилок, деформации листовых пластинок. Летом эти симптомы обычно маскируются. Симптомы на плодах обычно еще более ярко выражены, чем при заражении штаммом PPV-D.
Б.5 На листьях алычи (Prunus cerasifera) симптомы шарки весной имеют вид пятен, колец и полос различной формы. В жаркую погоду они маскируются. Для многих сортов характерна латентная инфекция. На плодах восприимчивых сортов развиваются вдавленные пятна и кольца различной интенсивности окраски, плоды могут деформироваться.
Б.6 На листьях вишни (Prunus cerasus) и черешни (Prunus avium) симптомы шарки проявляются в мае - июне в виде колец, пятен и крапчатости неправильной формы от светло-зеленого до кремово-желтого цвета. Обычно эти симптомы приурочены к жилкам у основания либо образуются на концах листовых пластинок. Некоторые из этих пятен затем некротизируются. У зараженных растений черешни наблюдается преждевременное и неравномерное созревание плодов. Эти плоды обычно меньшей величины, неправильной формы, деформированы (уплощены со стороны шва) и имеют более длинные плодоножки. Часть пораженных плодов чернеет и засыхает, а на остальных развиваются бледно-желтые кольцевые пятна. На полностью созревших плодах симптомы имеют вид очень мелких пятен, слегка вдавленных в мякоть. Рост и развитие зараженных растений вишни замедляется. На одном дереве одновременно можно наблюдать цветение, листообразование, завязывание и созревание плодов.
Б.7 На растениях вишни войлочной (Prunus tomentosa) потивирус шарки слив вызывает деформацию молодых листьев, на которых затем развиваются хлоротические пятна и некрозы. Незрелые плоды могут деформироваться, на зрелых плодах симптомы обычно маскируются.
Б.8 На листьях зараженных растений терна (Prunus spinose) развиваются диффузные пятна, кольца или рисунок типа дубового листа; иногда имеют место некротические пятна и кольца. На плодах симптомы обычно отсутствуют, изредка развиваются мелкие диффузные пятна и более светлая окраска. Обычной на терне является латентная инфекция потивируса шарки слив.
Приложение В
(справочное)
Иллюстрации симптомов поражения потивирусом шарки слив

Рисунок В.1 - Симптомы хлоротического рисунка на листьях сливы сорта Стенли, вызванные потивирусом шарки слив (Краснодарский край, Россия)

Рисунок В.2 - Листья сливы сорта Евразия-21 с симптомами кольцевой пятнистости, вызванными потивирусом шарки слив (Липецкая область, Россия)

Рисунок В.3 - Симптомы шарки слив на листьях сливы (Ростовская область, Россия)

Рисунок В.4 - Симптомы шарки слив (хлоротические пятна и кольца) на листьях сливы сорта Скороспелка красная (Московская область, Россия)

Рисунок В.5 - Симптомы шарки слив (хлоротические пятна, кольца, пожелтение жилок) на листьях алычи (Никитский ботанический сад)

Рисунок В.6 - Симптомы шарки слив на листьях абрикоса

Рисунок В.7 - Симптомы шарки слив на листьях персика

Рисунок В.8 - Симптомы шарки слив на цветках персика

Рисунок В.9 - Симптомы шарки слив на листьях вишни войлочной, внизу - здоровые листья (Московская область, Россия)

Рисунок В.10 - Лист черешни с симптомами хлоротического рисунка и деформации пластинки, зараженный штаммом PPV-C

Рисунок В.11 - Листья вишни с симптомами шарки слив (Самарская область, Россия)

Рисунок В.12 - Симптомы шарки на плодах сливы

Рисунок В.13 - Симптомы шарки слив на плодах и косточках плодов абрикоса

Рисунок В.14 - Симптомы шарки слив на плодах персика

Рисунок В.15 - Симптомы шарки слив на плодах персика
(Нет голосов) |
-
12.04.2024
Названы города России с самым доступным жильем
 Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
-
12.04.2024
Россиянам назвали лучшее время для продажи дачи
 Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
-
12.04.2024
Предсказано будущее рынка жилья в России
 «МК»: в России не отменят льготную ипотеку
«МК»: в России не отменят льготную ипотеку
-
12.04.2024
В Москве подешевела аренда квартир
 Аренда квартир в Москве подешевела на 10 %
Аренда квартир в Москве подешевела на 10 %
-
22.03.2024
Хуснуллин назвал необходимый размер ставки по ипотеке
 Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов