Введен в действие приказом Федерального агентства по техническому регулированию и метрологии от 9 июня 2016 г. N 596-ст
Межгосударственный стандарт ГОСТ 33771-2016
"СОЛЬ ПИЩЕВАЯ. РАСЧЕТНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ОСНОВНОГО ВЕЩЕСТВА ПО СОЛЕВОМУ СОСТАВУ"
Food common salt. Calculation method for determination (measurement) of the principal substance by saline composition
Дата введения - 1 июля 2017 г.
Введен впервые
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-2015 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2015 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 Подготовлен Федеральным государственным бюджетным научным учреждением "Всероссийский научно-исследовательский институт пищевых добавок" (ФГБНУ ВНИИПД)
2 Внесен Федеральным агентством по техническому регулированию и метрологии
3 Принят Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 29 марта 2016 г. N 86-П)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004-97
|
Код страны по МК (ИСО 3166) 004-97
|
Сокращенное наименование национального органа по стандартизации
|
|
Армения
|
AM
|
Минэкономики Республики Армения
|
|
Беларусь
|
BY
|
Госстандарт Республики Беларусь
|
|
Казахстан
|
KZ
|
Госстандарт Республики Казахстан
|
|
Киргизия
|
KG
|
Кыргызстандарт
|
|
Россия
|
RU
|
Росстандарт
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 9 июня 2016 г. N 596-ст межгосударственный стандарт ГОСТ 33771-2016 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2017 г.
5 Настоящий стандарт подготовлен на основе применения ГОСТ Р 54751-2011*
6 Введен впервые
1 Область применения
Настоящий стандарт распространяется на пищевую соль (далее - соль) и устанавливает расчетный метод определения массовой доли основного вещества (хлористого натрия) в диапазоне определения от 97, 00 до 99, 90% по солевому составу.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 13685-84 Соль поваренная. Методы испытаний
ГОСТ 13830-97 Соль поваренная пищевая. Общие технические условия
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Сущность метода
Метод основан на пересчете химического состава соли, измеренного в массовых долях ионов, в переводе их в определенной последовательности в солевой состав с последующим вычислением массовой доли хлористого натрия.
4 Требования к квалификации оператора
К выполнению расчетов допускается специалист, имеющий высшее или среднее специальное химическое образование.
5 Определение массовой доли хлористого натрия
5.1 Для вычисления массовой доли хлористого натрия XNaCl, %, проводят пересчет результатов измерений массовых долей отдельных ионов соли в последовательности (1 - 7), указанной в таблице 1.
Таблица 1
|
Анион
|
Катион
|
|
Ca2+
|
Mg2+
|
K+
|
Na+
|
|
SO42-
|
1-CaSO4
|
2-MgSO4
|
-
|
3-Na2SO4
|
|
Clˉ
|
4-CaCl2
|
5-MgCl2
|
6-KCl
|
7-NaCl
|
Массовую долю j-компонента Xj, %, вычисляют по формуле:
Xj=Xi·Kпер.,
(1)
где Xi - известная массовая доля i-компонента, определяемая по ГОСТ 13685 (пункты 2.4, 2.5, 2.6, 2.7, 2.8, 2.14, 2.15), %;
Kпер. - коэффициент пересчета.
5.2 Для пересчета используют коэффициенты, приведенные в таблице 2.
Таблица 2
|
N п/п
|
Наименование i-компонента
|
Наименование j-компонента
|
Kпер.
|
|
1
|
Са
|
SO4
|
2, 3966
|
|
2
|
Са
|
CaSO4
|
3, 3966
|
|
3
|
SO4
|
CaSO4
|
1, 4172
|
|
4
|
SO4
|
Ca
|
0, 4172
|
|
5
|
Mg
|
SO4
|
3, 9522
|
|
6
|
Mg
|
MgSO4
|
4, 9522
|
|
7
|
SO4
|
Mg
|
0, 2530
|
|
8
|
SO4
|
MgSO4
|
1, 2530
|
|
9
|
SO4
|
Na2SO4
|
1, 4787
|
|
10
|
Ca
|
2CI
|
1, 7691
|
|
11
|
Ca
|
CaCl2
|
2, 7691
|
|
12
|
Mg
|
2CI
|
2, 9173
|
|
13
|
Mg
|
MgCl2
|
3, 9173
|
|
14
|
К
|
CI
|
0, 9067
|
|
15
|
К
|
KCI
|
1, 9067
|
|
16
|
CI
|
Na
|
0, 6485
|
|
17
|
CI
|
NaCI
|
1, 6485
|
5.3 Схема расчетов массовой доли хлористого натрия в соли
В зависимости от содержания иона SO42- - в соли используют одну из схем расчета.
Все схемы расчетов начинаются с вычисления отношения массовых долей ионов сульфата и кальция 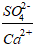 .
.
Примечание - Схема расчетов с целью упрощения приведена без обозначения массовой доли X и единицы измерения %.
Схема I
Если 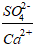 > 2, 3966, то весь Ca2+ связан с SO42- в CaSO4, а оставшиеся ионы SO42- связываются последовательно с Mg2+ в MgSO4, и если SO42- хватает, то и с Na+ в Na2SO4.
> 2, 3966, то весь Ca2+ связан с SO42- в CaSO4, а оставшиеся ионы SO42- связываются последовательно с Mg2+ в MgSO4, и если SO42- хватает, то и с Na+ в Na2SO4.
а) Вычисляют CaSO4 в соли:
CaSO4=Ca2+·3, 3966.
б) Вычисляют SO42-, связанные с Mg2+ и Na+:
SO42-(Mg, Na)=SO42--Ca2+·2, 3966.
в) Находят SO42-, связанный с Mg2+:
SO42-(Mg)=Mg2+·3, 9522
и сравнивают с SO42-(Mg, Na).
1 вариант схемы I
Если SO42-(Mg, Na)>SO42-(Mg), то весь Mg2+ находится в виде MgSO4, а оставшаяся часть SO42- связана в Na2SO4.
а) Вычисляют MgSO4 в соли:
MgSO4=Mg2+·4, 9522;
SO42-(Na)=SO42--[Ca2+·2, 3966+Mg2+·3, 9522].
б) Вычисляют Na2SO4 в соли:
Na2SO4=SO42-(Na)·1, 4787.
в) Вычисляют KCI в соли:
KCl=K+·1, 9067.
г) Вычисляют катион Na+:
Na+=(Clˉ- Clˉ(K))·0, 6485,
где Clˉ(K)=K+·0, 011.
д) Вычисляют массовую долю:
NaCl=(Clˉ- Clˉ(K))·1, 6485.
2 вариант схемы I
Если SO42-(Mg, Na)<SO42-(Mg), то часть Mg2+ связана SO42-- в MgSO4, оставшаяся часть Mg2+ связана с Clˉ в MgCl2, a Na2SO4 в соли отсутствует.
а) Вычисляют Mg2+, связанных с SO42-- в MgSO4:
Mg2+(SO4)=[SO42--Ca2+·2, 3966]·1, 2530;
MgSO4 в соли:
MgSO4=[SO42--Ca2+·2, 3966]·1, 2530 .
б) Вычисляют Clˉ, связанных с Mg2+ в MgCl2:
2Clˉ(Mg)=[Mg2+-Mg2+(SO4)]·2, 9173;
MgCl2 в соли:
MgCl2=[Mg2+-(SO42--Ca2+·2, 3966)·0, 2530]·3, 9173.
в) Вычисляют Clˉ, связанных с K+ в KCI:
Clˉ(K)=K+·0, 9067;
KCI в соли:
KCl=K+·1, 9067.
г) Вычисляют Clˉ, связанных с Na+ в NaCI:
Na+=Clˉ(Na)·0, 6485;
NaCl=[Clˉ- Clˉ(Mg)- Clˉ(K)]·1, 6485.
Схема II
Если 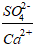 > 2, 3966, то все сульфаты связаны с Ca2+ в CaSO4, а оставшиеся ионы связаны с Clˉ в CaCl2.
> 2, 3966, то все сульфаты связаны с Ca2+ в CaSO4, а оставшиеся ионы связаны с Clˉ в CaCl2.
а) Вычисляют CaSO4 в соли:
CaSO4=SO42-·1, 4172.
Вычисляют Clˉ(Ca) - хлорид-ионов, связанных с Ca2+:
Clˉ(Ca)=[Ca2+-SO42-·0, 4172]·1, 7691.
Вычисляют CaCl2 в соли:
CaCl2=[Ca2+-SO42-·0, 4172]·2, 7691.
б) Вычисляют Clˉ-ионов, связанных с Mg2+:
2Clˉ(Mg)=Mg2+·2, 9173.
Вычисляют MgCl2 в соли:
MgCl2=Mg2+·3, 9173.
в) Вычисляют Clˉ-ионов, связанных с K+:
Clˉ(K)=K+·0, 9067.
Вычисляют KСl в соли:
KCl=K+·1, 9067.
г) Вычисляют Clˉ, связанных с Na+:
Clˉ(Na)=[Clˉ(общ)- Clˉ(Ca)- Clˉ(Mg)- Clˉ(K)].
Вычисляют NaCI в соли:
NaCl=[Clˉ(общ)- Clˉ(Ca)- Clˉ(Mg)- Clˉ(K)]·1, 6485.
Схема III
Если 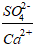 = 2, 3966, то все сульфаты связаны с Ca2+ в CaSO4 без остатка.
= 2, 3966, то все сульфаты связаны с Ca2+ в CaSO4 без остатка.
а) Вычисляют CaSO4 в соли:
CaSO4=Ca2+·3, 3966 или CaSO4=SO42-·1, 4172.
б) Вычисляют Clˉ, связанных с Mg2+:
2Clˉ(Mg)=Mg2+·2, 9173.
Вычисляют MgCl2 в соли:
MgCl2=Mg2+·3, 9173.
в) Вычисляют Clˉ, связанных с K+:
Clˉ(K)=K+·0, 9067.
Вычисляют KCI в соли:
KCl=K+·1, 9067.
г) Вычисляют NaCI в соли:
NaCl=[Clˉ(общ)- Clˉ(Mg)- Clˉ(K)]·1, 6485.
Вычисление проводят до третьего десятичного знака.
За окончательный результат расчета массовой доли хлористого натрия принимают значение до второго десятичного знака.
6 Проверка правильности результатов расчета
Проверку проводят путем сравнения суммы массовых долей ионов ∑Xионов и суммы массовых долей солей ∑Xсолей.
Полученные значения сумм округляют до первого десятичного знака.
Результат проверки признают удовлетворительным, если ∑Xионов = ∑Xсолей.
7 Метрологические характеристики
Метрологические характеристики метода определений массовой доли хлористого натрия приведены в таблице 3.
Таблица 3
|
Диапазон определения массовой доли хлористого натрия XNaCl, %
|
Границы абсолютной погрешности Δ, %, при Р = 95%
|
|
От 97, 00 до 99, 90 включ.
|
0, 60
|
|
Примечание - Диапазоны и показатели точности измерения хлористого натрия соответствуют его нормируемым значениям по ГОСТ 13830.
|
* Приказом Федерального агентства по техническому регулированию и метрологии от 9 июня 2016 г. N 596-ст отменен с 1 июля 2017 г.
Приложение А
(справочное)
Примеры расчетов
Пример 1
При анализе пробы соли получены следующие результаты:
Массовая доля: нерастворимый остаток (Н.О.) = 0, 21%; Ca2+ = 0, 34%; Mg2+ = 0, 02%; K+ = 0, 011%; SO42- = 0, 94%; Clˉ= 59, 54%.
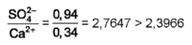 .
.
CaSO4=0, 34·3, 3966=1, 15%.
SO42-(Mg, Na)=0, 94-0, 34·2, 3966=0, 125.
SO42-(Mg)=0, 02·3, 9522=0, 079.
SO42-(Mg, Na)>SO42-(Mg), поэтому рассчитываем:
MgSO4=0, 02·4, 9522=0, 099%.
Na2SO4=[0, 125-0, 079]·1, 4787=0, 07%.
KCl=0, 011·1, 9067=0, 021%.
Na+=(Clˉ- Clˉ(K))·0, 6485=[59, 54-0, 011·0, 9067]·0, 6485=38, 61%.
NaCl=(Clˉобщ- Clˉ(K))·1, 6485=[59, 54-0, 011·0, 9067]·1, 6485=98, 14%,
Проверка:
∑Xионов = 0, 34 + 0, 02 + 0, 011 + 0, 94 + 59, 54 + 38, 61 = 99, 46% = 99, 5%.
∑Xсолей = 1, 15 + 0, 099 + 0, 07 + 0, 021 + 98, 14 = 99, 48% = 99, 5%.
∑Xионов = ∑Xсолей, результат проверки удовлетворительный.
Пример 2
При анализе пробы соли получены следующие результаты:
Массовая доля: Н.О. = 0, 76%; Ca2+ = 0, 43%; Mg2+ = 0, 04%; K+ = 0, 87%; SO42- = 1, 07%; Clˉ= 58, 95%.
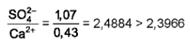 .
.
CaSO4=0, 43·3, 3966=1, 46%,
SO42-(Mg, Na)=1, 07-0, 43·2, 3966=0, 039.
SO42-(Mg)=0, 04·3, 9522=0, 158.
SO42-(Mg)>SO42-(Mg, Na), поэтому рассчитываем MgSO4, исходя из содержания оставшегося SO42-:
MgSO4=0, 04·1, 2530=0, 05%.
Mg2+(SO4)=0, 04·0, 2530=0, 010.
Mg2+(Cl)=0, 04-0, 01=0, 03.
MgCl2=0, 03·3, 9173=0, 12%.
KCl=0, 87·1, 9067=1, 66%.
Na+=(Clˉобщ- Clˉ(Mg)- Clˉ(K))·0, 6485=[58, 95-0, 03·2, 9173-0, 87·0, 9067]·0, 6485=37, 66%,
NaCl=[58, 95-0, 09-0, 79]·1, 6485=95, 73%.
Проверка:
∑Xионов = 0, 43 + 0, 04 + 0, 87 + 1, 07 + 58, 95 + 37, 66 = 99, 02% = 99, 0%.
∑Xсолей = 1, 46 + 0, 05 + 0, 12 + 1, 66 + 95, 73 = 99, 02% = 99, 0%.
∑Xионов = ∑Xсолей, результат проверки удовлетворительный.
![]() — Все документы — ГОСТы — ГОСТ 33771-2016 СОЛЬ ПИЩЕВАЯ. РАСЧЕТНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ОСНОВНОГО ВЕЩЕСТВА ПО СОЛЕВОМУ СОСТАВУ
— Все документы — ГОСТы — ГОСТ 33771-2016 СОЛЬ ПИЩЕВАЯ. РАСЧЕТНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ОСНОВНОГО ВЕЩЕСТВА ПО СОЛЕВОМУ СОСТАВУ Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
 Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
 «МК»: в России не отменят льготную ипотеку
«МК»: в России не отменят льготную ипотеку
 Аренда квартир в Москве подешевела на 10 %
Аренда квартир в Москве подешевела на 10 %
 Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов